微小RNA在动脉粥样硬化中的研究进展
2022-06-29李兰芳欧阳雪倩
李兰芳, 欧阳雪倩, 陈 薇
(南华大学衡阳医学院药学院药物药理研究所,湖南省衡阳市421001)
动脉粥样硬化(atherosclerosis,As)斑块形成是以脂质积累、血管局部炎症反应、平滑肌细胞增殖、细胞凋亡、坏死以及纤维化为主要特征。微小RNA(microRNA,miRNA)可以通过影响血管内皮细胞功能、增殖与迁移、炎症反应和脂质代谢等过程来影响As的发生、发展及预后[1]。本文就目前miRNA在As病程中的研究进展进行综述。
1 miRNA与血管内皮细胞
As的进展通常伴随着内膜的过度纤维化、炎症反应的级联、脂质斑块的形成。miRNA可以通过多种信号通路调控血管内皮细胞的功能,进而影响As的进程。见表1。

表1 参与调控血管内皮细胞的miRNA与As的关系
1.1 miRNA与血管内皮细胞凋亡
血管内皮细胞凋亡在As的发生、发展中起着至关重要的作用。内皮细胞凋亡是导致斑块不稳定的重要原因,内皮细胞死亡可能导致动脉血栓形成,从而导致急性冠状动脉闭塞和猝死。miRNA是参与内皮细胞凋亡的关键调节因子。miR-126是内皮细胞凋亡小体中含量最丰富的miRNA。它通过靶向抑制G蛋白信号通路调节因子-16(regulator of G-protein signaling-16,RGS16)诱导基质细胞衍生因子-1(stromal cell derivedfactor-1,SDF-1)的表达,并以miR-126依赖的方式保护小鼠免受As的影响。也有报道证明miR-126通过靶向激活磷酸肌醇3-激酶/蛋白激酶B(phospho-inositide 3-kinase/protein kinase B,PI3K/Akt)信号通路抑制血管内皮细胞凋亡[4-5]。miR-185-3p上调可以促进As病理发展,促进血管内皮细胞凋亡。Smad7(small mothers against decapentaplegic 7,Smad7)是miR-185-3p的靶基因,miR-185-3p抑制Smad7的表达[2]。
氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)是As发展的主要危险因素。miR-217-5p靶向氯离子通道蛋白4(chloride intracellular channel protein,CLIC4)抑制ox-LDL诱导的血管内皮细胞凋亡[6]。另一种叫做miR-106b的miRNA可以逆转ox-LDL诱导的细胞凋亡;潜在的机制涉及靶向抑制张力蛋白同源物基因(phosphatase and tensin homolog,PTEN)的表达而激活PI3K/Akt通路[7]。miR-338-3p通过靶向骨形态发生蛋白和激活素膜结合抑制剂(BMP and activin membrane-bound inhibitor,BAMBI)激活转化生长因子-β/Smad(transforming growth factor-β/small mothers against decapentaplegic,TGF-β/Smad)通路促进ox-LDL诱导的内皮细胞凋亡[3]。miR-410抑制人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)增殖并通过激活信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)抑制ox-LDL诱导的细胞凋亡[8]。
1.2 miRNA与血管内皮细胞衰老
细胞衰老分为复制性衰老和应激诱导衰老。正常的体细胞进入生长停滞状态失去复制能力称为复制性衰老。暴露在氧化应激、过氧化氢或低氧环境中,诱导细胞衰老,这被称为应激诱导衰老[22]。血管内皮细胞的衰老在As中起着重要作用。在内皮细胞的复制性衰老过程中,miR-22通过下调血管抑制素-1(Vasohibin-1)的表达而加速衰老过程[9]。在应激诱导的内皮细胞衰老过程中,miR-221通过抑制内皮细胞一氧化氮生成和激活核因子κB(Nuclear factor κB,NF-κB)信号来促进人动脉内皮细胞衰老[10]。氧化应激诱导miR-200C表达增加,通过靶向E盒结合锌指蛋白1(zinc finger E-box binding homeobox 1,ZEB1)抑制内皮细胞凋亡和衰老[14]。
沉默信息调节因子1(silence information regulator 1,SIRT1)是一种长寿基因,保护细胞免受氧化应激和遗传毒性[23]。研究表明肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)可以上调miR-155,通过靶向抑制SIRT1的表达来介导人脐静脉内皮细胞的衰老[11]。miR-217和miR-21通过减少内皮细胞中SIRT1的表达来促进衰老[12]。而let-7g通过增加SIRT1蛋白水平来拮抗内皮细胞衰老的作用[13]。
1.3 miRNA与血管内皮细胞增殖
血管内皮细胞的增殖在促进内皮愈合和改善血管功能的过程中至关重要。miRNA参与内皮细胞增殖过程。miR-143-3p通过直接靶向自噬相关蛋白2同源物B(autophagy-related protein 2 homolog B,ATG2B)下调自噬发生的水平,而显著促进内皮祖细胞的增殖和迁移[15]。此外,miR-487a过表达通过直接靶向抑制CREB结合蛋白(CREB binding protein,CBP)和p53蛋白的表达促进血管内皮细胞的增殖[16]。
一些miRNA发挥抑制内皮细胞增殖的作用。miR-126通过调节低氧诱导因子-1α(hypoxia-Inducible factor-1α,HIF-1α)抑制内皮细胞增殖[17]。糖尿病介导的miR-139-5p高表达抑制了转录调节因子c-Jun-血管内皮生长因子/血小板衍生生长因子亚基B(c-Jun-vascular endothelial growth factor/platelet derived growth factor subunit B,c-Jun-VEGF/PDGF-B)通路,从而减少内皮细胞的增殖和迁移[18]。
1.4 miRNA与血管内皮细胞炎症
As是一种具有慢性炎症反应特征的病理过程,血管内皮细胞在引发动脉炎症反应中调节内皮细胞的炎症反应,可能是As治疗的靶点之一。miRNA参与调控血管内皮细胞炎症。miR-126过表达激活了SIRT1/核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)信号通路,一些炎症因子如TNF-α、白细胞介素-6(interleukin-6,IL-6)等表达下降,从而抑制HUVEC氧化应激和炎症反应[21]。miR-21抑制过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor-α,PPARα)的翻译,通过提高激活子蛋白-1(activator protein 1,AP-1)的活性,诱导血管细胞黏附分子1(vascular adhesion molecule 1,VCAM1)和趋化因子2(C-C Motif chemokine ligand 2,CCL2)的表达,从而促进血管内皮细胞炎症[19]。miR-155通过靶向抑制BMAL1诱导As中内皮细胞凋亡和炎症反应,促进As的发展[20]。
2 miRNA与血管平滑肌细胞
在As形成过程中,首先表现为脂质沉积于血管壁,然后巨噬细胞吞噬这些脂质,逐渐泡沫化,继而平滑肌细胞增殖生长。平滑肌细胞形态、生理生化的变化与As密切相关。miRNA通过多种信号通路调控血管平滑肌细胞的功能。见表2。
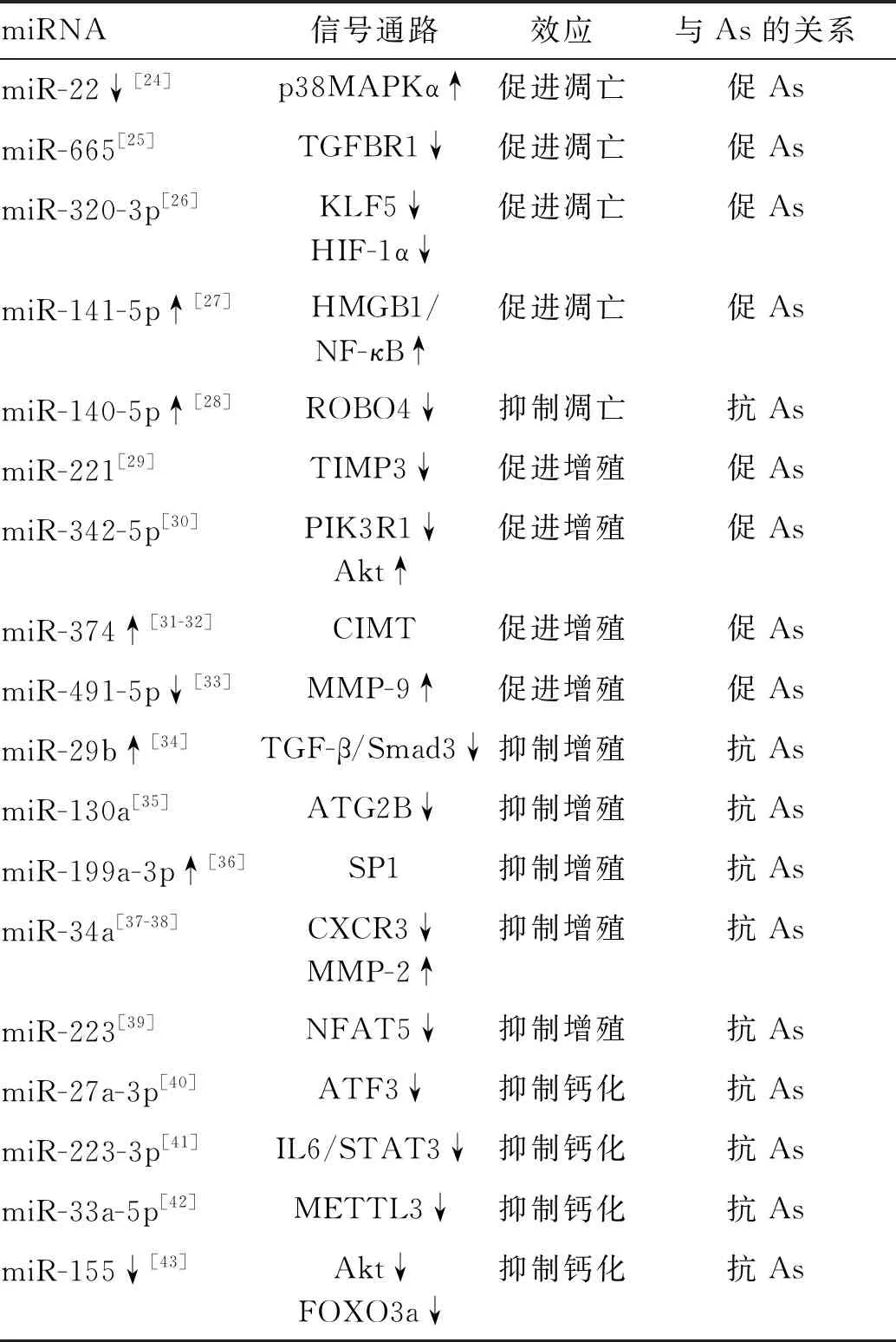
表2 参与调控血管平滑肌细胞的miRNA与As的关系
2.1 miRNA与血管平滑肌细胞的凋亡与衰老
血管平滑肌细胞(vascular smooth muscle cell,VSMC)的凋亡和衰老已被认为是As疾病的重要过程。下调miR-22直接靶向p38丝裂原活化蛋白激酶α(p38 mitogen-activated protein kinase α,p38MAPKα)引起VSMC的凋亡[24]。miR-665通过靶向转化生长因子β受体1(transforming growth factor beta receptor 1,TGFBR1)参与VSMC的凋亡[25]。miR-320-3p通过调节Kruppel样因子5(Kruppel-like factor 5,KLF5)和HIF-1α的表达调控缺氧条件下诱导的肺动脉平滑肌细胞的凋亡[26]。此外,miR-140-5p通过靶向环形交叉轴突导向受体同源物4(roundabout guidance receptor 4,ROBO4)基因表达调控As中VSMC的凋亡[28]。miR-141-5p过表达激活高迁移率族蛋白B1(high mobility group protein box-1,HMGB1)/NF-κB通路促进VSMC的凋亡[27]。
2.2 miRNA与血管平滑肌的增殖和迁移
在天然血管中,VSMCs维持在静止/收缩、非迁移和非增殖状态。当血管机械损伤时,VSMC转变为去分化/合成表型,并增强其增殖、迁移和产生细胞外基质的能力,从而促进As的发展。
一些miRNA可以促进VSMC的增殖和迁移。miR-221通过靶向基质金属蛋白酶组织抑制剂-3(tissue inhibitor of metalloproteinases-3,TIMP3)促进肺动脉平滑肌细胞增殖和迁移[29]。miR-342-5p通过下调磷脂酰肌醇3-激酶调节亚基α(phosphatidylinositol 3-kinase regulatory subunit α,PIK3R1)来激活Akt信号通路,促进VSMC的增殖[30]。miR-374是一种As的潜在诊断生物标志物,miR-374过表达显著促进VSMC的增殖和迁移,其潜在机制与颈动脉内膜中膜厚度(carotid intima-media thickness,CIMT)相关[31-32]。miR-491-5p下调显著促进VSMC的增殖和迁移,其靶点是基质金属蛋白酶9(matrix metallopeptidase-9,MMP-9)[33]。
一些miRNA可以抑制VSMC的增殖和迁移。miR-29b通过靶向TGF-β/Smad3信号通路抑制VSMC增殖[34]。miR-130a通过靶向ATG2B下调自噬的水平,抑制VSMC的增殖[35]。miR-199a-3p过表达靶向基本转录因子(transcriptional factor 1,SP1)抑制VSMC增殖和迁移[36]。miR-34a抑制VSMC的迁移,趋化因子受体3(C-X-C motif chemokine receptor 3,CXCR3)是miR-34a调节VSMC表型转换的直接靶点,而CXCR3通过共享共同的miR-34a靶点,通过竞争性内源性RNA调节增加基质金属蛋白酶2(matrix metallopeptidase-2,MMP-2)的表达水平[37-38]。miR-223通过靶向活化T细胞核因子5(nuclear factor of activated T cells 5,NFAT5)抑制血小板衍生生长因子诱导的人主动脉平滑肌细胞的增殖[39]。
2.3 miRNA与血管平滑肌细胞的钙化
血管钙化常见于As、糖尿病和慢性肾脏疾病的患者。血管钙化涉及VSMC向成骨细胞样细胞的分化和重编程,这些成骨细胞样的VSMC产生并释放钙化基质小泡。血管钙化过程受到严格调控,而miRNA在这一过程中发挥不可或缺的作用。
miR-27a-3p抑制激活转录因子3(activating transcription factor 3,ATF3)的表达,从而减少VSMC的钙化[40]。miR-223-3p通过阻断IL-6/STAT3信号通路抑制VSMC钙化[41]。miR-33a-5p通过靶向甲基转移酶样蛋白3(methyltransferase like 3,METTL3)抑制ox-LDL诱导的VSMC钙化[42]。下调miR-155导致Akt磷酸化和叉头框蛋白O3a(forkhead box protein O3a,FOXO3a)降解,从而减弱血管钙化,减少钙化诱导的VSMC凋亡[43]。
3 小 结
miRNA可以通过影响血管内皮细胞功能、平滑肌细胞增殖与迁移、炎症反应和钙化等过程来影响As的发生、发展及预后。然而miRNA的种类繁多,靶点及功能较为复杂,人们对于As相关miRNA及其机制的研究还不全面,亟待更多更深入的研究去探索和发现。
