基于BMP2/Smad1/Runx2/Osterix 信号通路探讨健骨颗粒氯仿萃取部位对体外成骨细胞分化的影响
2022-06-29孙雨晴张楚天林燕萍
周 芬,孙雨晴,孙 攀,张楚天,杨 娟,林燕萍
福建中医药大学中西医结合研究院,福建福州350122
成骨细胞是骨形成的主要功能细胞,具有合成、分泌骨基质,并促使其矿化的功能,是维持骨形成和骨吸收动态平衡的关键因素[4]。研究显示:骨形态发生蛋白2(bone morphogenetic protein 2,BMP2)是诱导成骨细胞分化的主要信号蛋白之一[5],BMP2/Smad1/Runx2/Osterix 信号通路和成骨细胞的分化密切相关[6-8]。
本课题组前期研究发现健骨颗粒能够促进成骨细胞分化,促进骨形成,发挥防治绝经后骨质疏松症的作用[9-12]。为进一步阐释健骨颗粒复方的作用机制,本文基于前期研究基础,对健骨颗粒整方进行氯仿萃取,获得中药有效部分干预原代成骨细胞,从BMP2/Smad1/Runx2/Osterix 信号通路角度,探讨健骨颗粒氯仿萃取部位对成骨细胞分化的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验药物 健骨颗粒主要药物组成:煅狗骨、淫羊藿、山茱萸、党参、淮山药等,均从福建省医药公司采购,委托福建中医药研究院加工制备成含原生药2.9 g的粉末。
1.1.2 实验动物 BALB/c 小鼠8 只,年龄<3 d,购自上海斯莱克实验动物有限公司,实验动物许可证号:SCXK(沪)2017-0005,用于原代成骨细胞的提取。
1.1.3 主要实验试剂 胰蛋白酶、DMEM 高糖培养基(新西兰Hyclone 公司);碱性磷酸酶染色试剂盒(南京建成生物科技有限公司);Noggin(美国Med‐Chemexpress生物科技公司);氯仿(国药集团化学试剂有限公司);DMSO 和Ⅰ型胶原酶(日本Sigma 公司);RIPA 蛋白裂解液、PMSF、BCA 蛋白浓度测定试剂盒、SDS-PAGE 凝胶配制试剂盒、彩色预染蛋白maker(碧云天生物技术研究所);BMP2、Smad1、Runx2、Osterix、ALP、Collagen Ⅰ以及β-actin 蛋白抗体(武汉三鹰生物技术有限公司);MTT 试剂盒(南京凯基生物科技公司);Trizol(美国invitrogen 公司);YBR Premix Ex TaqTMPCR Kit(日本TaKaRa 公司);BMP2、Smad1、Runx2、Osterix、ALP 与CollagenⅠPCR 引物(上海生物工程技术有限公司);胎牛血清(美国Gibco公司)。
1.1.4 主要实验仪器 倒置相差显微镜(日本奥林巴斯株式会社);LX-800 酶标仪(美国THERMO FISHER 公司);GEL DOC 2000 凝胶成像系统(美国PE 公司);实时荧光定量PCR 仪(美国Life technolo‐gies公司)。
1.2 实验方法
1.2.1 健骨颗粒氯仿萃取部位的提取 将健骨颗粒粉末和蒸馏水等比例配成药液混合物,加入1/3混合物体积的氯仿混匀,静置分层后析出氯仿部位[13]。重复以上操作4次后,上层溶液较少,较难再萃取,故取前5 次所得的氯仿萃取部位。将氯仿萃取部位溶液旋转蒸发后,先水浴制成浸膏,再真空干燥成固体状,最大程度上减少残留在药物内的萃取剂。将制成的固体中药,按照每30 mg 中药1 mL DMSO配成母液,-20 ℃保存。
1.2.2 成骨细胞的提取及培养 采用无菌技术分离出乳鼠的颅盖骨,用预冷的PBS洗净,去除多余组织后移入含5 mL Ⅰ型胶原酶的培养皿中,将骨片剪碎,消化2 h,用移液枪吸取上清液装入离心管,离心后去上清,加入完全培养液,吹打均匀,按需接种于培养瓶,置入温度为37 ℃、CO2含量为5%的培养箱培养[14]。原代成骨细胞培养时,48 h 换液1 次,当细胞密度约为80%时进行传代,置入温度为37 ℃、CO2含量为5%的培养箱中培养,每日观察细胞生长情况。
要从生活和思想两个方面服务好老同志,管理的加强是一个基础。笔者考虑的管理的加强,指的是对退休职工党员教育管理工作长效机制进行探索
1.2.3 碱性磷酸酶染色法鉴定成骨细胞 取生长状态较好的第2 代细胞,收集后接种于24 孔板,密度以每孔1×105为标准。次日ALP固定液固定3 min弃液,PBS 清洗干净,ALP 孵育液避光湿孵1 h,PBS洗净,苏木素复染3 min,观察结果[15]。
1.2.4 MTT 法筛选最佳给药浓度 取生长状态较好的第2 代细胞,种入96 孔板,加入2、4、8、16、32、64 ng/mL 这6 个浓度的健骨颗粒氯仿萃取部位(每组设6 个副孔)进行干预,干预时间设置为1、2、3、4、5 d,干预结束后按量加入MTT,细胞培养箱孵育4 h,测OD值,并绘制相应的生长曲线。
1.2.5 细胞分组与干预 取生长状态良好的第2代细胞铺板,将细胞分为空白组、药物组、抑制剂组和抑制剂加药物组4组。用含10%胎牛血清的完全培养基进行培养,细胞长至80%时弃液,饥饿培养24 h后,空白组更换新的完全培养基培养,药物组、抑制剂组分别用含健骨颗粒氯仿萃取部位(最佳药物浓度的完全培养基和含BMP抑制剂Noggin 150 ng/mL)的完全培养基干预,而抑制剂加药物组先用含Noggin的完全培养基预处理2 h,再加入健骨颗粒氯仿萃取部位的完全培养基共干预,各组均培养48 h 后进行后续实验。
1.3 相关指标检测
1.3.1 RT-PCR 检测BMP2、Smad1、Runx2、Osterix及ALP、Collagen ⅠmRNA 的表达情况 细胞分组与干预如“1.2.5”所述,干预结束后弃培养基,PBS清洗2 遍,Trizol 法提取细胞总RNA,Nano Drop2000 检测提取物浓度,纯度需要维持在1.8~2.0 范围内。反转录方法根据反转录试剂盒说明书步骤依次进行,采用两步法中的实时荧光定量,SYBRTMGreen PCR 法扩增后,得到溶解曲线和扩增曲线,并将各组的相对mRNA 的含量进行比较,引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.3.2 Western blot 检测BMP2、Smad1、Runx2、Os‐terix、ALP、Collagen Ⅰ的蛋白表达情况 细胞分组与干预同RT-PCR,干预结束后提取成骨细胞总蛋白并用BCA 定量法测定具体蛋白浓度,把蛋白样品依次加入相应的凝胶泳道内进行电泳,电泳结束后,用湿转法转膜。封闭2 h,TBST 洗涤后加入一抗4 ℃过夜。次日TBST 摇洗后二抗孵育2 h,再次洗涤后显影,用ImageLab 4.0 软件处理分析各组蛋白条带。
1.4 统计学方法
选用SPSS 21.0版软件分析处理所有实验数据,并用()的格式表示具体结果;当符合正态分布时,选用单因素方差分析;当不符合时选用Kruskal-Wallis 秩和检验分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 成骨细胞分离培养及鉴定
2.1.1 观察成骨细胞形态 第1代成骨细胞接种于培养瓶贴壁后,由均一的小球形变成菱形、多角形、梭形等多种形态,当细胞密度达80%时进行传代。观察发现第3 代细胞状态最好,故本实验选用第3代细胞作为实验对象,见图1。

图1 第1~3代成骨细胞贴壁生长形态Figure 1 Adherent growth morphology of osteoblasts in the 1-3 generation
2.1.2 成骨细胞鉴定 碱性磷酸酶染色结果提示所提取原代细胞阳性率>90%,经鉴定确认所培养细胞为成骨细胞,见图2。
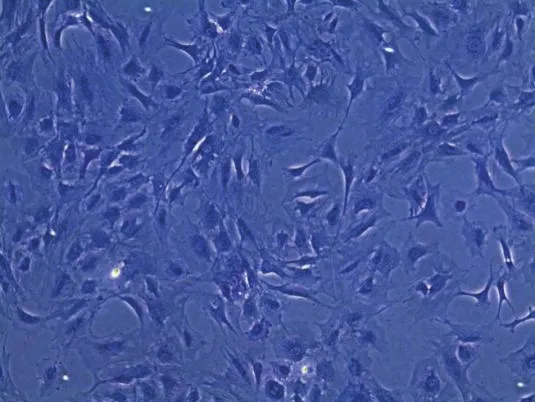
图2 原代成骨细胞碱性磷酸酶染色(×200)Figure 2 Alkaline phosphatase staining of primary osteoblasts(×200)
2.2 最佳给药浓度选择
经MTT 法检测成骨细胞增殖,结果显示:与空白组对比,6个实验药物浓度(分别是2、4、8、16、32、64 ng/mL)在干预后第1~2 天均可促进成骨细胞增殖,当药物浓度为32 ng/mL,干预时间为2 d 时,成骨细胞的增殖速度最快,故选择32 ng/mL 干预2 d作为健骨颗粒氯仿萃取部位的最佳干预条件,干预原代成骨细胞并进行后续实验,见图3。

图3 不同浓度药物干预后细胞生长曲线Figure 3 Cell growth curve after drug intervention at different concentrations
实验还发现,当药物浓度为0~2 ng/mL 时,细胞生长高峰在3~4 d;当药物浓度为4~64 ng/mL时,第2天就已到达生长高峰。由此可见,适当浓度的健骨颗粒能使成骨细胞生长高峰期提前,见图4。

图4 不同干预时间各药物浓度组成骨细胞增殖情况Figure 4 Osteocyte proliferation at different drug concentrations at different intervention time
2.3 4 组成骨细胞BMP2、Smad1、Runx2、Osterix、ALP和Collagen Ⅰ基因表达水平比较
BMP2、Smad1、Runx2、Osterix、ALP、Collagen Ⅰ的基因表达检测结果显示:与空白组比较,抑制剂组以上6个指标基因表达量均显著降低(P<0.05或P<0.01),药物组以上6 个指标基因表达量均显著升高(P<0.05 或P<0.01)。与抑制剂组比较,抑制剂加药物组以上6 个指标基因表达量均较高(P<0.05或P<0.01),见图5。

图5 4组BMP2、Smad1、Runx2、Osterix、ALP、Collagen ⅠmRNA表达水平比较Figure 5 Comparison of mRNA expression of BMP2,SMAD1,Runx2,Osterix and Collagen Ⅰin four groups
2.4 4 组成骨细胞BMP2、Smad1、Runx2、Osterix、ALP和Collagen Ⅰ蛋白表达水平比较
与空白组比较,抑制剂组以上6 个蛋白表达量均显著降低(P<0.05 或P<0.01),药物组以上6 个蛋白表达量均显著升高(P<0.05 或P<0.01)。与抑制剂组比较,抑制剂加药物组以上6 个蛋白表达量均较高(P<0.05或P<0.01)。见图6~7。
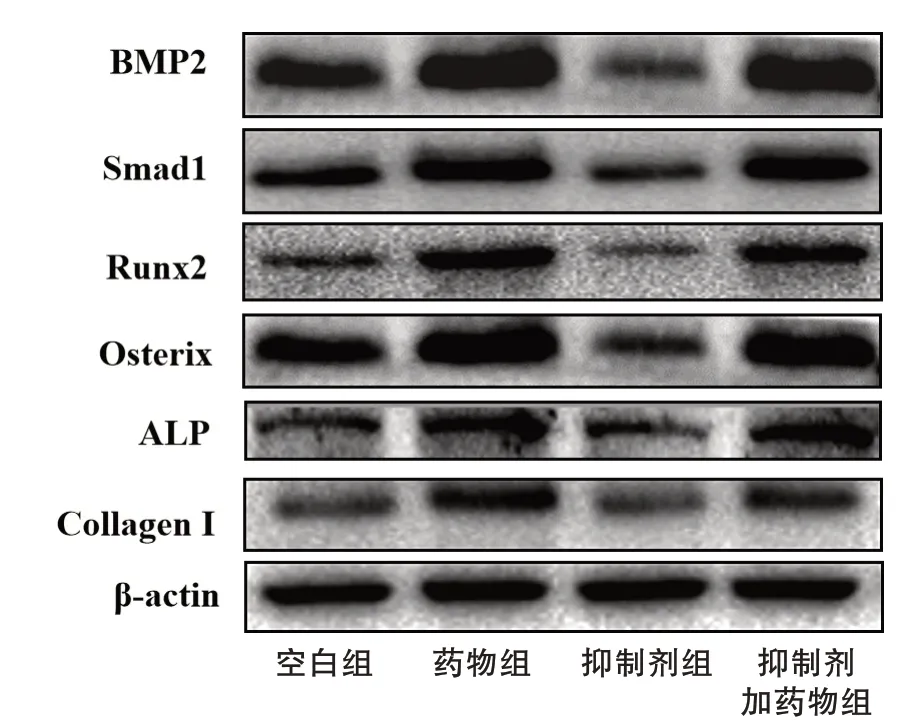
图7 Western blot检测4组成骨细胞蛋白表达水平Figure 7 Protein expression of osteoblasts in four groups detected by Western blot
3 讨论
绝经后雌激素水平下降导致成骨分化减少,骨吸收大于骨形成,骨稳态失衡是绝经后骨质疏松症的重要病因之一[16-17]。成骨细胞分化作为骨形成的关键环节对骨质疏松症的防治十分重要,因此,促进成骨细胞分化可以作为阐释中药防治PMOP的切入点[18]。中药临床治疗多以复方为主,复方药物种类多,成分复杂,直接水提干预体外细胞,复方的药效会受到干扰和限制[19]。为了使实验更加科学和严谨,本实验采用中药有效部位提取技术,使用有机溶剂氯仿将健骨颗粒整方萃取,得到效应成分更为富集的化学物质,进行体外细胞实验。既往研究发现氯仿从中药中萃取的木脂素成分属于植物雌激素,在体内的分解产物与雌激素的结构类似,能够促进成骨细胞分化[20]。本实验研究发现,适当浓度的健骨颗粒氯仿萃取部位不仅可以提高成骨细胞增殖速率,同时还能使成骨细胞生长高峰期提前。当成骨细胞增殖速度加快,数量增多形成多层细胞,并合成、分泌Ⅰ型骨胶原蛋白时,能够为最终矿化形成骨结节提供条件。细胞增殖到一定程度后开始分化,分化早期主要合成分泌ALP,从而促进骨基质的矿化。本实验研究结果表明,药物组Col‐lagenⅠ、ALP 基因和蛋白的表达量比空白组明显升高,说明健骨颗粒氯仿萃取部位能够有效促进成骨细胞分化。
BMP2 信号通路是成骨分化的关键调节剂[21]。BMP2 与其受体结合,诱导Smad1/5/9 的磷酸化,激活的Smads 转移到细胞核中可以调节目标基因,如Runx2 和Osterix。Runx2 是成骨细胞分化所必需的主转录因子,可协同其下游的Osterix 调节成骨细胞特异性基因(如ALP、CollagenⅠ)的表达[22-23],从而影响成骨细胞分化。本研究结果显示,与空白组相比,药物组BMP2、Smad1、Runx2、Osterix 基因和蛋白的表达量都有明显升高趋势,且ALP、CollagenⅠ的基因和蛋白表达量随BMP2 升高而同步上升,提示健骨颗粒氯仿萃取部位可能通过上调BMP2 促进成骨细胞分化。
Noggin 是一种分泌型糖蛋白,由205 个氨基酸组成,是骨形态发生蛋白(BMPs)的拮抗剂。Noggin可与BMP2 特异性结合,阻断后者的受体结合位点,从而抑制BMP2 的信号转导作用[23-24]。为了明确健骨颗粒氯仿萃取部位是否通过调控BMP2/Smad1/Runx2/Osterix 信号通路达到促进成骨细胞分化的作用,实验使用BMP2 抑制剂(即Noggin)抑制成骨细胞内BMP2信号转导作用,Noggin 作为BMP2的抑制剂能够明显抑制其下游的Smad1、Runx2、Osterix基因和蛋白的表达,且ALP 与Collagen Ⅰ基因和蛋白的表达量则随着BMP2 信号通路相关蛋白和基因表达下降而下降[25]。同时,设置抑制剂加药物组(Noggin和健骨颗粒氯仿萃取部位共干预)同药物组进行反向对比,药物组BMP2、Smad1、Runx2、Osterix的基因和蛋白的表达量均明显升高,且成骨细胞分化指标ALP 与CollagenⅠ基因和蛋白表达量同步升高。此外,实验结果显示抑制剂加药物组BMP2、Smad1、Runx2、Osterix 的基因和蛋白的表达量对比抑制剂组仍然有着明显的提升,说明健骨颗粒氯仿萃取部位有效干扰了Noggin 的抑制作用,其机制可能是药物干扰Noggin 与BMP2 的结合,减弱了Nog‐gin的抑制作用,但其详尽机制尚有待进一步深入探讨。本实验结果提示,健骨颗粒氯仿萃取部位能通过调控BMP2/Smad1/Runx2/Osterix 通路促进成骨细胞分化,增加骨形成,从而达到防治绝经后骨质疏松症的作用。
猜你喜欢
杂志排行
康复学报的其它文章
- 改良太极功法临床实践指南·脑卒中运动障碍
- Risk Factors for Acute Febrile Reaction after Zoledronic Acid Treatment for Primary Osteoporosis
- 脑卒中后维吾尔语、汉语运动性失语患者动词产生的脑激活区对比研究
- Network Pharmacology and Molecular Docking Analyses of the Syner⁃gistic Mechanism of Babao Dan and Oxaliplatin in Colorectal Cancer
- 游泳对大肠癌移植瘤小鼠肠道菌群及炎症的影响
- 重复经颅直流电刺激联合康复治疗意识障碍研究
