游泳对大肠癌移植瘤小鼠肠道菌群及炎症的影响
2022-06-29李加鹏谢秋容陈海春沈阿灵
李加鹏,谢秋容,文 颖,陈海春,彭 军,沈阿灵*
1 福建中医药大学体育部,福建福州 350122;
2 福建中医药大学中西医结合研究院,福建福州 350122;
3 福建省中西医结合老年性疾病重点实验室,福建福州 350122;
4 福建师范大学体育科学学院,福建福州350108
2020 年全球癌症发病1 930 万人,死亡994 万人,其中大肠癌发病率为10.0%,居第3 位,病死率为9.4%,居第2 位,其中,大肠癌全球男女性发病率分别为10.6%和9.4%,病死率分别为9.3%和9.5%[1],严重危害人类健康。研究发现,机体一半以上的免疫细胞附着于肠道,肠道菌群通过与肠黏膜免疫系统受体上的各类肠上皮细胞、多核细胞、巨噬细胞和树突细胞相互作用对免疫系统进行调控,是机体中免疫调节的重要组成部分[2]。
在大肠癌患者体内肠道菌群多呈紊乱状态,紊乱的肠道菌群可改变肠黏膜渗透性,导致肠道内细菌移位和炎症信号通路的激活,促进肠道慢性炎症的发生并大量产生活性氧自由基、氮自由基等,出现氧化应激反应,造成DNA 损伤和上皮细胞的增殖,诱发大肠癌的发生[3];另外紊乱的肠道菌群还会对肠道及免疫功能产生影响,继而参与肿瘤生长的调控[4]。肠道菌群的检测已被作为监测宿主健康状态的重要指标之一,同时也是癌患机体肿瘤预后评价的重要指标之一[5]。
适量的运动作为机体的一种良好外界刺激,部分作用机制源于运动对肠道菌群的调节[6],如可增加有益菌数量与种类,改变肠道微生物的组成[7],参与不同疾病的调控。另外,运动还可通过影响肠道微生物组成,调节肠道pH 值,降低大肠癌的患病风险[8]。适当的体育锻炼对肠道菌群具有正向的调控作用,有助于维持肠道微生态平衡,但其中的具体机制仍未得到明确的阐述。据此,本研究以游泳为干预手段,基于肠道菌群测序探讨游泳对移植瘤小鼠肠道菌群丰度结构及其功能的影响,为运动改善癌患机体肠道菌群参与抑制肿瘤生长的调控奠定理论与实验基础。
1 材料与仪器
1.1 实验动物
SPF 级BALB/C 雄性小鼠12 只(供应商:上海斯莱克实验动物有限公司),6 周龄,体质量(20.4±1.2)g[SCXK(沪)2017-0005];实验地点:福建中医药大学动物实验中心SPF 级动物房层流架[SYXK(闽)2019-0007];环境条件:室温(24±2)℃,湿度40%~70%,空气洁净度7 级,交替进行12 h 光照、12 h 黑暗处理,6 只/笼,正常饮食。实验动物均严格按照实验动物福利伦理进行实验(动物伦理编号:FJTCM IACUC 2019042)。
1.2 主要试剂仪器
实验用氨水(A512P-500)、甲酸铵(A115-50)、甲酸(A117-50)、LC-MS水(W6-4)、甲醇(A456-4)、LCMS CAN(A955-4),美国Fisher Chemical 公司;色谱仪(UHPLC 3000)、质谱仪(Q Exactive),美国Thermo Fisher 公司;色谱柱(PREMIER BEH C18),美国Waters 公司;TNF-α(PT512)、IL-1β(P1301)、IL-10(P1523)ELISA 试剂盒,碧云天生物技术有限公司。
2 实验方法
2.1 CT-26小鼠移植瘤模型的构建
取对数生长期CT-26 细胞悬液(1×107个细胞/mL)与等体积的基质胶混匀;采用皮下注射方法将1.0×106个/只(100 μL/只)的基质胶混合液注射到小鼠右侧腋皮下5 mm处。在皮下注射2~3 d后,皮下形成明显且大小相对均一的瘤体即为造模成功。采用瘤体体积计算公式计算瘤体体积,并依据体积大小,采用随机分组法将小鼠分为模型组、游泳组,每组6只。
瘤体体积(V)=½长径(L)×短径(S)2
2.2 游泳干预方案
正式干预前,移植瘤小鼠经过3次(5、15、25 min)递增时间的适应性游泳,适应性间隔时间为12 h。正式实验的游泳运动干预[7]:采用无负重,游泳时间为30 min/次,2 次/d,早晚8 点各1 次,6 d/周,共计3 周。游泳结束后迅速用捞网将小鼠捞起,并用吸水纸巾吸去皮毛中水分,吹风机暖风吹干后放回笼内。游泳环境和条件:水温(32±2)℃,在长100 cm×宽80 cm×深40 cm 的泳箱内进行,游泳干预时保证每只游泳空间≥200 cm²/只。游泳时,手持玻璃棒对小鼠进行驱赶,同时防止小鼠挤压、溺水或静漂;每次游泳前需对泳箱进行消毒清洁工作,防止小鼠在水中释放警戒物质影响游泳干预的进行。
2.3 游泳对移植瘤生长的影响
皮下移植瘤造模成功后,进行规律性游泳干预,在干预结束后,采用异氟烷气体麻醉小鼠,脱颈致死后剥离瘤体进行拍照,并采用电子天平进行称质量。
2.4 移植瘤小鼠肠道菌群16S rRNA测序
2.4.1 粪便样品采集保存 在最后一次游泳干预实验24 h 后,将小鼠置于高温高压后的塑料托盘上,用棉签取小鼠新鲜粪便3粒,立即置于无菌采样管中,并迅速经液氮速冻后,转移至实验室-80 ℃冰箱保存待检。
2.4.2 DNA 提取及检测 采用CTAB/SDS 法提取各粪便样品的总DNA,并用琼脂糖凝胶电泳及相应仪器确定提取的总DNA 质量,按测定的粪便样品浓度将总DNA 进行稀释;采用特异引物扩增16S rDNA序列、纯化PCR 产物;Illumina HiSeq 平台测序优化;PICRUSt 分析,与数据库中已知细菌比较获得样品种属信息。
2.4.3 肠道菌群的统计分析 通过对肠道菌群的OTU分析、物种注释及分类学分析、α多样性分析、β多样性分析、样品热图分析、组间差异显著性分析、KEGG 功能预测,比较分析2 组样本的肠道菌群在结构丰度及功能基因的差异。
2.5 ELISA检测游泳对机体血清炎症的影响
将TNF-α、IL-1β、IL-10 的ELISA 试剂盒提前置于室温恢复,配制相关的试剂:用纯水将20×的浓缩洗涤液稀释到1×,配制标准品、生物素化抗体工作液,配置酶结合物工作液,在作为空白对照的孔中滴加标准样品和标本通用的稀释液,剩余孔中加入标本或不同浓度的标准品(100 μL/孔),使用封口膜封闭反应孔并放入37 ℃的烘箱中进行孵育90 min后,漂洗孔板5次。在空白孔中加入提前20 min配制好的生物素化抗体稀释液(100 μL/孔),剩余孔中加入生物素化抗体工作液(100 μL/孔)。使用封口膜封闭反应孔并放入37 ℃的烘箱中进行孵育60 min 后,漂洗孔板5 次。在空白孔中加入提前20 min配制好的酶结合物工作液(100 μL/孔),用封口膜封闭反应孔并放入37 ℃的烘箱中进行孵育30 min 后,漂洗孔板5 次。每孔加入100 μL 显色底物并放入37 ℃的烘箱中进行避光孵育15 min后,每孔加入100 μL 终止液并充分混匀后通过酶标仪上在459波长处测量OD值。
2.6 统计学方法
采用SPSS 26.0、GraphPad Prism 7 软件对实验数据进行统计分析,所得数据用()表示。数据首先进行方差齐性检验和正态性检验,实验数据符合正态分布,2 组间数据的差异通过t检验。P<0.05为差异有统计学意义。
3 实验结果
3.1 游泳对小鼠移植瘤生长的影响
游泳干预结束后,剥离瘤体进行拍照、称体质量,与模型组相比,游泳组瘤体具有变小的趋势,见图1;称重统计显示2 组间瘤体质量具有统计学意义(P<0.05),见表1。

图1 游泳对CT-26移植瘤生长的影响Figure 1 Effect of swimming on growth of transplanted tumor of CT-26
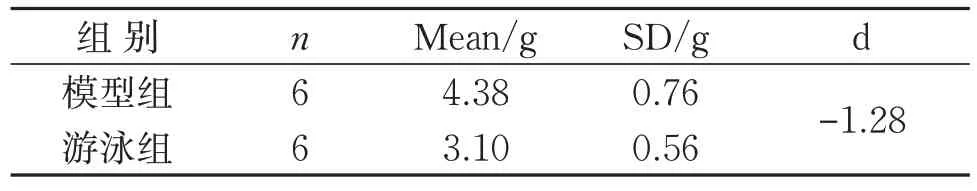
表1 2组瘤体质量统计比较Table 1 Statistical comparison of tumor weight between two groups
3.2 Illumina HiSeq 平台测序质量评估——稀释性曲线
如图2 所示,2 组样本的稀释曲线从0 开始升高趋势明显,在测序条目20 000 左右达到平台期,之后随着抽取的测序数据量的增加,OTU 的数量增加较为缓慢,表明2 组样本的测序量和深度已经基本覆盖到样品中所有的物种,可进行下一步的数据测试和分析。

图2 2组样本的稀释曲线Figure 2 Dilution curves of samples between two groups
3.3 游泳对肠道菌群OTU 聚类的影响
通过绘制韦恩图(Venn diagram)对所有样品(相似性>97%的序列)的OTU 进行分组统计和比较,找出2组样品中共有的OTU,并且找到只存在于单组样品中的特有OTU。如图3 所示,在OTU 水平上,2 组共有487 个重叠细菌种群,模型组特有细菌种群数目为73 种,游泳组特有种群数目40 种,表明微生物种群结构组成发生了较大的改变。

图3 2组样品在OTU水平上的Venn图Figure 3 Venn diagram of samples at OTU level between two groups
3.4 游泳对肠道菌群α多样性的影响
对2 组小鼠粪便中的肠道菌群进行α 多样性分析,结果如图4 所示,与模型组比较,游泳组的Ace和Chao1 指数降低,说明模型组的物种丰富度略高于游泳组;而模型组的Simpson 指数显著低于游泳组,同时Shannon 指数明显高于游泳组,说明模型组虽然在OTU 数目上多于游泳组,但是其OTU 在菌群的均匀度上明显不如游泳组,故综合微生物群落的丰富度和均匀度揭示,游泳组的肠道菌群生物多样性要优于模型组(P<0.05)。

图4 Alpha多样性指数统计Figure 4 Alpha diversity index statistics
3.5 游泳对肠道菌群β多样性的影响
PCoA 主坐标分析用来研究各样本之间的相似性,在坐标图上样本距离越远,差异越大。如图5所示,在差异贡献度达到67.92%的主成分PC1 上,模型组和游泳组之间存在明显的差异与距离(P<0.05,R>0),表明2 组的肠道菌群结构相似性较低,存在明显的结构差异。进一步的降维分析发现,纵坐标β距离数据显示,2组的组间差异明显大于组内差异(R2=0.657,P=0.001),说明分组有效,2 组的肠道菌群结构确实存在较大的差异。

图5 主成分分析Figure 5 PCoA analysis
进一步基于4种不同的距离算法binarry_jaccard、bray_curtis、unweighted_unifrac、weighted_unifrac进行降维处理,得到样品之间的距离矩阵,通过R语言工具绘制得到代表各样品间差异的热图(图6),均可说明2组间肠道菌群存在显著性差异。
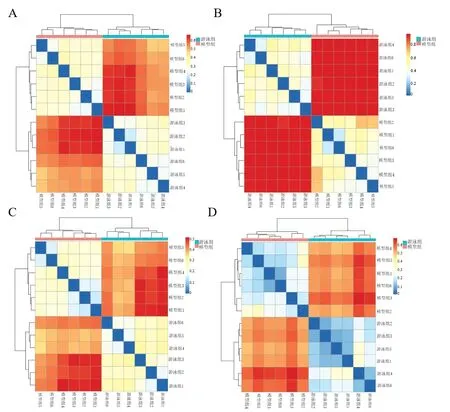
图6 各样本差异热图Figure 6 Heat map of differences among samples
3.6 游泳对肠道菌群在各分类层级上的物种差异及其丰度的影响
为了进一步解析游泳干预后的肠道群落结构改变及在各分类层级上的差异,对获得的OTUs 从门、纲、目、科、属各分类等级进行物种分类,并绘制物种分布柱状图(图7)。统计发现,2组在门的水平上排位前十菌门为:拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、螺旋体门(Spirochaetes)、Epsilon‐bacteraeota、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、Patescibacteria、蓝藻门(Cyanobac‐teria)、软壁菌门(Tenericutes)、Deferribactere。通过对排名前十的菌门的相对丰度进行比较发现,与模型组相比,游泳组Firmicutes 比例减少了39%(P<0.05),而Bacteroidetes丰度上调了44%(P<0.05),说明规律性游泳训练降低了肠道菌群F/B(Firmicutes/Bacteroidetes)比值。
在纲水平上进行2组对比,结果发现:与模型组相比,游泳组肠道菌群中的拟杆菌纲(Bacteroidia)占比增加了44%(P<0.05),而致病菌或条件性致病菌:梭菌纲(Clostridia)、丹毒丝菌纲(Erysipelotrich‐ia)、杆菌纲(Bacilli)的含量分别减少了14%、13%、15%(P<0.05)。见图7B。
在目水平上进行2组对比,结果发现:与模型组比较,游泳组的Clostridiales(梭菌目)、Erysipelotrichales(丹毒丝菌目)、Sphingomonadales(鞘脂单胞菌目)和Lactobacillales(乳杆菌目)的丰度分别减少了12%、13%、8%和15%(P<0.05),而Bacteroidales(拟杆菌目)丰度显著增加了44%(P<0.05)。见图7C。
在科水平上进行2组对比,结果发现:与模型组比较,游泳组普雷沃氏菌科(Prevotellaceae)、Murib‐aculaceae 和毛螺菌科(Lachnospiraceae)的含量分别增多了8%、38%、20%(P<0.05),而消化链球菌科(Peptostreptococcaceae)、韦荣球菌科(Erysipelotricha‐ceae)、梭菌科(Clostridiaceae_1)和链球菌科(Strepto‐coccaceae)丰度分别减少16%、13%、17%和11%(P<0.05)。见图7D。
在属水平上进行2组对比,结果发现:与模型组比较,游泳组中S24-7科细菌属(Uncultured-bacteri‐um-f-Muribaculaceae)、拟普雷沃菌属(Alloprevotel‐la)和毛螺菌属(Lachnospiraceae_NK4A136_group)的丰度分别增加了37%、6%、11%(P<0.05),而苏黎世杆菌属(Turicibacter)、链球菌属(Streptococcus)和梭状芽胞杆菌属(Clostridium_sensu_stricto_1)分别减少了13%、12%和16%(P<0.05)。见图7E。

图7 肠道菌群在各分类层级上的物种差异及其丰度Figure 7 Species diversity and abundance of intestinal flora at different taxonomic levels
3.7 游泳对组间样品LEfSe分析的影响
根据LEfSe 分析(不同组产生显著性差异影响的微生物群落分析),进一步计算2组中存在显著性差异菌群的LDA 值,以2 作为分界制作LDA 差异贡献条形图(图8),可以直观地反映组间存在显著性差异的微生物类群丰度对差异的贡献值。如图所示,厚壁菌门、梭菌科、消化链球菌科等29个分类群是游泳组肠道内丰度显著下调的菌群,而在拟杆菌门、Muribaculaceae门、Alloprevotella、普雷沃氏菌科、氏菌属等27 个分类群是游泳组肠道内丰度显著上升的菌群,它们是构成了2 组产生显著性差异的主要贡献菌群。

图8 LDA值差异贡献条形图Figure 8 LDA value difference contribution bar graph
3.8 游泳对肠道菌群KEGG 功能基因在代谢通路中富集的影响
从图9中可以看出2组19个代谢通路差异具有统计学意义(P<0.05)。模型组中功能基因代谢通路在传染病、碳水化合物代谢、寄生、膜转运、外源性生物降解与代谢、药物依赖、免疫疾病及其他氨基酸代谢通路等方面富集程度显著高于游泳组(P<0.05);游泳组中功能基因代谢通路在免疫系统、运输和贮藏、其他次生代谢物的生物合成、能量代谢、多糖生物合成和代谢、内分泌代谢疾病、神经系统、循环系统、信号分子的相互作用途径等方面富集程度显著高于模型组(P<0.05)。

图9 2组小鼠肠道菌群的基因功能富集分析Figure 9 Gene functional enrichment analysis of intestinal microflora in mice between two groups
3.9 游泳对移植瘤小鼠血清中TNF-α、IL-1β 和IL-10表达水平的影响
部分肠道菌群可通过多途径、多通路激活宿主NF-κB 信号通路,促使宿主分泌大量的TNF-α、IL-1β 等细胞因子,促进肿瘤细胞的增殖与存活[9]。为了探讨游泳改善肠道菌群的潜在作用机制,进一步采用ELISA 检测移植瘤小鼠血清中TNF-α、IL-1β和IL-10 的表达水平。如图10 所示,移植瘤小鼠在游泳干预后,游泳组小鼠血清中炎性因子TNF-α、IL-1β 含量水平显著性降低(P<0.05),免疫因子IL-10 在经过游泳干预后含量水平显著性提高(P<0.05),提示游泳可显著降低CT-26 移植瘤小鼠机体炎症水平提高免疫力。

图10 2组小鼠血清中TNF-α、IL-1β和IL-10含量水平比较Figure 10 Comparison of levels of TNF-α,IL-1β and IL-10 in serum of mice between two groups
4 讨论
肠道菌群与机体保持着和谐共生或者相互拮抗的关系[10]。可通过参与机体消化吸收、神经调控、炎症免疫等反应,起到保护肠道黏膜屏障、改善机体代谢能力、调节免疫响应、抗炎等功能[11]。研究发现,肠道菌群与肿瘤的发生、发展关系密切,大肠癌患者与健康人群肠道中的微生物菌群的组成和分布特征存在极大差异,大肠癌患者肠道中,厚壁菌门及梭杆菌属的丰度增加。此外,对比癌旁组织与癌变组织,乳球菌和梭杆菌的丰度有所增加[12]。肠道微生物的组成与众多疾病的发生、发展息息相关,肠道菌群也逐渐成为机体生理健康状况评估以及癌症发生发展的重要指标之一。
4.1 运动参与调节肠道菌群的组成和结构
目前研究发现,运动对机体产生的抗炎抗肿瘤的作用,部分作用得益于运动可调节肠道菌群结构,优化有益菌群,均衡肠道微生态,但对其中的具体作用机制研究较少,为了探究运动是否能够通过改善肠道菌群来抑制肿瘤的生长,本研究以CT-26移植瘤小鼠为模型,通过16S rRNA 测序技术分别检测了2 组粪便中的菌群,结果发现游泳组的肠道菌群生物多样性要优于模型组(P<0.05),说明游泳干预能够显著提高移植瘤小鼠的肠道菌群多样性。在β 多样性分析中,PCoA 主坐标图显示在对差异贡献最大的主成分PC1 上,2 组的差异值达到了67.92%,说明2 组小鼠肠道菌群存在明显的群体差异,进一步揭示了游泳干预对移植瘤小鼠肠道微生物群落的组成和结构具有重要的影响。
4.2 游泳干预提升大肠癌移植瘤小鼠菌群多样性,提高有益菌占比
为了进一步明确游泳干预是否改善了移植瘤小鼠的肠道菌群结构,对获得的OTUs 从门、纲、目、科、属等各层级进行物种分类,从各个分类层级的物种分布柱状图中,可直观地看出2 组在各个分类等级中差异均有统计学意义。在门层级上,与移植瘤小鼠模型组相比,游泳组中厚壁菌门的比例显著减少(P<0.05),而拟杆菌门丰度显著提高(P<0.05)。在急性结肠炎中,厚壁菌门与拟杆菌门的比值显著提高,且厚壁菌门的丰度增加以及拟杆菌门的减少都被证明有助于大肠癌的发展。对大鼠的大肠癌模型进行肠道菌群分析发现,相较于健康组,大肠癌大鼠肠道中厚壁菌门数量增加,拟杆菌门丰度减少,变形菌门差异无统计学意义,普雷沃菌属、乳酸杆菌属和密螺旋体属较健康组少,而梭杆菌在肠癌组样品中丰度较高[13]。而运动干预能够减轻厚壁菌门与拟杆菌门相对丰度比值升高的情况[14];不同运动方式的干预,均可减轻肥胖小鼠肠道菌群中厚壁菌门与拟杆菌门相对丰度失衡的状态[15]。本研究发现3周有规律的游泳训练对移植瘤小鼠肠道内菌群在门层级上的组成也起到了较好的调节作用。
在门层级下,与模型组相比,游泳组中丰度显著提高的拟杆菌门的细菌种类中,含量显著提升的是拟杆菌纲和弯曲菌纲,以及其下属分类层级的弯曲菌目、Muribaculaceae科、Prevotellaceae科、Prevotel‐laceae_UCG_001 属、拟普雷沃菌属、氏菌属等;运动干预后,整体丰度下调的厚壁菌门细菌种类中链球菌科、消化链球菌科、丹毒丝菌科、链球菌属等含量减少,而毛螺菌科、胃瘤菌科和Lachnospiraceae_NK4A136_group 属的丰度提升。有研究发现,大肠癌大鼠肠道微生物中,普雷沃式菌科和胃瘤菌科的丰度相较于健康大鼠明显降低,说明这两类菌群的数量与大肠癌的发生、发展呈现负相关的关系[16]。而Muribaculaceae 是在2019 年被划分为拟杆菌门下,是一种具有抗炎作用的益生菌[17]。此外,王婷婷[18]在对56 例健康对照和46 例大肠癌患者的肠道菌群结构分析过程中发现,一些条件致病菌大量活跃于大肠癌患者的肠道中,主要包括消化链球菌科、肠球菌属、链球菌科、志贺氏杆菌属等细菌;另一方面,在健康对照中能够产丁酸盐的毛螺菌科等丰度提高。研究证实,丁酸盐还能够降低肠细胞DNA 损伤,促进损伤肠细胞凋亡,提高机体免疫起到抗炎、抗肿瘤的功能,进而降低肠道的炎症反应和患大肠癌的风险[19]。本研究发现,游泳干预能够改善移植瘤小鼠肠道内的菌群结构,下调条件致病菌链球菌科、消化链球菌科、丹毒丝菌科、链球菌属等的丰度,同时增加丁酸盐产生菌毛螺菌科、氏菌属等细菌的数量,进而延缓大肠癌的发生、发展。
4.3 游泳通过影响肠道菌群功能基因在代谢途径上的改变,参与大肠癌移植瘤小鼠机体的炎症免疫调控
为了进一步探讨游泳运动通过改善移植瘤小鼠肠道菌群结构延缓移植瘤生长的机制,通过KEGG 分析对游泳干预前后的移植瘤小鼠的肠道菌群功能基因在代谢途径上进行功能富集分析发现,游泳组肠道菌群功能基因在免疫系统、转运和代谢、能量代谢等通路中富集程度显著高于模型组(P<0.05)有关。在本实验结果中,干预后移植瘤小鼠血清中炎性因子TNF-α、IL-1β 下降(P<0.05),而IL-10水平显著提高(P<0.05),说明在游泳干预后,肠道菌群介导的机体免疫对移植瘤小鼠的机体炎症水平具有一定的抑制作用。
如前所述,肠道致病菌群产生的代谢产物引起的炎症反应是大肠癌发生的主要因素之一。无论是由溃疡性结肠炎恶化导致的炎症性大肠癌,还是散发性的大肠癌,其发生、发展通常都伴随着炎症渗透反应和促炎细胞因子TNF-α、IL-1β 等的释放[20]。如脆弱拟杆菌在小鼠肠道内定植后会产生肠毒素,而肠毒素会引起肠组织损伤,进一步激活转录因子STAT3,诱导细胞因子白细胞介素-17(in‐terleukin-17,IL-17)的产生,形成结肠肿瘤[21]。这些研究均证实了肠道菌群的结构在维持机体免疫内稳态方面扮演了重要的角色,一旦出现病原菌入侵或肠道致病菌增加时,肠道微生态系统的平衡被打破,促进肠组织炎症和损伤,诱发大肠癌的发生[22]。
运动作为可以影响肠道菌群的积极因素可调节肠道菌群的丰度及结构,提高微生物多样性,保持肠道微生态平衡,达到改善机体健康的作用[23]。前期研究发现,运动能够提高肠道菌群中负责分泌短链脂肪酸(short-chain fatty acids,SCFAs)的微生物的比例,而SCFAs 可经人体消化道内膜吸收后,可参与调节机体内分泌,维持机体的能量稳态[24]。其中,丁酸的分泌能够消除肠道炎症,平衡肠道微生态,有助于肠道细胞的生存[25],有效防治溃疡性结肠炎和大肠癌的发生[26]。
研究发现,规律性游泳运动能够显著阻断胰岛素抵抗大鼠的氧化应激信号转导,进一步激活IKK/NF-κB 通路,抑制TNF-α 的转录表达降低机体炎症水平[27]。运动亦可通过减少肠道近端和远端中的环加氧酶2(cyclooxygenase-2,COX-2)等炎症标志物,降低机体炎症水平[28]。谯蔚茜[29]研究发现,普雷沃菌属等丰度升高能够降低炎症因子COX-2、TNF-α、IL-8 及STAT3 的表达,改善因1,2-二甲基肼诱导大肠癌导致的肠道菌群多样性和结构的失衡,刺激细菌产生有益代谢产物,进而降低大肠癌发生的风险。
本研究发现:3 周规律性游泳训练能够提高移植瘤小鼠肠道微生物多样性,调节肠道微生态中拟杆菌门、厚壁菌门、螺旋体门及变形菌门的相对比例,逆转移植瘤小鼠肠道内厚壁菌门与拟杆菌门相对丰度失衡的情况,提高肠道内SCFAs 产生菌(Ru‐minococcaceae、Lachnospiraceae、Bacteroides 和Pre‐votellaceae 等)的丰度,这些SCFAs 产生菌通常与抗炎因子TGF-β 和IL-10 等以及控制调节性T 细胞发育和功能的关键转录因子Foxp3 的含量成正比,而与促炎因子TNF-α、IFN-γ、IL-17 等以及细菌脂多糖(lipopolysaccharide,LPS)的表达呈负相关,对减轻机体免疫炎症反应,促进结肠组织损伤修复,抑制肠源性内毒素的释放,维持肠道内微生态的平衡,有效防治大肠癌的发生均具有积极的促进作用。
5 结论
本研究探讨了游泳干预、肠道菌群和小鼠大肠癌移植瘤生长之间的关系,结果发现游泳干预可能通过改变移植瘤小鼠肠道菌群的结构,改善肠道微生态,增加毛螺菌科等负责分泌丁酸盐的菌群丰度,促进能量代谢,增强肠黏膜的免疫屏障功能,降低机体炎症水平。其中,游泳、肠道菌群与肿瘤生长抑制之间的关系以及基于游泳运动改变菌群对大肠癌移植瘤生长的具体抑制作用机制的研究还有待进一步深入。
