奥拉西坦联合rTMS减轻脑缺血再灌注损伤大鼠缺血侧脑皮质神经元氧化应激损伤
2022-06-29刘泽晶钱晓蕊杨富佼赵琳琳
刘泽晶, 徐 丰, 刘 勇, 吕 英, 钱晓蕊, 杨富佼, 赵琳琳, 刘 曦
(1.黑龙江中医药大学,黑龙江省哈尔滨市150006;2.黑龙江中医药大学附属第四医院,黑龙江省哈尔滨市150001;3.黑龙江中医药大学附属第一医院,黑龙江省哈尔滨市150040)
脑缺血再灌注损伤(ischemia reperfusion injury,I/RI)是指缺血脑组织在恢复血流灌注后损伤反而加重的现象,多发于缺血性脑卒中、脑外伤、心肺复苏等脑缺血后的再灌注过程中。既往研究认为,I/RI过程中产生的大量氧自由基是导致脑皮质神经元损伤的重要机制之一[1],抗氧化剂治疗可以清除脑组织过多的氧自由基,减轻脑组织氧化应激损伤。奥拉西坦(oxiracetam,Oxi)是一种新型y-氨基丁酸环化衍生物,不仅能有效促进脑氧代谢过程,还能激活、保护及修复神经元细胞,发挥脑保护作用[2]。已有研究显示,Oxi中的有效成分(S)-Oxi可以调节脑缺血大鼠脑皮质区的能量代谢,发挥抗氧化作用,减轻脑组织损伤[3]。重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)是一种通过在大脑中产生感应聚焦电流,实现瞬间调制大脑皮层的无创刺激方式,在脑部疾病的诊治中发挥着至关重要的作用[4]。既往研究显示,接受rTMS刺激治疗脑梗死患者的神经功能缺损情况明显优于接受常规手段治疗的患者[5]。但Oxi与rTMS联合是否能发挥协同增效作用,且这一作用是否与氧化应激过程相关尚不明确。因此,本研究探索了Oxi联合rTMS对脑I/RI大鼠缺血侧脑皮质神经元的保护作用,并进一步分析其对氧化应激过程的调节作用,旨在为临床治疗提供一定的理论基础。
1 材料和方法
1.1 动物、试剂和仪器
SPF级SD雄性大鼠60只,体质量220~250 g,6~8周龄,由哈尔滨医科大学实验动物学部提供,动物许可证号SCXK(黑)2019-001。实验开始前大鼠于实验室环境中适应性喂养1周,温度(25±2)℃,相对湿度(40±5)%,光照周期10~12 h,整个实验过程中大鼠自由饮水和进食。
Oxi(福安药业集团重庆博圣制药公司,国药准字H20143232);氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)(德国Biofroxx公司);超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒(南京建成生物工程研究所);B细胞淋巴瘤2(B cell lymphoma 2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)、活化的Caspase-3(Cleaved Caspase-3)、核因子E2相关因子2(nuclear factor E2 associated factor 2,Nrf2)、血红素加氧酶(hemeoxygenase-1,HO-1)、醌氧化还原酶1(quinone oxidoreductase 1,NQO-1)单克隆抗体(英国Abcam公司);辣根过氧化酶(horseradish peroxidase,HRP)标记羊抗兔IgG(艾美捷科技有限公司)。Rapid2型经颅磁刺激仪(英国Magstim公司)。
1.2 脑缺血再灌注损伤模型的建立和分组
60只SD大鼠适应性喂养7天后,随机均分为对照组、I/RI组、Oxi组、rTMS组和Oxi+rTMS组。除对照组外所有大鼠均采用Longa法[6]制备大鼠脑I/RI模型,腹腔注射2%戊巴比妥钠溶液(2 μL/g),于左侧颈总动脉离分叉处约5 mm处剪一小口,于近心端采用栓线结扎脑中动脉,并缝合,缺血2 h后拔出栓线实现再灌注。对照组大鼠仅暴露脑中动脉,插入栓线,不进行结扎,其余步骤同手术组。若再灌注后24 h内,造模大鼠出现神经缺损症状,如左前爪伸展不完全,行走时身体有向左侧转圈或倾倒的倾向等,则为造模成功[7]。造模成功后,Oxi组以200 μg/g Oxi腹腔注射,1次/天;rTMS组以rTMS刺激,在大鼠清醒的状态下固定头部,将圆形线圈中线对准人字缝,使线圈中心处于前囟与人字缝中间,磁刺激频率10 Hz,100次/串,5串/天,每串间隔时间30 s,刺激强度0.5 T;Oxi+rTMS组以Oxi干预联合rTMS;对照组、I/RI组以等量生理盐水腹腔注射,以上5组均连续干预14天。
1.3 大鼠神经功能和脑梗死体积的检测
末次干预后,采用Zea Longa 5分制标准[8]进行神经体征缺失评分(neurological defectscore, NDS)。检测后,断颈处死各组大鼠,取大鼠左侧脑皮质组织,-20 ℃冰箱中冷冻20 min后,脑组织冠状切片后置于2%氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)溶液,37 ℃ 15 min。随后取出切片,生理盐水冲洗2次后置于4%多聚甲醛中进行组织固定,24 h后采用图像处理软件Image J测量各组脑梗死灶面积,并计算脑梗死体积百分比(infarct volume rate,IVR)。
1.4 脑组织损伤和神经元细胞凋亡率的检测
取大鼠左侧脑皮质组织,4%多聚甲醛固定, 4 μm组织切片,行常规HE染色或者TUNEL染色,光学显微镜下观察组织形态,采用Image J对TUNEL染色图像进行分析处理,每张图片随机选取5个视野,观察每个视野凋亡细胞数(细胞核呈棕褐色或棕黄色颗粒的细胞)和总细胞数,细胞凋亡率(%)=(凋亡细胞数/总细胞数)×100%。
1.5 脑组织中氧化应激相关因子的检测
取大鼠左侧脑皮质组织,制备组织匀浆,严格按照试剂盒说明书,黄嘌呤氧化酶法检测脑组织中SOD水平,化学比色法检测脑组织GSH-Px水平,硫代巴比妥检测脑组织MDA水平。
1.6 Western blotting检测脑组织Nrf2、HO-1、NQO-1和凋亡相关蛋白表达
取大鼠左侧脑皮质组织,匀浆,提取总蛋白,采用BCA法测定蛋白水平,依次进行电泳、转膜,滴加5%脱脂牛奶室温下封闭2 h,滴加一抗Nrf2(1∶500)、HO-1(1∶1 000)、NQO-1(1∶1 000)、Bcl-2(1∶1 000)、Bax(1∶1 000)、Caspase-3(1∶1 000)和Cleaved Caspase-3(1∶1 000),4 ℃摇床中孵育24 h后洗膜,滴加二抗(1∶5 000),滴加ECL显影剂显影,采用Image J软件进行灰度分析,以β-actin为内参,计算各蛋白相对表达量。
1.7 统计学分析
2 结 果
2.1 Oxi联合rTMS改善I/RI大鼠神经功能缺损和脑组织损伤
Oxi组、rTMS组和Oxi+rTMS组大鼠NDS评分和IVR明显低于I/RI组,Oxi+rTMS组IVR进一步低于Oxi组和rTMS组(P<0.05;表1)。HE染色结果显示,对照组脑组织未见明显病理变化;I/RI组左侧脑皮质神经元结构较疏松,间隙变宽,细胞核固缩深染,出现变性和坏死细胞;Oxi组、rTMS组和Oxi+rTMS组左侧脑皮质神经元水肿程度减轻,变性和坏死细胞数量减少(图1)。

表1 Oxi联合rTMS改善I/RI大鼠神经功能和脑组织损伤
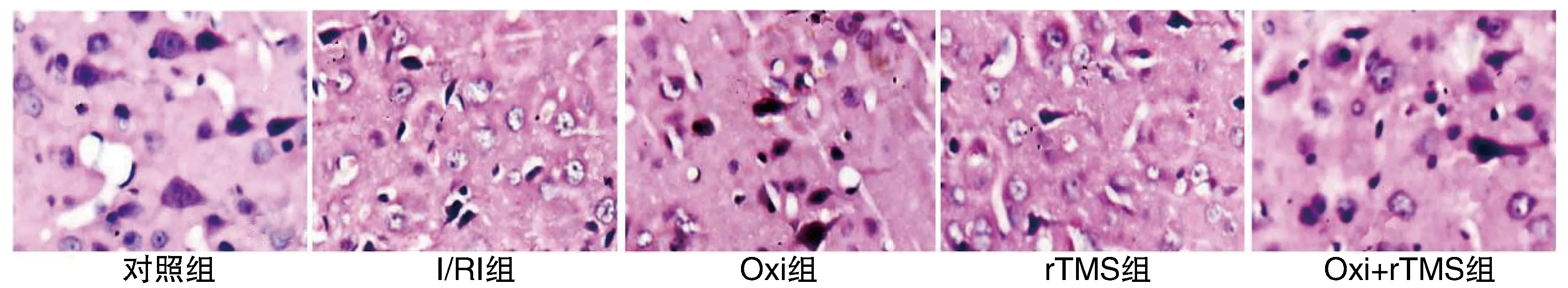
图1 Oxi联合rTMS减轻I/RI大鼠脑组织损伤(HE, 400×)
2.2 Oxi联合rTMS抑制脑皮质神经元细胞凋亡
I/RI组大鼠脑皮质神经元细胞凋亡率、Bax/Bcl-2和Cleaved Caspase-3/Caspase-3蛋白表达明显高于对照组(P<0.05);而Oxi组、rTMS组和Oxi+rTMS组上述指标明显低于I/RI组(P<0.05);与Oxi组和rTMS组比较,Oxi+rTMS组上述改变更为显著(P<0.05;图2)。
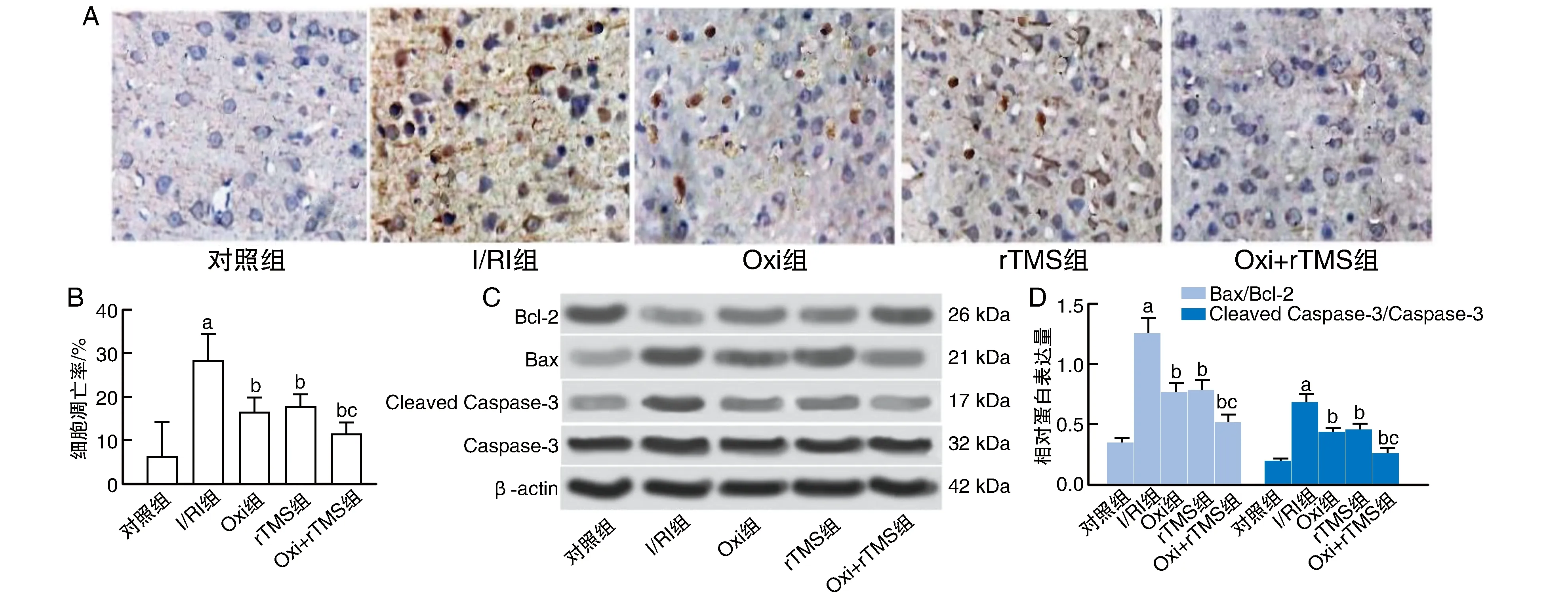
图2 Oxi联合rTMS抑制I/RI大鼠脑皮质神经元细胞凋亡
2.3 Oxi联合rTMS降低I/RI大鼠脑组织氧化应激水平
I/RI组大鼠脑组织SOD和GSH-Px明显低于对照组,MDA明显高于对照组(P<0.05)。Oxi组、rTMS组和Oxi+rTMS组脑组织SOD和GSH-Px明显高于I/RI组,MDA明显低于I/RI组(P<0.05);与Oxi组和rTMS组比较,Oxi+rTMS组上述改变更为显著(P<0.05;表2)。
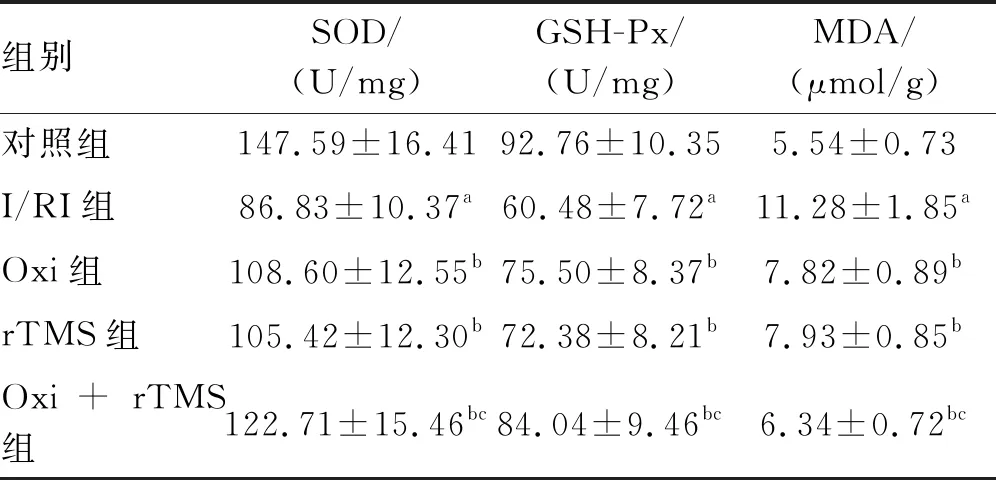
表2 Oxi联合rTMS降低I/RI大鼠脑组织氧化应激水平
2.4 Oxi联合rTMS促进I/RI大鼠脑组织Nrf2、HO-1、NQO-1蛋白表达
I/RI组大鼠脑组织Nrf2、HO-1和NQO-1蛋白表达明显高于对照组(P<0.05)。Oxi组、rTMS组和Oxi+rTMS组脑组织Nrf2、HO-1和NQO-1蛋白表达明显高于I/RI组(P<0.05);与Oxi组和rTMS组比较,Oxi+rTMS组上述改变更为显著(P<0.05;图3)。
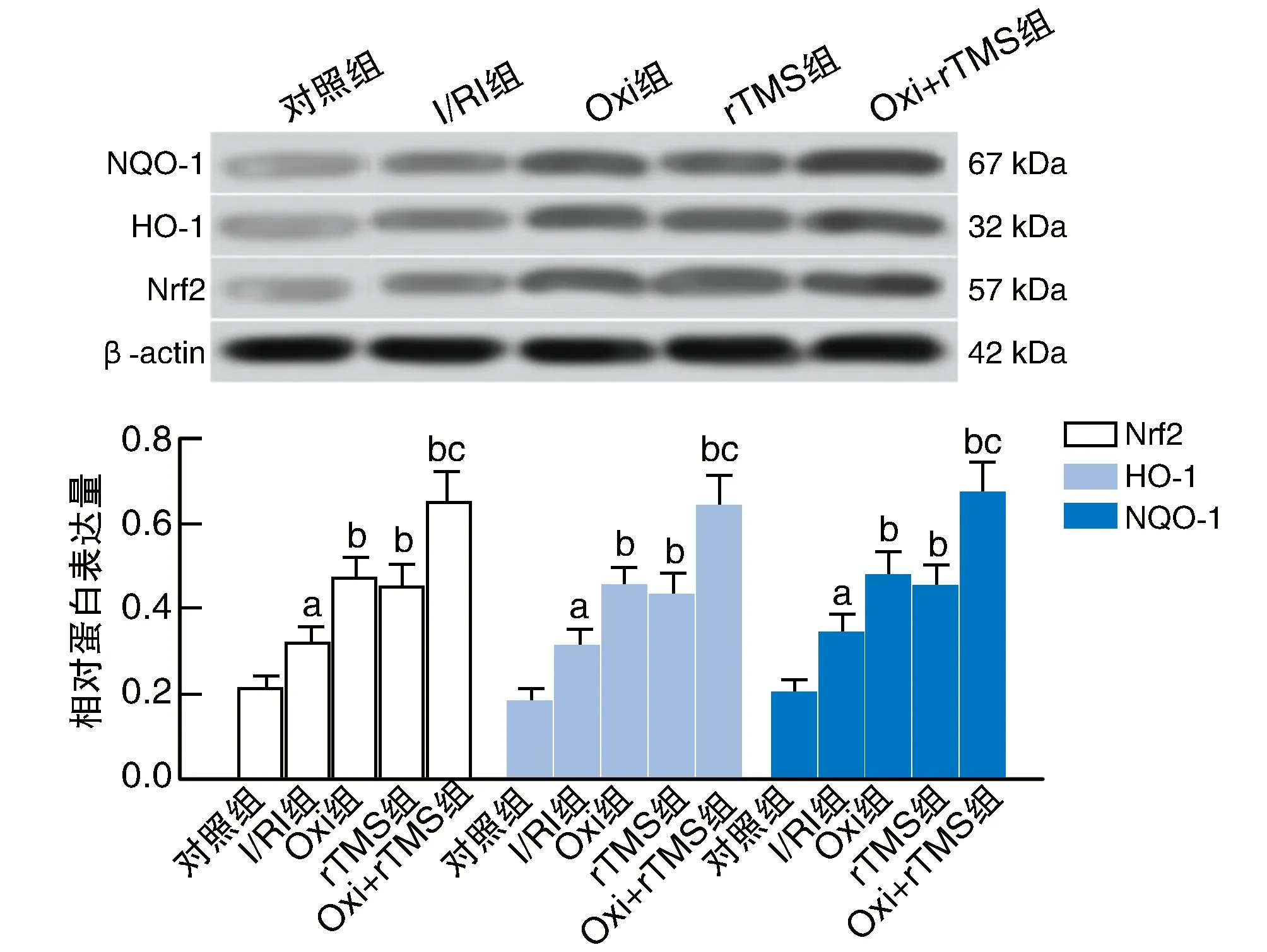
图3 Oxi联合rTMS促进I/RI大鼠脑组织Nrf2、HO-1、NQO-1蛋白表达(Western blotting)
3 讨 论
脑缺血再灌注(I/R)过程中诱导产生了大量氧自由基,引起细胞膜脂质过氧化,破坏线粒体结构,影响脑组织能量代谢障碍,还可以激活凋亡相关的信号通路,诱导神经细胞凋亡,加重脑组织损伤[9]。Oxi是一种神经营养药物,可以提高痴呆大鼠脑组织抗氧化酶活性,减轻脑组织氧化应激损伤,发挥脑保护作用,目前已应用于临床脑血管疾病的治疗[10]。rTMS利用电磁感应的原理,可以重复使用脉冲磁场刺激大脑皮质神经元,影响神经元活动,调节脑组织能量代谢,改善神经功能[11]。本研究观察了Oxi联合rTMS干预对脑I/RI大鼠脑组织损伤的影响,发现Oxi和rTMS可以显著改善I/RI大鼠的神经功能,减轻脑皮质组织损伤,缩小其脑梗死面积,且Oxi联合rTMS干预可以明显提高临床作用效果,提示临床可联合应用Oxi联合rTMS减轻脑缺血患者I/RI损伤,改善神经功能。
本研究中,Oxi和rTMS均可以抑制脑I/RI大鼠脑皮质神经元细胞凋亡,抑制Bax/Bcl-2和Cleaved Caspase-3/Caspase-3蛋白表达,且Oxi联合rTMS干预可以明显提高临床作用效果。细胞凋亡信号通路主要包括由线粒体介导的内部细胞凋亡信号通路和死亡受体介导的外部细胞凋亡信号通路[12]。Bax/Bcl-2是一组调控线粒体凋亡途径的蛋白,已有研究发现,I/RI过程中大量氧自由基可以诱导Bax转位至膜上与Bcl-2结合,破坏线粒体膜的完整性,导致线粒体细胞色素C释放进入胞浆,激活Caspase级联反应,活化凋亡执行蛋白Caspase-3,诱导脑组织细胞凋亡[13]。Hong等[14]研究显示,rTMS刺激可以抑制脑I/RI大鼠神经元细胞凋亡,缩小脑梗死体积,改善神经功能,提示Oxi联合rTMS可能通过抑制脑皮质神经元细胞凋亡,减轻脑组织损伤,改善神经功能。
本研究中,Oxi和rTMS均可以促进脑I/RI大鼠脑组织Nrf2、HO-1和NQO-1蛋白表达,且Oxi联合rTMS干预可以明显提高临床作用效果。Nrf2是机体内最重要的抗氧化应激调节因子,可以调控多个抗氧化基因HO-1、NQO-1等表达,清除机体过多的氧自由基[15]。既往研究显示,当细胞受到氧自由基刺激时,Nrf2可与其特异性受体Keap1发生解偶联,转位至细胞核,启动抗氧化反应元件所调控的HO-1、NQO-1等基因表达[16]。赵宗刚等[17]研究显示,Oxi可以促进脑梗死大鼠脑组织Nrf2表达,提高脑组织抗氧化能力,减轻脑组织氧化应激损伤,改善神经功能,提示Oxi联合rTMS可以协同调节脑I/RI大鼠的氧化应激水平,减轻脑组织损伤。本研究中,Oxi和rTMS均可以升高脑I/RI大鼠脑组织SOD和GSH-Px活性,降低MDA水平,且Oxi联合rTMS干预可以明显提高临床作用效果。SOD和GSH-Px均为细胞内重要的抗氧化酶,MDA可以反应细胞内氧自由浓度,提示Oxi联合rTMS可以提高脑I/RI大鼠的抗氧化能力。关园等[18]研究显示,Oxi可以提高心肌I/RI大鼠的心肌组织抗氧化能力,清除过多氧自由基,抑制心肌组织细胞凋亡,减轻心肌组织损伤。王金华等[19]研究显示,rTMS可以提高血管性痴呆大鼠的脑组织抗氧化酶活性,抑制脑组织细胞凋亡,发挥神经保护作用,提示Oxi联合rTMS可能通过调节Nrf2表达,降低I/RI过程中的氧化应激反应,减轻脑I/RI大鼠的氧化应激损伤。
综上所述,Oxi联合rTMS可以促进脑I/RI大鼠脑组织Nrf2蛋白表达,提高抗氧化酶活性,抑制缺血侧脑皮质神经元细胞凋亡,减轻脑组织氧化应激损伤,改善神经功能,临床可采用Oxi联合rTMS治疗减轻脑I/RI损伤。本研究不足之处在于仅在动物水平上探索了Oxi联合rTMS对大鼠脑I/RI氧化应激损伤的影响,尚需大量的临床试验来验证。
