‘青燕1 号’幼苗叶绿素合成和荧光特性对土壤干旱的响应
2022-06-29刘凯强贾志锋梁国玲刘文辉
刘凯强,贾志锋,梁国玲,刘 勇,马 祥,刘文辉
(青海省青藏高原优良牧草种质资源利用重点实验室 / 青海大学畜牧兽医科学院, 青海 西宁 810016)
干旱是困扰世界农业生产的一个严重问题[1],干旱频繁发生影响作物的生长、分布和发展[2]。叶片作为植物关键 “源”器官,是逆境生理学研究的热点之一,逆境下除了进行碳同化循环积累物质和能量外,同时是植物与外界物质和能量交换的纽带[3]。研究发现,叶片抗旱的策略是多样的,包括渗透调节、气孔的优化调节、光合色素比例的调节等生理形态的变化[4]。叶绿素是绿色植物光合作用的主要承担者,它的含量受内在基因和外部环境共同调控。叶绿素生物合成涉及多种基因和酶的协作且严格受光调控,光照条件下,原叶绿素酸酯氧化还原酶催化原叶绿素酸脂转化成叶绿素酸脂,经叶绿素合成酶催化生成叶绿素a[5]。此外,除光照影响,低温、水涝、干旱等胁迫都也会影响叶绿素合成。叶绿素含量降低会破坏色素蛋白复合体的稳定性,引起光系统Ⅰ和光系统Ⅱ光吸收效率减弱,造成光合性能降低,最终导致生物量积累下降。干旱胁迫引起叶绿素含量下降的研究已在玉米(Zea mays)[6]、水稻(Oryza sativa)[7]、小麦(Triticum aestivum)[8]、高粱(Sorghum bicolor) [9]等传统作物上有大量报道。研究认为光合色素吸收的光能极易受到环境胁迫而出现分配失衡,光能代谢紊乱引胞内活性氧大量积累造成的叶绿体暂时性或永久性的功能损伤,是导致最终光合色素减少的重要原因[10],也有研究认为光合色素的减少可能是植物对胁迫的适应策略,减少吸收光能对机体产生二次伤害,降低光破坏影响的重要表现[11]。干旱会引起光系统Ⅱ反应中心失活,张永强等[12]研究指出,干旱胁迫显著改变小麦的叶绿素荧光参数变化;张翠梅等[13]研究表明,在-1.2 MPa 的水势条件下,抗旱型紫花苜蓿(Medicago sativa)光合机构损伤及膜脂过氧化程度较轻,且品种差异具有较大的主导作用。Nankishore 和Farrell[14]研究认为,叶绿素含量和荧光参数可以作为评价干旱胁迫下基因型差异最有效的指标。叶绿素荧光参数变化不仅受干旱影响,而且与叶绿素含量显著相关[15]。植物体内叶绿素含量受限于其前体物质的积累及关键酶活性水平,研究叶绿素代谢对于探究干旱胁迫下植物生长变化及抗旱评价具有重要的参考价值。
燕麦(Avena sativa)属于禾本科燕麦属一年生草本植物,是青藏高原的主要种植作物之一[16],具有很高的经济价值和生态价值[17-18]。燕麦虽然性喜凉,耐瘠薄,对逆境具有较强的耐受性[19],但干旱还是在一定程度上影响了燕麦的生长,尤其是春旱对幼苗生长抑制更甚。随着青藏高原气候变化的不规则性,近些年这一现象正在加剧。因此,了解燕麦对春季水分亏缺的响应将变得更加重要。大量研究证明苗期是植物最为关键的时期[20-21],期间幼苗生长较为脆弱,植株的防御系统还未建立完全,正经历从地下种子提供营养转为地上部光合制造碳水化合物阶段,处于种子胚乳养分耗竭,地上部叶片构建的状态,苗期器官还未完全分化完成,外界环境变化对其生长的影响是极为显著的。燕麦苗期有效叶片较少,光合作用养分积累有限,茎生长较弱,不能抵御长时间水分亏缺,严重时甚至影响其器官生长发育,导致后期籽粒产量下降,影响燕麦产业的经济效益。叶绿素是植物光合作用获取光能的重要途径和手段,是植物获取能量的支撑.研究土壤干旱对燕麦幼苗生长、叶绿素合成前体物质和荧光特性的变化,旨在探讨土壤干旱对燕麦幼苗伤害的生理机制,以期为进一步研究和评价燕麦苗期干旱提供参考依据。
1 材料与方法
1.1 供试材料
供试品种‘青燕1 号’由青海大学畜牧兽医科学院牧草种质资源库提供。
1.2 试验设计
试验于2019 年开始,地点位于青海省畜牧兽医科学院省级重点实验室防雨棚内,挑选籽粒饱满、大小一致的‘青燕1 号’燕麦种子,消毒处理后均匀撒播于高30 cm、直径28 cm 育苗盆中,并覆土镇压,显著高于对照90.3%、129.0%和122.5%。出苗后每盆定植25 株。土壤来自大田土,晒干后过筛混合均匀等量装入育苗盆,底肥为磷酸二铵(N 18%,P2O546%) 38.98 g·m−2和尿素(N 46%) 19.49 g·m−2。
干旱处理:采用单因素随机区组设计,设4 个水分梯度,分别为田间持水量75% (土壤含水量18.75%,对照);田间持水量60% (土壤含水量15.00%);田间持水量45% (土壤含水量11.25%);田间持水量30% (土壤含水量7.50%)。100%田间持水量为25.00%土壤含水量,土壤含水量由实测所得。于苗期土壤干旱 10 d,共 4 个处理,10 次重复,40 盆。
控水方法:试验选择称重差值法进行水分控制,于每天17:00 称重花盆,计算预计灌水量之间的差值用以补充花盆缺失水分。
1.3 测定指标及方法
1.3.1 形态特征
株高:采用直尺测量,选择长势一致的幼苗,测量其绝对高度,即植株基部至顶生叶片的绝对长度,每个处理测定10 株。
叶长宽比:采用直尺测量,选择长势一致的幼苗,测量其顶生叶长和宽,计算长宽比,每个处理测定10 株。
根冠比:选择长势一致的燕麦幼苗,地上部分和地下部分分离,冲去表面杂质,滤纸吸干水分后于75 ℃烘箱烘干至恒重,每个处理测定10 株。
1.3.2 叶绿素及其合成前体物质
干旱处理结束后,各处理取长势均匀的正二叶0.5 g,迅速放入液氮冷冻后,于-80 ℃冷藏,用于各指标测定。
叶绿素含量测定参照Wen 等[22]的方法;δ-氨基乙酰丙酸(δ-aminolevulinic acid, ALA)测定参照钟小兰[23]的方法;胆色素原(porphobilinogen,PBG)测定参照Bogorad [24]的方法;尿卟啉原Ⅲ(uroporphyrinogen Ⅲ, Uro Ⅲ)和粪卟啉原Ⅲ (copr Ⅲ,Cop Ⅲ)测定参考Czarnecki O [25]的方法;原卟啉Ⅸ(protoporphyrin Ⅸ, Proto Ⅸ)、镁原卟啉Ⅸ (magnesium protoporphyrin Ⅸ, Mg-Proto Ⅸ)和原叶绿素酸酯(protochlorophyllide, Pchl)测定参考陈友根[26]的方法。
1.3.3 叶绿素荧光参数的测定
土壤干旱结束后进行叶绿素荧光参数测定,每个处理选择3 株长势一致植株的正二叶,用便携式光合仪(Li-6800, LI-COR, USA)测得荧光参数,每个叶片重复3 次。叶室测定参数:CO2浓度(400.0 ± 5.0)μmol·mol−1(CO2钢瓶提供);相对湿度300% ± 1%;饱和脉冲光设为8 000 μmol·(m2·s)−1;温度25 ℃。在黑暗条件下适应1 h 后,待叶室参数稳定后读取初始荧光(Fo)、稳定荧光(Fs)、暗适应下最大荧光(Fm)和光下最大荧光(Fm')等参数。参考Li 等[27]的方法,计算最大光化学效率(Fv/Fm)和PSⅡ实际光化学效率(ΦPSⅡ);参考Schreiber 等[28]和Genty 等[29]的方法,计算非光化学淬灭系数(NPQ)、调节性能量耗散 Y( NPQ)和非调节性能量耗散 Y( NO)。计算公式如下:
ΦPSⅡ= (Fm′ −Fs)/Fm′;
Fv/Fm= (Fm−Fo)/Fm;
NPQ=Fm/Fm′ − 1;
qP= (Fm′ −Fs)/(Fm′ −Fo′);
Y(NO) = 1/[NPQ+ 1 +qP×Fo′/Fs× (Fm/Fo− 1)];
Y(NPQ) = 1 −ΦPSⅡ− 1/[NPQ+ 1 +qP×Fo′/Fs×(Fm/Fo− 1)]。
1.3.4 光能分配参数
根据Braun 和Malkin [30]方法计算PSⅠ激发能分配系数 α、PSⅡ激发能分配系数 β、双光系统激发能分配不平衡系数 ( β/α - 1),参考Demmig-Adams 等[31]方法、计算光化学反应的份额(P)、天线热耗散的份额(D)、非光化学反应耗散的份额(Ex)。计算公式如下:
P=Fv′ /Fm′ ×qP;
D= 1 −Fv′/Fm′;
Ex=Fv′ /Fm′ × ( 1 −qP)。
1.4 数据分析
采用 Excel 2013 软件整理数据,用平均值和标准差表示测定结果,采用 SPSS 16.0 软件对不同土壤干旱处理间进行Duncan 法多重比较,采用Origin 2019 作图。
2 结果与分析
2.1 不同土壤干旱对燕麦幼苗生长的影响
不同土壤干旱下燕麦幼苗生长的变化不同(图1),随着胁迫程度加深‘青燕1 号’株高和叶长宽比呈显著下降趋势(P< 0.05)。与对照相比,田间持水量60%、45%和30%的株高分别降低了24.3%、45.8%和57.4%,叶长宽比分别降低了44.0%、61.9%和68.2%。干旱显著增加了‘青燕1 号’地下生物量的分配(P< 0.05),田间持水量60%、45%和30%时根冠比分别达0.59、0.71 和0.69,显著高于对照90.3%、129.0%和122.5%。
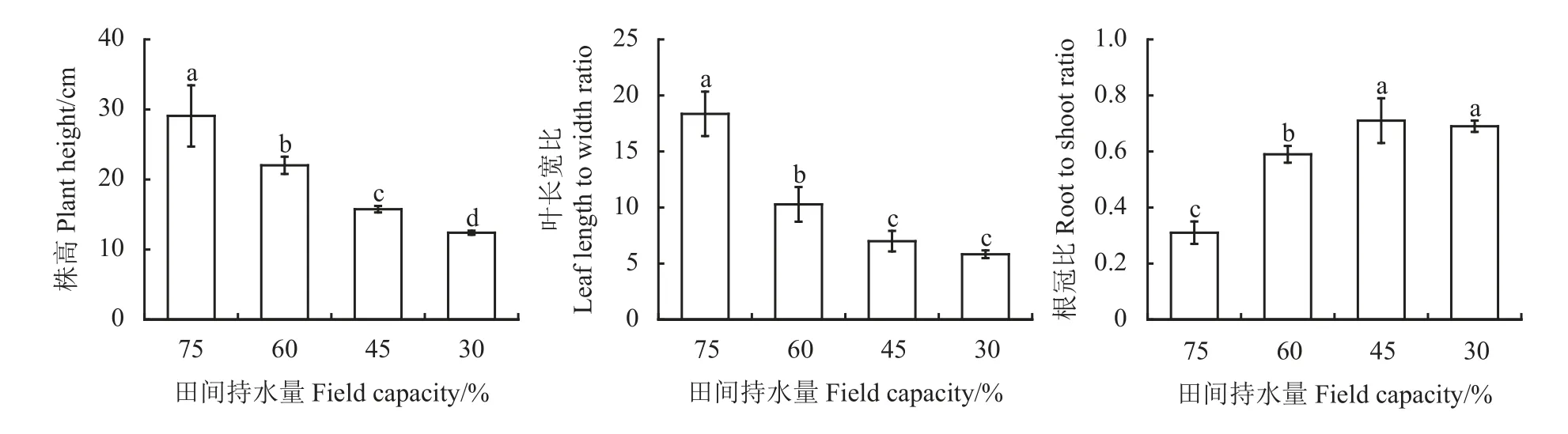
图1 不同土壤干旱下燕麦幼苗生长变化Figure 1 Growth change in oat seedlings under different soil drought
2.2 不同土壤干旱对燕麦叶绿素合成的影响
燕麦幼苗叶绿素合成前体物质对土壤干旱响应不同(图2)。除田间持水量60%外,45%和30%的幼苗ALA 含量均显著高于对照(P< 0.05),分别提高了53.2%和173.1%。在干旱处理下PBG 表现出不同的变化,对照的PBG 含量显著高于其他3 个干旱胁迫处理,尽管田间持水量为30%时PBG 含量略有上升,但仍显著低于对照。4 个处理的UroⅢ均差异不显著(P> 0.05)。Cop Ⅲ随着干旱增加而逐渐降低,与对照相比,田间持水量60%、45%和30%的Cop Ⅲ含量分别显著降低了41.7%、62.3%和63.8%。与对照相比,田间持水量60%的Proto Ⅸ、Mg-Proto Ⅸ和Pchl 的含量均差异不显著,但是田间持水量45%和30%的含量均显著低于对照。
不同胁迫下燕麦叶绿素含量也有差异(图2)。与对照相比,叶绿素a 和叶绿素b 含量在田间持水量45%和30%处理下显著低于田间持水量60%与对照(P< 0.05),田间持水量60%与对照间无显著差异(P> 0.05)。叶绿素a/b 在所有处理下均无显著差异(P> 0.05),但田间持水量45%和30%的叶绿素总量显著低于对照,说明中度和重度水分胁迫可能影响了叶绿素的合成或者加速了其分解速度,从而导致叶绿素含量降低。

图2 不同土壤干旱下燕麦叶绿素合成前体物质及叶绿素含量的变化Figure 2 Changes in precursors of chlorophyll synthesis and chlorophyll content in oat under different soil drought
2.3 不同土壤干旱对燕麦叶绿素荧光参数的影响
干旱对燕麦叶绿素荧光参数Fv/Fm、ΦPSⅡ、qP、NPQ、Y(NPQ)和Y(NO)均有显著影响(P< 0.05)(图3)。田间持水量30%的Fv/Fm显著低于其他处理(P< 0.05),其他处理间显著不显著(P> 0.05)。ΦPSⅡ和qP 的变化趋势一致,与对照相比,田间持水量60%、45%和30%的ΦPSⅡ分别显著降低了20.4%、33.9%和43.2% (P< 0.05),qP 分别显著降低了15.4%、 26.7%、 36.9% (P< 0.05)。 与对照相比,田间持水量60%、45%和30%的NPQ 和Y(NPQ)均显著增加(P< 0.05),其中NPQ 分别增加了79.3%、57.6%和65.2%,Y(NPQ)分别增加了24.3%、30.1%和29.4%。Y(NO)在对照、田间持水量60%和45%处理下差异不显著(P> 0.05),但在田间持水量30%处理下显著高于对照(P< 0.05),提高了20.5%。
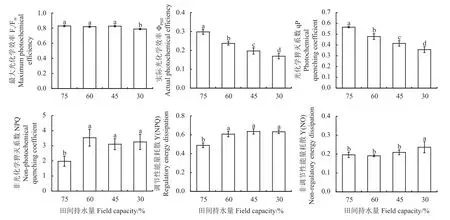
图3 不同土壤干旱下燕麦叶绿素荧光参数的变化Figure 3 Changes in chlorophyll fluorescence parameters of oat under different soil drought
2.4 不同土壤干旱对燕麦光能分配参数的影响
干旱对燕麦叶片光系统PSⅠ激发能和PSⅡ吸收光能分配的影响不同(图4)。与对照相比,PSⅠ激发能分配系数(α)随着水分胁迫加剧呈下降趋势,而PSⅡ的激发能分配系数(β)呈上升趋势。激发能在两个光系统之间的不平衡分配系数(β/α-1)以及PSⅡ光能在天线耗散(D)和非光化学反应(Ex)中的份额随着干旱胁迫加剧也呈上升趋势。在田间持水量为60%处理下,β、β/α-1 和D 比对照分别显著增加了6.0%、42.4%、9.5% (P< 0.05),Ex 增加了6% (P>0.05),在田间持水量45%下分别比对照显著增加了14.2%、126.3%、14.1%和13.9% (P< 0.05),在田间持水量30% 处理下,分别比对照显著增加了16.9%、154.5%、9.1%和34.4% (P< 0.05)。在干旱处理下,α 和用于光化学反应的份额(P)不断降低。田间持水量60%、45%和30%的α 和P 较对照分别显著降低10.5%、 25.2%、 29.6% 和19.9%、 33.4%和42.9% (P< 0.05)。

图4 不同干旱胁迫下燕麦光能分配参数的变化Figure 4 Changes in light distribution parameters of oat under different soil drought
3 讨论
光合作用是高等绿色植物进行光能转化为化学能的重要手段[32]。干旱、盐碱、低温等逆境会引起植物的光合代谢失序,主要归因于光合器官结构形变、光合酶类物质的失活以及光合色素的降解等[33-34]。高等植物光合色素主要存在于叶片的叶绿体基粒,分为叶绿素和类胡萝卜素[35]。依据功能分类,叶绿素主要包括叶绿素a 和叶绿素b,前者是光合作用的主要承担者。叶绿素的合成从谷氨酸开始至叶绿素a 和叶绿素b 的形成结束,受多种基因和酶的调控,任何一个步骤出现问题都可能引起叶绿素合成受阻。Dalal 和Tripathy[36]、赵艳艳[37]研究发现,逆境胁迫会下调表达叶绿素合成过程中的催化酶,从而减少中间产物的合成积累,最终导致小麦叶绿素的合成减少。姚嘉龙等[38]发现谷氨酰-tRNA 还原酶、谷氨酸酯-1-半醛2, 1 氨基变位酶是控制大豆(Glycine max)叶绿素合成的关键酶。本研究发现,土壤干旱增加了燕麦叶绿素合成中间产物δ-氨基乙酰丙酸含量(ALA);随着干旱强度增加中间产物胆色素原(PBG)含量先降低后略有升高;而粪卟啉原Ⅲ(Cop Ⅲ)、原卟啉Ⅸ (Proto Ⅸ)、镁原卟啉Ⅸ (Mg-Proto Ⅸ)和原叶绿素酸酯(Pchl)含量均明显下降,且下降幅度受胁迫程度影响。叶绿素中间产物的增加或减少,一方面可能是由于前体物质转化受挫,导致中间产物的合成前体减少;另一方面也可能是光合电子传递过程产生过多的活性氧引起机体产生氧化胁迫,破坏了叶绿素合成相关酶活性,进一步机理有待揭示。叶绿素是光合作用的基础,其含量的多少决定了光合速率的上限,增加或减少均与光合性能的联系紧密。有研究表明,耐旱型水稻具有更高的叶绿素a 含量,且叶绿素b 响应水分变化较叶绿素a 敏感[39]。本研究发现,土壤干旱抑制了叶绿素a 和叶绿素b 合成,叶绿素总量显著降低。也有研究发现叶绿素a/b 可以作为甘薯(Dioscorea esculenta)抗旱性评价的指标[40],但本研究中未观察到此现象,这可能是物种间的差异引起的。
植物光合作用吸收的光能利用效率不足20%,剩余光能主要以光化学反应、热耗散和叶绿素荧光途径耗散。光化学反应是耗散光能的主要途径,也是植物碳积累的有效方式。逆境胁迫下光合速率和碳同化效率降低都是光化学反应受抑制的重要表现。植物光化学反应可通过最大光化学效率(Fv/Fm)、实际光化学效率(ΦPSⅡ)、光化学猝灭系数(qP)等荧光参数来反映[41]。本研究发现,土壤干旱对燕麦最大光化学效率(ΦPSⅡ)和光化学猝灭系数(qP)影响显著,而最大光化学效率(Fv/Fm)仅在重度胁迫下略有下降。这与孙骏威等[42]研究结果相似,可能是因为实际光化学效率的下降主要是化学猝灭系数下降引起,而最大光化学效率变化较小说明PSⅡ和光合电子传递链可能未受损伤。热耗散是植物受到光抑制的重要防护策略,主要将吸收光能以热能的形式无损伤的耗散掉,而非光化学猝灭灭系数(NPQ)诱导的热能耗散是评价耗散重要指标。非光化学猝灭灭系数(NPQ)主要分为调节性能量耗散Y(NPQ)和非调节性能量耗散Y(NO),前者与高能态猝灭相关关,参与叶黄素循环的光保护过程,后者是评价PSⅡ是否遭受光损伤的重要参数。本研究中非光化学猝灭灭系数(NPQ)和调节性能量耗散Y(NPQ)受土壤干旱胁迫后明显上调,说明燕麦受土壤干旱后叶黄素循环开始参与PSⅡ的保护并耗散过剩光能;而非调节性能量耗散Y(NO)仅在重度胁迫下略有升高,可能是由于重度胁迫下燕麦的光系统过剩的光能已经不足以被光保护机制耗散掉,出现了光抑制和光破坏现象。
植物叶绿体中光合色素吸收的光能由光合电子传递体经光合系统进行传递[43],PSⅡ一般位于PSⅠ前端,是植物光能利用的第一步[44]。PSⅡ主要由PSⅡ反应中心、捕光复合体Ⅱ和放氧复合体组成[44]。干旱胁迫会影响捕光复合体Ⅱ吸收光能在PSⅡ反应中心的光化学利用效率,未利用的光能在PSⅡ和PSⅠ中积累诱导产生大量的活性氧物质,造成光合系统的氧化胁迫。有研究表明[45],短期干旱促使捕光复合体Ⅱ解体,大部分的光系统蛋白含量下降,如Lhcb5、Lhcb6 和PsbQ 蛋白。而PSⅡ的光损伤率受入射光的强度影响,且PSⅡ的修复对活性氧物质的是否存在特别敏感[46]。因此,环境的改变引起PSⅡ的损伤往往是多种因素的级联反应的综合结果。植物的PSⅠ和PSⅡ的激发能均衡分配和合理耗散是光合过程高效运转和传递的保障。本研究得出,土壤干旱显著增加了PSⅡ激发能β 分配比例,降低了PSⅠ的激发能α 分配,导致双光系统间激发能分配不平衡偏离系数β/α−1 增加,说明干旱胁迫减少了燕麦光反应阶段激发能的利用,将更多的激发能分配到暗反应阶段。尽管PSⅡ的激发能分配增多有助于碳同化效率提升,但过多的激发能必将造成PSⅡ光化学反应和热耗散压力过大,机体必须通过热耗散的形式散失掉过多的光能。本研究表明,胁迫后光化学利用份额P 明显降低,而依赖NPQ 耗散的激发能份额D 显著增加,进一步印证了热耗散是过剩光能的主要散失途径。
植物汲取水分的能力与其生长生境和自身遗传特性密切相关,二者在很大程度上决定了其在自然界适应范围的广度。植物生长归根结底是水分的转移和协调运输的过程,期间伴随着多种生理生化响应,当植物感受到水分匮缺的信号时[47],会减缓植物的发育进程,如细胞伸长、分化、分裂等,最终引起植株表型差异,如叶、茎和根系等发育迟缓[48]。前期植株的生长良好是后期完成物质积累的重要保障,干旱胁迫引起植物生长节律紊乱,导致植株矮化、叶片失绿、过早成熟、严重时甚至造成植株死亡,是引起粮食减产、品质下降的主要原因[49]。Anjum等[50]在玉米中研究发现,干旱引起植株高度、叶面积、根的鲜干重以及叶片数均有不同程度的下降,且抗旱型品种具有较强的耐受性。对于牧草而言,干旱胁迫不仅影响草品质,而且对产量也影响巨大[51]。苗期是牧草生长的关键时期,此时幼苗养分供给与耗散平衡正处于稳定性较差的阶段,当养分供给小于耗散速度时幼苗发育受阻,当养分供给大于耗散速度时幼苗处于快速增长阶段。本研究发现,土壤干旱显著影响燕麦幼苗的发育,降低了幼苗株高和叶长宽比,增加了根冠比的分配比例,这可能是由于土壤干旱抑制了植株的养分供给,而养分供给不足归根结底是光合作用不足,其主要原因可能是叶绿素及其合成前体物质代谢失衡造成的。同时,本研究中发现,叶绿素降低与光合系统变化密切相关,叶绿素含量降低后燕麦光能利用效率下降,光合系统光能分配紊乱,过剩光能以热耗散形式散失。因此,叶绿素可能是影响荧光技术评价燕麦遭受土壤干旱程度的重要参数。而随着水分胁迫加剧根系的分配比例增大,这可能是幼苗抵御干旱的重要策略。
4 结论
土壤干旱导致‘青燕1 号’燕麦幼苗株高和叶长宽比下降,引起地下生物量分配增加。叶绿素合成中间产物的增加或减少,最终会引起叶绿素含量减少。土壤干旱后燕麦遭受光抑制和光破坏程度相对较轻,干旱后叶黄素循环是光保护的重要途径。此外,干旱引起了激发能在双光系统分配的失衡,热耗散是过剩光能的主要散失途径。
