盐城大丰麋鹿自然保护区滨海湿地土壤有机碳分布特征
2022-06-29么秀颖闫丹丹李静泰盛昱凤谢思荧栾兆擎
么秀颖,闫丹丹,李静泰,盛昱凤,谢思荧,刘 垚,栾兆擎,*
(1.南京林业大学 生物与环境学院,江苏 南京 210037;2.南方现代林业协同创新中心,江苏 南京 210037)
引 言
联合国政府间气候变化专门委员会(IPCC)发布的第六次评估报告(AR6)中指出,从2011年以来,大气中温室气体含量持续增加,2011—2020年间全球平均温度较1850—1900年平均值高1.09 ℃[1],而气候的变化在影响生态系统碳循环和全球碳收支方面发挥着重要作用[2]。作为全球三大生态系统之一,湿地储存了超过全球30%的碳[3],其巨大的碳储量和固碳能力,让湿地生态系统在全球碳循环中发挥着重要作用[4]。
滨海湿地受海洋和陆地相互作用的影响,对土壤碳的存储、释放及转化等具有独特的调节作用[5]。由于全球气候变暖下海平面上升[6],以及外来物种入侵导致湿地生态系统结构和功能转变等原因,目前对滨海湿地土壤碳的研究存在很大的不确定性[7]。Hager[8]和Valery等[9]对比研究了盐沼湿地入侵种和本地种土壤全碳含量,发现二者没有显著性差异;Windham等[10]在美国Mullica河口湿地发现芦苇(Phragmitesaustralis)入侵前后土壤碳储量没有显著改变;Koutika等[11]研究证明了比利时受大豕草(Heracleummantegazzianum)和虎杖(Fallopiajaponica)入侵地块土壤有机碳(SOC)含量比未入侵地块的要低;王刚等[12]和Liao等[13]通过野外调查采样表明互花米草入侵滨海湿地能够显著提高土壤的碳汇能力。国内关于互花米草入侵对滨海湿地土壤碳影响的研究较多,多集中于物种入侵对土壤有机质及碳组分的空间分布[14,15]、生态系统初级生产力[16]、不同潮滩生物量[17]、湿地碳储量[7,18]等的影响,但研究多基于浅层土壤和单次季节采样,对互花米草入侵下滨海湿地土壤有机碳时空分布特征的研究报道仍较为少见。因此,本研究拟通过研究盐城大丰麋鹿国家级自然保护区滨海湿地不同季节、不同植物类型下深层土壤有机碳的分布特征,探讨土壤有机碳含量与土壤理化性质之间的相关关系,分析互花米草入侵及其他外界因素对原有潮滩湿地土壤碳储量的影响,以期拓展和完善我国滨海湿地碳储量研究,并为大丰麋鹿保护区湿地保护和管理提供一定科学依据。
1 材料与方法
1.1 研究区概况
大丰麋鹿国家级自然保护区位于江苏省盐城大丰市境内,介于川东港与东台河之间(32°56′~33°36′N,120°42′~120°51′E)。保护区主要由林地、草滩、沼泽地和盐裸地组成。自然形成的大小潮沟及人工修建的沟渠构成了保护区的基本水系。该区处于亚热带和温带之间的过渡地带,属于海洋性季风气候,年平均温度14.1 ℃,年平均降水量1068 mm,年平均无霜期213天[19],成土母质为黄河口沉积物,土壤质地为粉质砂壤土,属于滨海盐土类中的草甸滨海盐土和潮滩滨海盐土[20]。互花米草于1983年引入保护区后,经30多年的繁殖扩张已取代芦苇和碱蓬成为了当地优势种。
1.2 样品采集与分析
以大丰麋鹿国家级自然保护区第三核心区作为研究区,选取了光滩、碱蓬(Suaedasalsa)、互花米草(Spartinaalterniflora)、白茅(Imperatacylindrica)、獐毛(Aeluropussinensis)、狗牙根(Cynodondactylon)和芦苇(Phragmitesaustralis)7种典型湿地植被群落作为研究对象。分别于2020年10月(秋季)、2021年1月(冬季)、2021年4月(春季)和2021年8月(夏季),对11个样点进行样品采集(图1)。其中,设置低互花米草(34~37 cm,米草-L)、中互花米草(76~120 cm,米草-M)和高互花米草(150~190 cm,米草-H)3个采样点,光滩和碱蓬各2个采样点,其它植被群落各1个采样点,每个采样点进行3次重复采样。按照0~20 cm,20~40 cm,40~60 cm,60~80 cm和80~100 cm深度进行分层采样,同时每层使用标准体积环刀采集原状土用于测定土壤容重和含水率[21,22]。将采集的土壤样品置于密封袋中,带回实验室。人工挑选出土样中的植物根系、螺、贝壳、石砾等杂物,自然风干、碾磨,分别过10目和100目土壤筛后装袋储存备用。
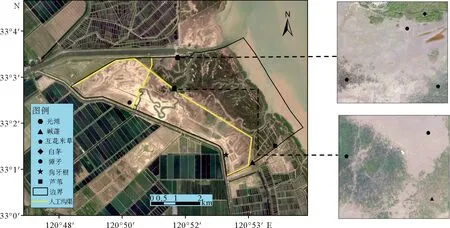
图1 研究区采样点示意图
土壤有机碳(SOC)含量采用重铬酸钾氧化—外加热法测定[23],土壤总氮(TN)含量使用元素分析仪(vario MACRO cube,Elementar, Langenselbold,Germany)在CNS模式下测定,土壤pH和电导率分别使用pH计和电导率仪进行测定[24,25]。
1.3 数据处理
土壤有机碳密度(SOCs,kg·m-2)计算公式[26,27]如下:
(1)
式中,SOCi为第i层土壤有机碳含量(g·kg-1);BDi是第i层土壤的容重(g·cm-3);Di是第i层土壤的厚度(cm)。
土壤有机碳储量计算公式[27]如下:
(2)
式中,SOCc为积累单位面积有机碳储量(kg·m-2);SOCsi是第i层土壤有机碳密度。
对实验数据进行整理后,使用SPSS 25.0对数据进行单因素方差分析(One-way ANOVA)检验差异显著性,用Origin 2021b进行Person相关性分析等制图。图表中的数据均为平均值±标准误差。
2 结果与讨论
2.1 滨海湿地土壤有机碳含量分布特征
2.1.1 土壤有机碳含量水平分布特征
大丰麋鹿国家级自然保护区第三核心区不同植被群落SOC含量存在明显差异(图2),介于0.95~4.63 g·kg-1。在7种湿地中,SOC含量高低顺序表现为:互花米草(4.63±0.57 g·kg-1)>光滩(3.02±0.61 g·kg-1)>碱蓬(2.64±0.61 g·kg-1)>狗牙根2.33±0.52 g·kg-1)>獐毛(2.22±0.23 g·kg-1)>芦苇(1.78±0.13 g·kg-1)>白茅(0.95±0.18 g·kg-1)。其中,互花米草SOC含量显著高于其他湿地(p<0.05),这与金桂香等[15]、高建华等[18]得出的结论相同。作为C4植物,互花米草具有比碱蓬、芦苇、茅草这些C3植物更高的光合效率和更大的生产力,其本身的无性繁殖特点也决定了互花米草具有更发达的根茎和地下生物量[28]。
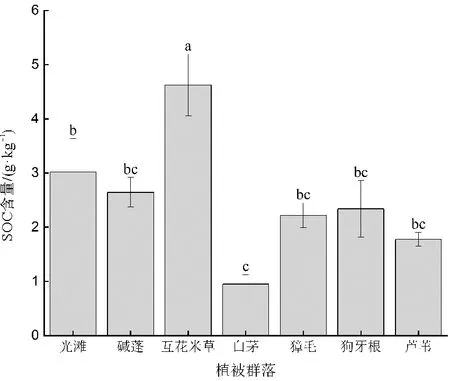
图2 不同植被群落SOC含量
研究表明,滨海湿地互花米草、芦苇、碱蓬等植被覆被区土壤SOC含量显著高于光滩[15,29]。本文与前人研究结果存在差异,发现光滩湿地SOC含量仅低于互花米草湿地,高于其他具有植物覆盖的湿地。分析认为,光滩地势较低,外源有机质随地表径流或地下水流动时易出现堆积,从而使光滩SOC含量偏高;此外,根据实地调查,光滩采样点的位置曾被互花米草覆盖,因此其SOC含量可能因受过互花米草的影响而导致整体含量偏高。对比其他湿地类型,白茅湿地SOC含量明显低于互花米草、芦苇等湿地(p<0.05),这和陈虹伊等[30]的研究结果类似。白茅多生长在相对高程较高且低盐的位置[31],而研究区属于滨海盐土且地势平坦,这些环境条件限制了白茅的分布和生长,从而使白茅湿地土壤SOC含量较低。除环境因素外,麋鹿粪便、尿液等排泄物也会对表层土壤产生一定影响,导致地上生物量较少的狗牙根和獐毛土壤其SOC含量要高于地上生物量较大的芦苇。
2.1.2 土壤有机碳含量垂直分布特征
从整体来看,不同植被群落SOC含量随深度的变化表现出非单调趋势(图3)。在0~40 cm土壤中,所有植被群落SOC含量的垂直分布规律大致相同,即随土壤深度增加SOC含量下降。光滩、碱蓬和互花米草湿地在40~100 cm土层SOC含量表现出随土壤深度增加含量逐渐增加的规律。白茅、獐毛、狗牙根和芦苇湿地SOC含量最高值均出现在0~20 cm土层,在20~100 cm深度范围土壤中的含量变化相对较小,比较稳定。
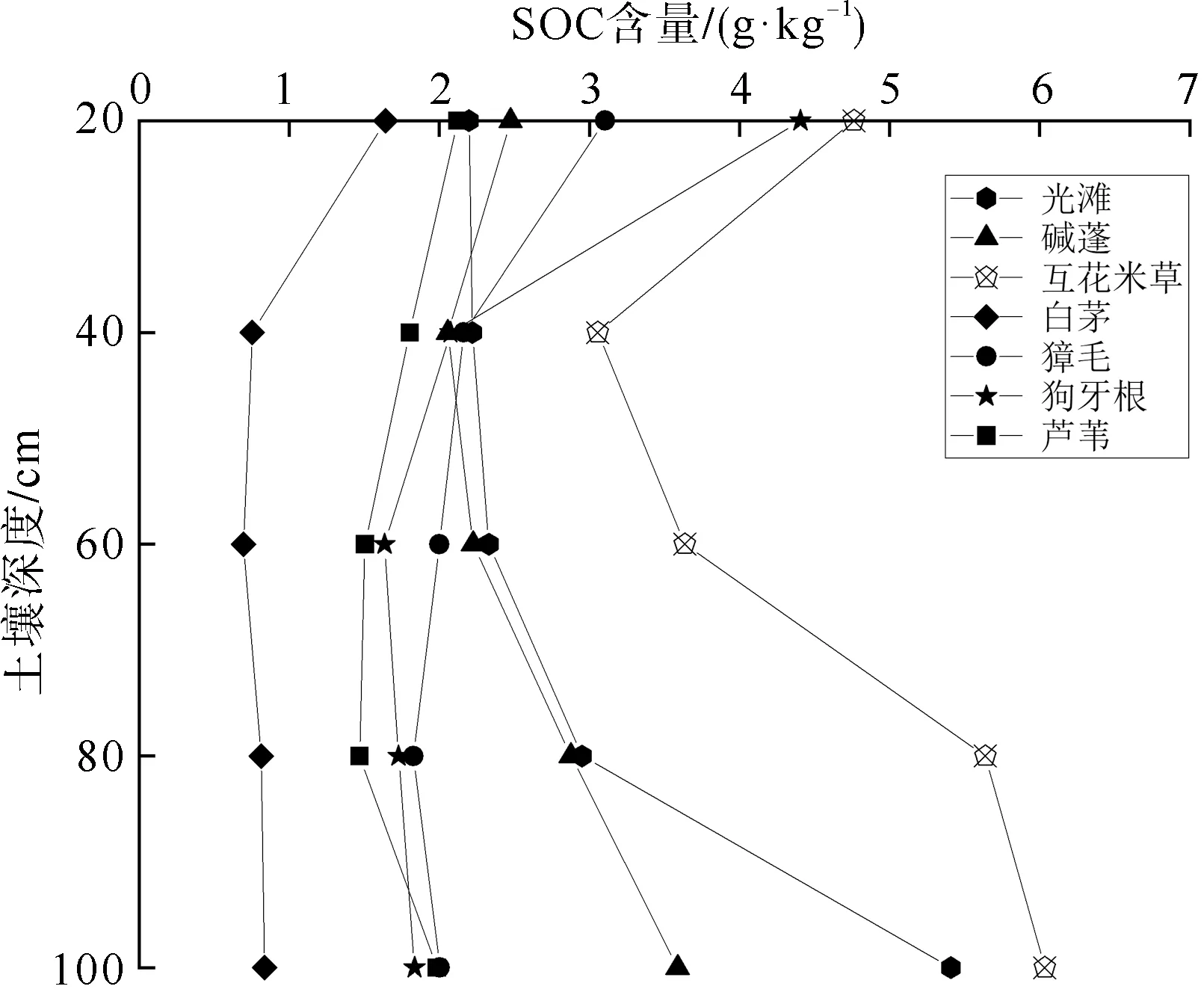
图3 不同植被群落SOC含量的垂直分布
大丰麋鹿自然保护区所处的辽阔苏北海岸属于淤涨型平原淤泥质海岸,为了加速滩涂淤积,大丰区于1982年试栽了互花米草,该物种在1992—1999年迅速蔓延生长,至2000年后生长速度渐趋于稳定[32]。由于互花米草本身较高的初级生产力和加速沉积能力[33],在起到良好促淤效果的同时,也逐渐取代了芦苇、碱蓬等本地植物,成为主要潮滩植被群落。为了遏制互花米草的蔓延趋势,保护区于2010年和2016年建设了淡水人工沟渠(图1)。这些人工沟渠切断了互花米草间的水文连通,使保护区内互花米草的蔓延得到有效抑制,生物多样性得到一定恢复。而互花米草从光滩定植,到扩张取代本地植物,再消退被其他植物取代的植被演替动态,对湿地SOC的垂直分布产生了重要影响。和本文的研究结果相似,Gao等[34]分析了互花米草入侵后苏北潮滩沉积物中有机碳来源的变化,发现光滩、碱蓬和芦苇湿地有机碳垂直分布特征明显受互花米草入侵后潮滩演化的影响,在垂向分布上呈非单调波动变化。
2.1.3 土壤有机碳含量的季节动态变化
研究区不同植被类型SOC含量的季节变化特征如图4所示,湿地SOC含量总体表现为10月(秋季)>8月(夏季)>4月(春季)>1月(冬季),季节间不存在显著差异(p>0.05)。和訾园园等[5]的研究一样,土壤有机碳含量在冬季最低。冬季较低的温度导致土壤微生物活性低,限制了微生物对碳的分解。光滩、白茅、狗牙根和芦苇湿地SOC含量在四季没有显著差异,碱蓬夏季SOC含量(4.10±0.40 g·kg-1)显著高于其他季节(p<0.05),獐毛秋季SOC含量(3.14±0.14 g·kg-1)显著高于其他季节(p<0.05)。在所有湿地类型中,互花米草SOC含量在四季均为最高值,且秋季SOC含量(5.74±0.73 g·kg-1)显著高于其他季节(p<0.05)。其原因除了互花米草具有较高的地上生物量外,还因为互花米草受潮汐作用影响,随海水带来的外源有机质在夏季潮汐作用减弱后被滞留在湿地内,增加了互花米草湿地SOC含量[5]。此外,互花米草秋季SOC含量随植被由低到高呈现出递增规律,即米草-L(4.83±3.71 g·kg-1)<米草-M(5.67±2.07 g·kg-1)<米草-H(6.72±1.20 g·kg-1)。

图4 不同植被群落SOC含量季节动态变化
2.2 滨海湿地土壤有机碳含量与土壤理化因子的相关性分析
对研究区SOC含量与土壤理化因子进行相关性分析(图5),发现土壤SOC含量与土壤总氮、含水率、电导率、C/N呈极显著的正相关关系(p<0.01),与土壤容重、pH呈极显著的负相关。其中,SOC与土壤总氮、含水率、C/N之间相关性很强,相关系数分别达到了0.86、0.81、0.85。此外,容重、含水率、pH等其他土壤理化因子之间也具有不同程度的相关性,因子之间相互作用,对土壤SOC含量和储量产生影响。

图5 SOC含量与土壤理化因子的相关性分析
湿地土壤中的氮主要来源于大气沉降、潮汐输送以及植物凋落物的输入,其数量和质量会影响植被生物量和凋落物的数量,这是土壤SOC的主要来源[35]。土壤SOC和总氮呈极显著的线性正相关(p<0.01),表明氮在湿地土壤中主要以有机氮的形态存在[36]。土壤C/N的高低可以在一定程度促进或抑制土壤微生物的活性,反映土壤有机质的分解速率。低C/N(<25)表示分解速度很快,而高C/N(>25)表明土壤有机物的分解速度越来越慢[37]。本研究中,土壤C/N介于0.94~12.21之间,整体比值较低,说明保护区土壤SOC的腐殖化程度较高,有机质的分解速度较快。
土壤容重和pH通过影响土壤的吸附能力,进而影响土壤有机质的矿化速率[38]。研究区土壤容重在0.19~1.81 g·cm-3,平均值为1.49 g·cm-3。土壤容重反映了土壤孔隙度的大小,通过影响土壤水、热、气,改变微生物对凋落物的分解速率,进而对土壤SOC含量产生影响[5]。土壤pH还通过影响微生物活性,对湿地土壤SOC的含量和分布产生影响。微生物在pH6~8范围内最活跃,在碱性条件下会被抑制[39]。在本研究区内,土壤pH介于8.31~9.65,表明土壤呈碱化状态。土壤SOC与pH之间存在显著的负相关,表明微生物活动仍能影响研究区土壤SOC的含量。
近几十年来,学者们认为土壤中矿物有机结合物的形成是碳稳定和碳存储的重要机制,而这一过程可能会受到土壤湿度水平的影响[40]。Kang等[41]也发现土壤含水率的变化会影响土壤pH和电导率,进而影响土壤微生物的活性,改变微生物对SOC的分解和固定。对于土壤SOC含量与含水率之间的关系,在不同的研究中存在不同的结论。陈怀璞[42]通过对崇明东滩湿地进行研究,得到土壤含水率与土壤碳储量呈负相关关系。而许鑫王豪等[29]通过对比盐城滨海湿地不同植被覆盖下表层土壤总有机碳与土壤含水率之间的关系,发现二者之间呈显著正相关,这与本研究结论一致。在滨海湿地,产生这种结果差异的原因可能是土壤受潮汐作用、外源物质输入等的影响。
2.3 滨海湿地土壤有机碳储量分布特征
2.3.1 滨海湿地不同植被群落土壤有机碳密度垂直分布特征
研究区不同植被群落SOC密度沿土壤深度分布情况如图6所示,植被群落在不同土壤深度间存在显著差异。光滩和碱蓬湿地SOC密度表现出随土壤深度增加而增大的趋势,在80~100 cm土层达到最高值,且光滩SOC密度在80~100 cm土层显著高于其他土层(p<0.05)。互花米草在60~80 cm土层(1.51 kg·m-2)和80~100 cm土层(1.52 kg·m-2)SOC密度近似相同,显著高于0~60 cm土层(p<0.05),该植被群落SOC密度整体表现为:80~100 cm>60~80 cm>0~20 cm>40~60 cm>20~40 cm。白茅、獐毛和狗牙根湿地SOC密度最高值均出现在表层0~20 cm土层中,其中白茅和狗牙根湿地表层SOC密度显著高于其他土层(p<0.05),獐毛各土层SOC密度差异不具有显著性。芦苇SOC密度在不同土层间波动较大,在80~100 cm土层(0.66 kg·m-2)具有最高值。从整体平均值来看,研究区7种典型滨海植被群落SOC密度随土壤深度的增加呈现出近似“V”形的分布特征,最高值出现在80~100 cm土层,最低值出现在20~40 cm土层。不同湿地类型地表覆盖物的差异对土壤SOC含量和SOC密度的影响存在一定程度的差异,除了受土壤容重的影响,也与湿地水文环境、地质地貌等相关[43]。
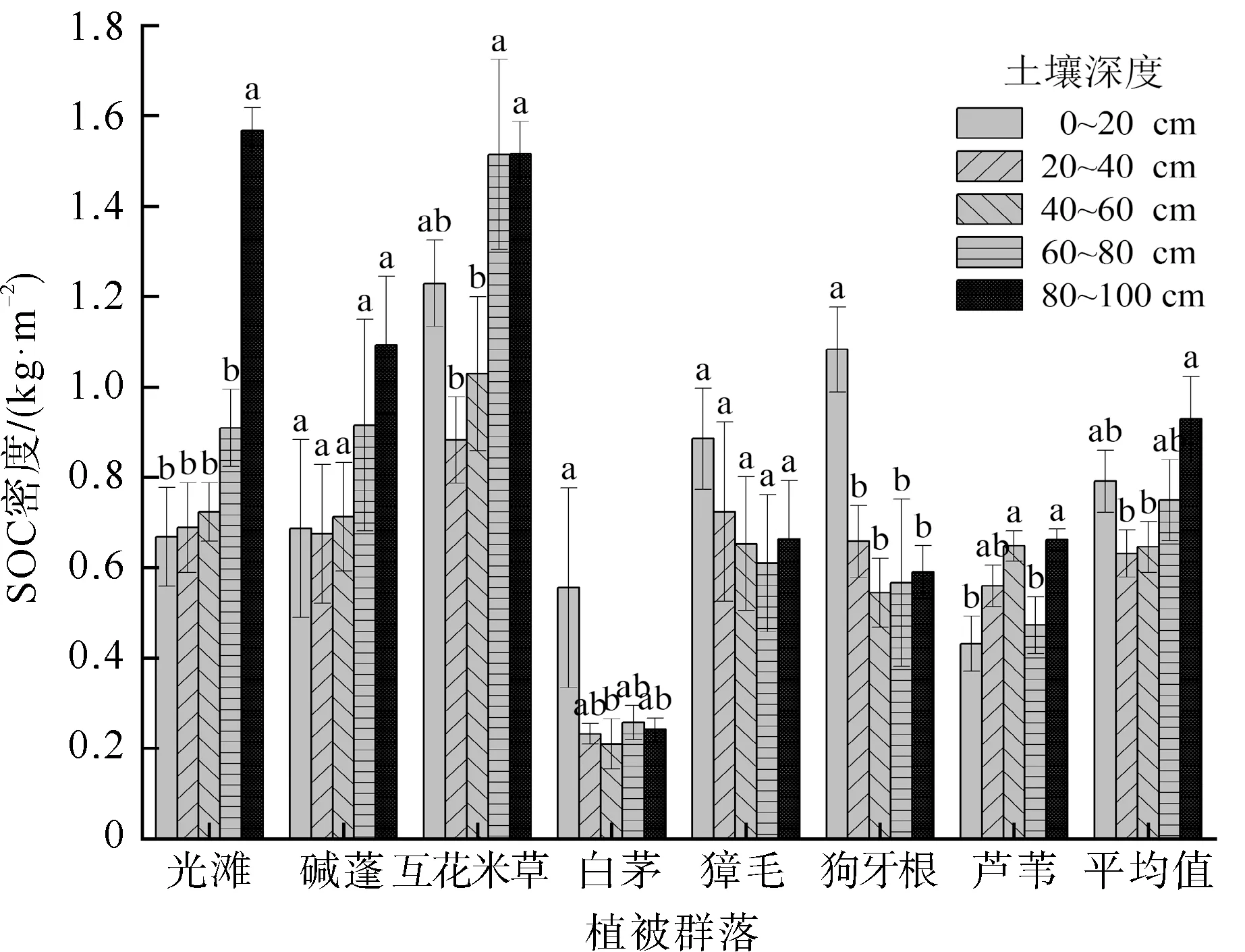
图6 不同植被群落SOC密度垂直分布特征
2.3.2 滨海湿地土壤有机碳储量估算
通过对各层土壤SOC密度相加,估算了滨海湿地不同植被群落单位面积SOC储量(表1)。研究区不同植被群落单位面积SOC储量在0.65~7.32 kg·m-2范围内,平均值为3.71 kg·m-2。各类型湿地年平均SOC储量整体表现为:互花米草>光滩>碱蓬>獐毛>狗牙根>芦苇>白茅。其他研究发现,崇明东滩SOC储量为2.32 kg·m-2[42],胶州湾滨海湿地为5.09 kg·m-2[5],墨西哥湾北部滨海湿地为3.4~4.7 kg·m-2[44],而大丰麋鹿保护区不同植被群落SOC储量平均值为3.71 kg·m-2。这种结果间的差异,主要是由于不同研究区域土壤理化性质、采样深度、采样时间等的差异。

表1 不同植被群落单位面积SOC储量的季节变化特征
3 结论
(1)大丰麋鹿国家级自然保护区第三核心区不同植被群落SOC含量介于0.95~4.63 g·kg-1,在7种湿地中,SOC含量表现为互花米草>光滩>碱蓬>狗牙根>獐毛>芦苇>白茅。受植物入侵、植被演替、麋鹿放养等的影响,不同湿地类型SOC含量在垂直方向的分布呈现非单调趋势,在0~40 cm土壤中,所有植被群落SOC含量的垂直分布规律大致相同,即随土壤深度增加SOC含量下降。
(2)在季节变化上,研究区不同植被群落SOC含量总体表现为10月>8月>4月>1月。在所有湿地类型中,互花米草SOC含量在四季均为最高值,且秋季显著高于其他季节。受植被、水文、温度等影响,土壤SOC含量与土壤总氮、含水率、电导率、C/N呈显著的正相关,与土壤容重、pH呈显著的负相关。
(3)研究区土壤SOC储量在0.65~7.32 kg·m-2,平均值为3.71 kg·m-2。各植被群落在不同土壤深度间存在显著差异,SOC密度随土壤深度的增加呈现出近似“V”形的分布特征,最高值出现在80~100 cm土层,最低值出现在20~40 cm土层。
植被对滨海湿地土壤有机碳的含量和分布有着重要影响。互花米草的入侵明显增加了潮滩有机碳的积累,其演替过程也对湿地生态系统碳循环及碳的空间分布产生了重要影响。但由于采样深度和样品分层等方面的差异,导致在垂直方向上土壤有机碳储量的估算有较大变异性,后续需加强对深层土壤的研究,同时应细化土壤分层,并从土壤粒度及沉积物来源等方面进一步提高土壤碳储量的估算精度。
