半滑舌鳎循环水养殖系统中生物滤池细菌多样性及功能预测分析
2022-06-29陈春秀何晓旭刘张倩于燕光郑德斌宓慧菁戴媛媛
马 超, 贾 磊,* , 陈春秀, 何晓旭, 刘张倩, 于燕光 郑德斌, 宓慧菁, 戴媛媛, 周 律
(1.天津市水产研究所,天津 300221;2. 清华大学环境学院,北京 100091)
引 言
半滑舌鳎(Cynoglossussemilaevis)是我国广受市场认可的海水工厂化养殖鱼类,其主要养殖方式为全封闭式循环水养殖,该模式具有节水节能、生态环保、高密度养殖等优势,能够解决环境污染问题,提高水产品质量。针对于养殖系统中残饵溶蚀和粪便产生的氨氮过量积累[1],循环水系统中生物过滤技术可降低氨氮、亚硝酸盐氮等有害物质的浓度达到养殖水体循环使用的目的[2]。生物滤池是循环水系统有效运行的核心环节,而其中生物膜的细菌群落又起到了关键作用[3-6]。
近年来,国内外学者采用各种方法分析研究了循环水系统中生物滤池细菌群落,如用16S rRNA基因克隆文库[7-8]、PCR-DGGE[9-10]等,相比这些传统方法,宏基因组方法更能全面深入了解微生物群落组成和多样性。虽然也有很多学者应用高通量测序方法对循环水系统细菌群落进行了研究[11-12],但多数只关注于细菌群落结构(α和β多样性),无法对其功能展开研究。目前,PICRUSt[13]功能预测分析在细菌群落多样性分析中已经广泛应用[14-16],但在循环水生物滤池细菌研究中应用较少,它的应用将为探明生物滤池细菌群落组成和功能提供重要帮助。本研究从半滑舌鳎海水循环水养殖系统三级生物滤池中采集水样及生物填料上的生物膜,运用高通量测序技术,对生物膜细菌群落多样性及功能预测进行初步研究,揭示了生物滤池内部细菌群落的多样性,为进一步揭开研究生物滤池脱氮效果提供数据,对海水循环水系统中生物滤池的构建、优化及提高脱氮效率具有重要的指导意义。
1 材料与方法
1.1 试验材料
半滑舌鳎循环水养殖系统建于天津滨海新区天世农水产养殖有限公司,该系统自2018年1月开始运行, 其水处理流程由养鱼池、微滤机、臭氧-蛋白质分离器、浸没式生物过滤器、紫外线消毒等环节组成,系统运行稳定,日换水量约占总的 5%,循环次数为 20 次/d。2018 年4月开始养殖半滑舌鳎,于2019年4月采集样品,分别从同一循环水系统的三级生物滤池随机采集生物膜样品及水体样品。按照水流方向顺序将生物滤池分别标为1号、2号、3号,并在每个滤池中选取3个采样点用灭菌后的剪刀剪取弹性毛刷样品约30 g放入50 mL灭菌离心管中;并用2 L无菌采水瓶采集水体样品。所有生物膜及水体样品各取平行样3组(1号生物滤池生物膜样品:A1,A2,A3;2号生物滤池生物膜样品:B1,B2,B3;3号生物滤池生物膜样品:C1,C2,C3;1号生物滤池水样:A4,A5,A6;2号生物滤池水样:B4,B5,B6;3号生物滤池水样:C4,C5,C6)。所有样品保存于预先灭菌的冰盒中,并迅速运回实验室进行后续处理。
1.2 试验方法
1.2.1 样品总DNA提取
所有水样用直径为0.22 μm的无菌微孔滤膜(津腾,中国)抽滤,滤膜剪碎后放入 50 mL无菌离心管中,按照E.Z.N.A.® Water DNA Kit (Omega Bio-Tek, Norcross, GA, USA)试剂盒的说明,提取水体中的样品总DNA;所有生物膜样品管中注入PBS缓冲液(0.15 mol/L NaCl,0.1 mol/L Na 2 EDTA,pH 值 8),使用漩涡振荡器进行震荡 5 min,反复操作 8~10次,收集水样,将水样14 000 r/min 离心 15 min(4℃),收集沉淀用于DNA提取,基因组DNA釆用FastDNA SPIN Kit for soil(MP Biomedicals, Illkirch, France)按照操作说明提取。
1.2.2 PCR扩增和高通量测序
采用细菌通用引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′ ) 和926R(5′-CCGTCAATTYYTTTRAGTTT-3′)对16S rRNA基因的V4-V5区域进行PCR扩增, PCR反应条件为94 ℃ 2min;94 ℃30 s, 56 ℃ 30 s,72 ℃ 30 s,72 ℃ 5min,10 ℃ 保温,8个循环,并用1.2%琼脂糖凝胶电泳检测。在Illumina MiSeq 2×300 bp平台上由微基生物科技(上海)有限公司完成测序。
1.2.3 数据分析
所有序列在97%的相似水平下被归纳为多个OTU(operational taxonomic unit),使用软件Mothur进行生物信息统计分析,然后比对进行物种信息注释使用的是SILVA128数据库。用Mothur生成稀疏曲线、α-多样性指数,UniFrac距离的主坐标分析(PCoA)、聚类分析等。采用在线统计工具LEfSe分析生物膜与水体中细菌的丰富度差异。生物膜功能和代谢途径预测采用PICRUSt软件进行分析,基于在线分析平台(http://picrust.github.io/picrust/)[13]将16S rRNA测序结果与KEGG数据库进行比对,获得功能预测信息。
2 结果与分析
2.1 高通量测序结果和α-多样性
高通量测序结果表明,生物滤池中所有生物膜样品和水样的平均测序有效序列条数分别为44755和44084。结果表明所有样品具有丰富的群落组成(表1),其中水样的Sobs、Ace、Chao1指数均高于生物膜样品,说明水样中的细菌种类更多,细菌群落的丰富度较高。

表1 不同样品细菌多样性评估表
2.2 稀释性曲线
稀释性曲线用来说明样本的测序数据量是否合理,及评价测序量是否足以覆盖所有类群。本研究中18个生物滤池中的样品细菌稀释性曲线如图1所示,随着测序深度的增加物种丰富度也开始增加,但在测序条数达到20 000条以上时,曲线趋向平缓。结果表明本研究的实验测序数据量合理,更多的数据量只会产生少量新的OTU,已经能够代表物种的丰富度。
2.3 细菌群落组成
高通量测序结果表明,生物滤池中细菌主要由27个门组成,包括变 形 菌 门(Proteobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、蓝藻细菌门(Cyanobacteria) 等(图2),其中变形菌门在所有样品中都是最优势门类,在9个生物膜样品中优势门类前三的细菌门类分别为变形菌门(Proteobacteria,49%~66%),拟杆菌门(Bacteroidetes,15%~36%),浮霉菌门(Planctomycetes,5.6%~11.7%);而生物滤池中的水体样本中的前三细菌门类分别为变形菌门(Proteobacteria,66%-80%),蓝细菌门(Cyanobacteria,5.7%~10.2%),拟杆菌门(Bacteroidetes,5.9%~10.1%)。
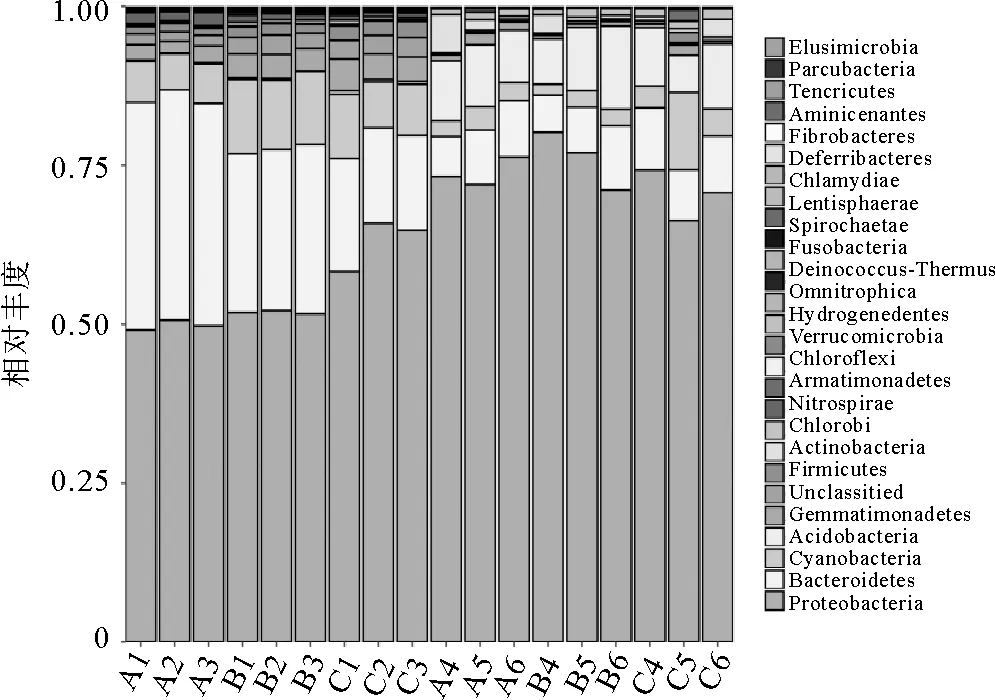
图2 不同样品门水平上细菌相对丰度分布
两组样品微生物群落在属分类水平均值分布情况如图3,其中生物膜组样品主要菌属有Muricauda(7.46%),Pseudomonas(3.88%),Maribacter(2.31%),其中属于硝化细菌只有2类细菌,即氨氧化菌的亚硝化单胞菌属(Nitrosomonas)和亚硝酸盐氧化菌硝化螺菌属(Nitrospira),丰度均小于0.05%,生物膜样品中含有59%未能分类的细菌。而养殖水体样品中占比最高的菌属是Pseudomonas(47.18%),其次是Pseudomonas(3.71%)和Vibrio(2.86%)。

图3 不同样品属水平上细菌相对丰度分布的分组均值
2.4 β-多样性分析
基于unifrac距离的PCoA(principal co-ordinates analysis)和UPGMA(Unweighted pair group method with arithmetic mean)分析均能描述不同样品间是否有显著的微生物群落差异,如果两个样品的距离较近,那么则表示这两个样品的微生物群落组成较相似。本研究中的海水循环水养殖系统中生物滤池及其水样细菌群落PCoA分析(unweighted unifrac)如图4所示,在图中所有生物膜样品位于PC1轴左侧,且每个生物滤池中的3个平行样品距离较近,并远离其他2组;所有水体样品位于PC1轴右侧,除C5样品外有较好的聚集性,且PC1轴的贡献率达到了94.78%。UPGMA聚类分析结果(图5)与PCoA分析结果相似,生物膜和养殖水体样品分为2大组,以上结果均表明生物滤池中生物膜和养殖水体细菌群落结构有所差异,并且所有水体的细菌群落结构差异不大,但不同生物滤池中生物膜细菌群落结构有所差异。
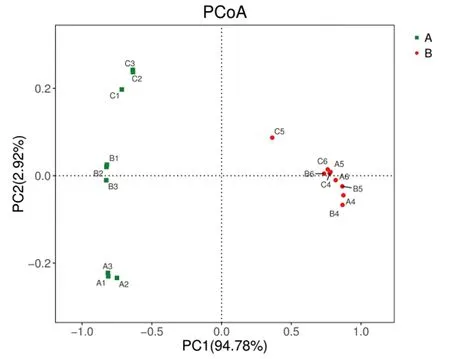
图4 生物滤池细菌多样性的主坐标分析
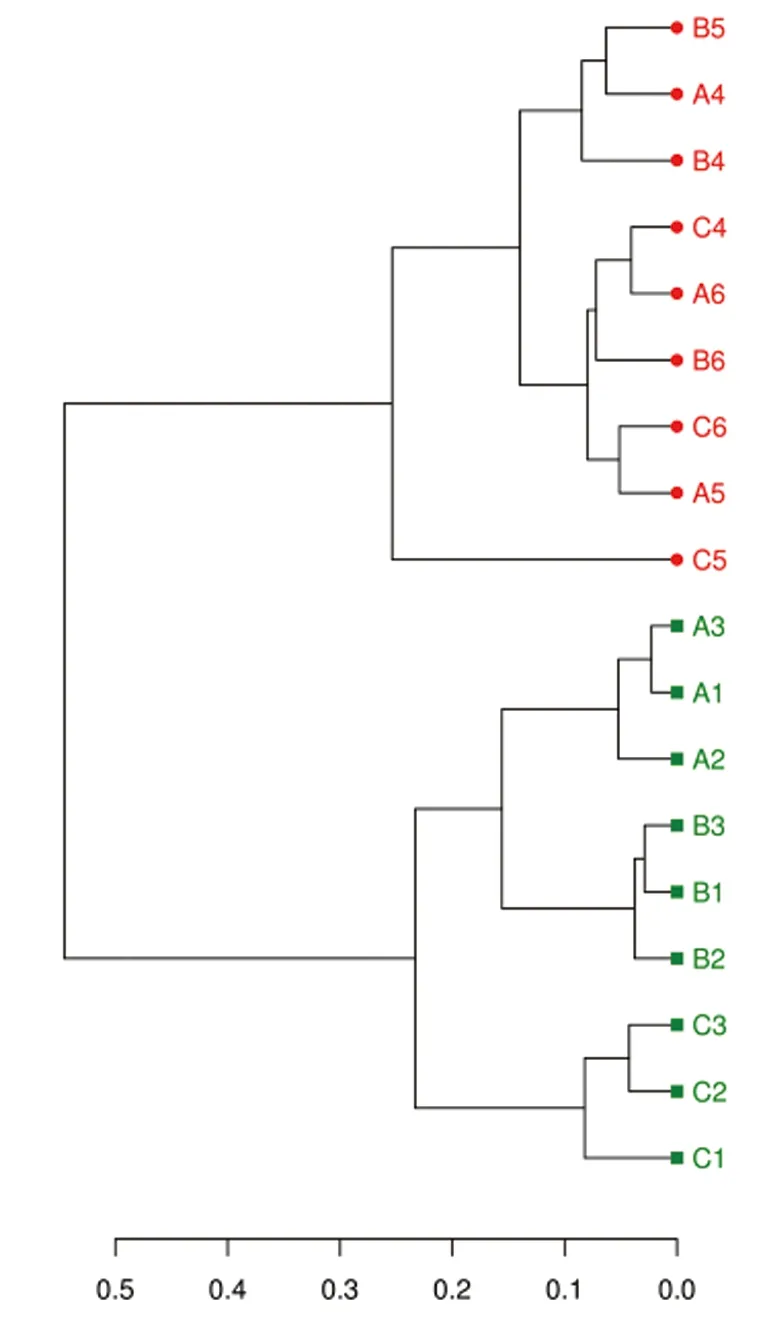
图5 不同样品UPGMA聚类图 Fig.5 UPGMA clusters of different bacterial communities
2.5 LEfSe组间群落差异分析
通过使用在线统计工具LEfSe来进一步分析生物膜与水体中细菌的丰富度差异,可以找出对样品划分产生显著性差异影响的群落或种属,结果用聚类树来表示(图6)。结果表明,在门的水平上,生物膜样品中6个门(Bacteroidetes、Planctomycetes、Acidobacteria、Gemmatimonadetes、Chlorobi和Armatimonadetes)的细菌存在显著差异;水体样品中4个门(Proteobacteria、Cyanobacteria、Firmicutes和Actinobacteria)的细菌存在显著差异。在属的水平上,生物膜样品中疣微菌门的Roseibacillus,浮霉菌门的Phycisphaera,酸杆菌门的Blastocatella,拟 杆 菌 门 的Muricauda、Psychroserpens、Chryseolinea,变形菌门的Mesorhizobium、Sphingorhabdus、Octadecabacter等 26个属的细菌存在显著差异; 水体中厚壁菌门的Brevibacillus,酸杆菌门的Acanthopleuribacter,拟杆菌门的Rubidimonas、Bacteroides和Dokdonia,变形菌门的Photobacterium、Vibrio、Pseudoalteromonas和Oceaniserpentilla等14个属的细菌存在显著差异。

图6 不同样品差异细菌分布
2.6 PICRUSt功能预测分析
为了获得生物滤池生物膜细菌的功能,本研究采用PICRUSt软件进行菌群预测分析。通过比对KEGG数据库(Kyoto encyclopedia of genes and genomes),共获得6类生物代谢通路功能分析(一级功能层),其中主要包括代谢(metabolism)、遗传信息处理(genetic information processing)、环境信息处理(environmental information processing)等(图7),占比分别为51.00%~52.35%、15.17%~16.73%和11.05%~14.01%。对预测基因三级功能层进行分析,发现其主要由Transporters、General function prediction only、ABC transporters、DNA repair and recombination proteins等76个子功能组成,所有的样品均发现有氮代谢功能(Nitrotoluene degradation)基因存在,且通过聚类分析表明,各级生物滤池生物膜细菌群落功能有所差异。

图7 生物膜细菌群落PICRUSt功能预测分布(一级功能层)
3 讨论
3.1 海水循环水养殖系统生物滤池细菌群落组成
目前循环水养殖系统生物滤池细菌群落组成的研究在国内外已有开展[11,17-18]。Tal等[19]对海水金头鲷循环水养殖系统生物膜进行了DGGE分析,发现滤池中有起硝化作用的氨氧化细菌和亚硝酸盐氧化细菌(Nitrosomonascryotolerans)和硝化螺菌(Nitrospiramarina)。本实验则采用Illumina公司MiSeq测序平台对3级生物滤池中生物膜和水体细菌群落组成进行了研究,发现其主要由变形菌门、拟杆菌门、浮霉菌门、蓝藻细菌门等27个门,Nitrospira、Sphingomonas、Haliangium、Lysobacter、Gemmatimonas、Pseudomonas等属的细菌组成,表现出细菌群落组成的丰富性。有研究表明变形菌门是海洋环境中的主要类群[21-22],本研究中发现生物滤池中的生物膜和养殖水体最优势菌群都是变形菌门,与Martins等[23]研究海水循环水养殖系统细菌群落结果一致。本研究对三级生物滤池细菌群落进行了分析,结果表明不同生物滤池生物膜细菌群落结构具有差异,细菌群落组成的PCoA分析表明3级的生物滤池中的养殖水体细菌群落结构较为相似,生物膜细菌群落组成各不相同。
3.2 生物滤池中硝化作用分析
通过使用在线统计工具LEfSe分析结果发现,生物膜与水体中的浮霉菌门细菌存在明显差异,且在生物膜上发现有5.6%~11.7%的浮霉菌门细菌(图2)。有研究发现在厌氧条件下,某些种类的微生物能够发生以NO2-为电子受体, 以NH4+为电子供体, 将NH4+和NO2-转变为氮气的生化过程[24-27]且这些微生物的系统发育地位属于浮霉菌门细菌(Planctomycetes)[28],因此推断本研究循环水系统中生物膜含有大量浮霉菌门细菌参与进行硝化作用。有研究表明,水体中常见与氮循环有关的细菌主要由α-、β-、γ-、δ-变形菌等组成,氨氧化细菌(ammonia oxidizing bacteria,AOB)主要有β-变形菌纲的亚硝化单胞菌(Nitrosomonas)、亚硝化螺菌属(Nitrosospira)和γ-变形菌纲的亚硝化球菌属(Nitrosococcus)等[29]。在属水平上,本研究中生物滤池硝化细菌只有2类细菌,即氨氧化菌的亚硝化单胞菌属(Nitrosomonas)和亚硝酸盐氧化菌硝化螺菌属(Nitrospira),丰度都不高,并且在生物膜发现上含有超过50%未能分类的细菌(图3)。之前就有研究表明,有细菌能够进行从氨到硝态氮的全部硝化过程[30-32],这些微生物被定义为全程氨氧化微生物Comammox,并且Crab等研究循环水养殖系统时同样发现了此类细菌。所以生物膜上可能附着未能在数据库中进行分类的全程氨氧化微生物。综上所述,在本研究中的海水循环水养殖系统生物滤池的生物膜起到了主要的硝化和反硝化作用,虽然生物膜上含有少量的亚硝化单胞菌属和亚硝酸盐氧化菌硝化螺菌属细菌,但是同时发现大量的浮霉状菌和未能分类的细菌,推断这些细菌有可能起到主要硝化作用,这些硝化细菌的反应效率及条件还有待进一步研究。
3.3 PICRUSt功能预测分析
之前关于循环水系统生物滤池细菌群落的高通量测序分析主要关注于细菌群落结构(α和β多样性),对于其功能的研究开展较少[7,17]。基于高通量测序的PICRUSt功能预测分析在各种不同生境微生物研究中已经开始应用。张菲等[15]采用PICRUSt功能预测分析对丹江口库区表层浮游细菌进行研究时发现,表层浮游细菌涉及氨基酸运输和代谢、转录等24个基因功能家族,且氮代谢能力整体趋势为库心高于渠首。Cleary等[16]采用高通量测序方法对印度尼西亚的Spermonde 群岛周边海水、沉积物等细菌群落进行研究,并使用PICRUSt预测其功能,结果发现不同样品细菌群落功能上具有差异。目前PICRUSt功能预测分析在海水循环水养殖系统生物滤池中生物膜研究中鲜见报道,为了探明不同级别的生物滤池生物膜上细菌功能,本研究将高通量测序的结果使用PICRUSt软件进行菌群预测分析。结果表明,生物膜上细菌主要涉及代谢、遗传信息处理和环境信息处理等6 类生物代谢通路,表现出生物膜在功能上的丰富性。通过PCoA和UPGMA分析生物膜细菌群落时发现各级生物滤池生物膜细菌群落组成所有差异,且PICRUSt预测结果也表明各级生物滤池生物膜细菌功能也有较大差异,所以推断不同的细菌群落组成造成了各级生物膜功能的差异。所有的样品在第三级功能层均发现有氮代谢功能(Nitrotoluene degradation),说明所有生物膜细菌群落均具有氮元素循环功能。该结果初步分析了海水循环水养殖系统生物滤池中生物膜细菌功能的差异,但是使用PICRUSt软件进行菌群功能预测分析时有一定的局限性,为了更准确的掌握生物膜降低养殖水体中氮、磷等元素过程中的菌群功能,还需在以后的研究中结合宏基因组测序和氮磷等元素循环功能基因分析。
4 结论
针对半滑舌鳎海水循环水系统生物滤池细菌群落和功能研究鲜见报道的现状,采用16S rRNA基因测序技术分析对其细菌群落组成进行分析,并采用PICRUSt软件预测其功能.结果表明3级生物滤池具有丰富的群落组成,主要由变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、蓝藻细菌门(Cyanobacteria)等为主;生物膜上含有少量的亚硝化单胞菌属和亚硝酸盐氧化菌硝化螺菌属细菌,不同生物滤池中生物膜细菌群落结构有较大差异,并且推断生物膜中含有大量浮霉菌门细菌和未能分类的细菌参与进行硝化作用,PICRUSt功能预测分析表明生物膜上细菌主要涉及代谢、遗传信息处理和环境信息处理等6类生物代谢通路,各级生物滤池生物膜细菌群落功能有所差异,所有样品均发现有氮代谢功能(Nitrotoluene degradation)的基因。本研究从细菌群落组成、细菌群落多样性及功能预测等角度初步分析了海水循环水系统3级生物滤池生物膜的差异,为循环水系统高效运行提供了参考依据。
