黄粉虫(Tenebrio molitor)肠道中聚乳酸塑料降解菌的筛选及其降解特性
2022-06-29朱廷恒罗春萍杨佳玥祝思瑜
冯 娟,朱廷恒,罗春萍,杨佳玥,祝思瑜,李 彤
(1.台州科技职业学院 农业与生物工程学院,浙江 台州 318020; 2.浙江工业大学 生物工程学院,浙江 杭州 310014)
聚乳酸,又称聚丙交酯(polylactic acid,PLA),是以乳酸或丙交酯为单体聚合而成的高分子材料,具有优良的生物相容性和可生物降解性,在自然环境中可以彻底水解为CO和HO,是一种环境友好型的可降解塑料,被认为是最有希望代替石油基塑料的候选者。早期,由于PLA的生产成本较高,该材料主要应用于生物医学方面,如手术缝合线、外科移植等。随着相关制作技术的成熟,生产成本的降低,外加国家环保政策的引导,近年来,聚乳酸不仅应用于生物医学等方面,更在农林环保、纺织、3D 打印、材料等领域得到了广泛的应用。
目前,可降解PLA消耗逐年增长,其需求量已经出现井喷现象。虽然PLA最终能够在环境中彻底降解,但是降解周期较长。随着PLA产品的需求量增大,PLA的降解周期与效率也急需进一步的突破。若有简单、安全、高效的降解技术产生,必将进一步助推聚乳酸材料的应用,减少白色污染对环境的破坏。近年来,利用微生物降解PLA塑料,其降解过程具有反应条件温和、处理过程清洁、无污染、效率高等优势,已受到人们的关注;筛选快速高效降解PLA塑料的微生物,已形成研究PLA降解的热点。
昆虫肠道作为一种特殊的生境,生存着数量庞大、种类繁多的共生微生物,肠道内的微生物种类与功能表现出特异性。昆虫肠道微生物群落与其宿主的肠道结构、摄取食物结构相关联,经过长期的自然选择和协同进化,有些肠道微生物可通过降解难以被昆虫消化的食物从而为宿主提供营养。鉴于昆虫肠道与其肠道微生物菌群的关系,通过改变其摄取食物结构,富集某一类功能菌,使其变为优势菌,从而提高该类功能菌的筛选效率。Yang等用聚乙烯(polyethylene,PE)塑料喂养印度古螟()幼虫,在PE被幼虫取食之后,对该昆虫进行解剖,以PE塑料为唯一碳源的培养基进行培养,筛选出两株能够降解PE塑料的细菌,分别为肠杆菌YT1和芽孢杆菌sp.YP1。该研究首次发现自然界中存在能够降解PE塑料的微生物,为研究人员提供了利用昆虫肠道筛选微生物的新思路,从昆虫中分离降解菌也是开发高分子材料生物降解的重要途径之一。
黄粉虫()又称面包虫,属于鞘翅目,是全变态类昆虫,生长周期分为卵、幼虫、蛹与成虫4个阶段,一般一个世代需要90~100 d。黄粉虫幼虫富含脂肪和蛋白质等营养物质且容易大规模饲养,是一种低成本的可食用蛋白质来源,是肉鸡蛋白的一个合适的替代来源,主要用于动物饲料、食品加工、抗菌蛋白及医药保健品等,此外,有很多文献表明黄粉虫幼虫能啮食降解塑料。近年来,许多学者对黄粉虫及其肠道微生物降解聚苯乙烯、聚乙烯等塑料做了相关研究报道。王哲等综述了黄粉虫对塑料有较强的取食能力,指出合理利用并提高黄粉虫对塑料的降解能力,将其应用于实际解决白色污染问题。Peng等用聚乳酸等材料混合喂养黄粉虫幼虫,通过化学修饰和热修饰对黄粉虫摄取聚乳酸之后产生的粪便进行研究,表明黄粉虫肠道可消化PLA塑料;通过高通量分析,黄粉虫肠道微生物菌群中的链球菌科相对丰度由5.64% 增加到43.66%,螺旋菌科的相对丰度由4.80%增加到29.65%,表明黄粉虫摄取PLA塑料后明显改变了其肠道微生物菌群,从而富集了具有降解PLA能力的微生物。
Peng等指出,啮食PLA塑料之后,黄粉虫肠道的细菌菌群发生了明显改变。易力等指出,黄粉虫肠道及土壤环境中存在对聚乳酸塑料具有一定降解的细菌,分别为克雷伯氏菌属、克雷伯氏菌、克雷伯氏菌亚种、大肠埃希菌等。目前,有很多实验室具备筛选PLA降解微生物能力,但是对于具有降解PLA塑料的真菌类微生物、降解菌剂的开发及现实的应用等仍然缺少研究。Panyachanakul等采用透析法降低乳酸浓度,首次报道PLA在5 L生物反应器中的降解小试验,但国内外尚无可行可靠的具有产业化生产价值的降解PLA微生物或相关生物制剂的开发与应用的深入研究。因此,如何获得高效、应用性强、更广泛的PLA降解菌,提取高效降解酶,开发PLA降解工艺等,仍然是现在从事该研究的主要方向。本研究主要以啮食60 d聚乳酸的黄粉虫幼虫为实验材料,以PLA粉末固体培养基作为筛选培养基,筛选和分离出几种具有降解PLA能力的真菌,并对其中一株真菌毛栓孔菌()FJ001菌株进行菌株形态学观察、分子鉴定及降解特性分析的研究,试图筛选更多降解PLA的微生物,为PLA降解菌的研究、应用提供理论依据及菌质资源。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 黄粉虫
购买于台州市椒江花鸟市场,在室温(25±2) ℃的实验室环境下饲养60 d。
1.1.2 聚乳酸材料
350目聚乳酸粉末、聚乳酸薄膜由浙江绍兴不速之客材料有限公司提供。
1.1.3 试剂
实验主要试剂为化学纯,国药集团药业股份有限公司;Ezup柱式真菌基因组、DNA聚合酶、引物均由上海生工生物有限公司提供。
1.1.4 仪器设备
超净工作台,上海博讯有限公司;智能型光照培养箱,上海天恒医疗器械有限公司;摇床,常州金坛中旺公司;超低温冰箱,中科美菱低温科技股份有限公司;PCR仪,美国 Bio-Rad 公司;核酸电泳仪,北京六一生物科技有限公司;冷冻离心机,湖南湘仪仪器有限公司。
1.1.5 培养基
(1)无机盐液体培养基(无机盐培养基):称取KHPO0.7 g, KHPO0.7 g,NHNO1.0 g,NaCl 0.005 g,ZnSO·7HO 0.002 g,MnSO·HO 0.001 g,MgSO·7HO 0.7 g,FeSO·7HO 0.002 g,加蒸馏水溶解并定容至1 000 mL,调pH至7.2,121 ℃灭菌20 min。;
(2)PLA薄膜液体培养基:将PLA薄膜裁剪至约5 cm×5 cm大小,蒸馏水洗涤及浸泡15 min,60 ℃烘干4 h,2张为一份,于超净台中,浸泡到75%乙醇10 min后用无菌水洗涤3次,添加到装有已灭菌的100 mL无机盐液体培养基中,配置成PLA薄膜液体培养基。
(3)LB培养基:称取酵母抽提物5 g,胰蛋白胨10 g,氯化钠5 g,加入无机盐培养液1 000 mL,调pH 7.4,121 ℃灭菌20 min。
(4)PLA 粉末固体培养基:称取琼脂20 g,350目聚乳酸粉末20 g,加入无机盐培养液1 000 mL,121 ℃灭菌20 min。
(5)PDA培养基:称取马铃薯200 g,煮沸20 min后过滤取汁,加葡萄糖20 g,琼脂20 g,加蒸馏水定容至1 000 mL,115 ℃灭菌30 min。
(6)干酪素培养基:称取干酪素40 g,琼脂20 g,加蒸馏水定容至1 000 mL,调pH 7.0,121 ℃灭菌20 min。
(7)三乙酸甘油脂无机盐固体培养基:三乙酸甘油脂40 mL,琼脂20 g,加蒸馏水定容至1 000 mL,调pH 7.0,121 ℃灭菌20 min。
1.2 黄粉虫饲养
在室温(25±2) ℃的环境下饲养黄粉虫,对照组喂养麸皮(对照组),实验组喂养350目PLA粉末,每组各100条。饲养过程中,保持空气湿度为50%~70%,每隔72 h,喷洒一次无菌水。
1.3 黄粉虫肠道微生物分离、纯化和筛选
按照文献[15]的方法,取以350目PLA粉末喂食60 d大小基本一致的黄粉虫10条,在流水下冲洗5 min,置于超净工作台上,用75%乙醇对虫体消毒5 min,无菌水清洗3次;再在无菌平皿上,用镊子拉取肠道,放入无菌研钵中,加入2 mL 0.5%无菌NaCl溶液,用研磨棒快速研磨至无可见颗粒,制作成肠道微生物提取液。
取稀释倍数分别为10、10、10肠道提取液100 μL涂布于PLA粉末固体培养基上。30 ℃恒温培养3~7 d,挑选形态、大小、颜色等各异的菌落,在PLA粉末固体培养基上反复多次划线分离和纯化,获得纯菌落,4 ℃保存备用。
1.4 降解菌的鉴定
1.4.1 形态学观察
观察菌株在PLA粉末固体培养基上的生长状况,即形状、形态、颜色、产孢、菌丝等形态学观察及记录。
1.4.2 基因测序
以筛选出的微生物总基因为模板,采用真菌提取试剂盒提取DNA,用鉴定通用引物(ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′)扩增分离菌ITS序列,送至上海生物工程有限公司进行测序。将测序结果通过NCBI进行BLAST比对,下载相似度较高的参考序列后使用MEGA7软件内置的Clustal X程序进行序列的多重比对,使用Neighbor-Joining法构建系统发育树,所选模型为Kimura 2-parameter model,Bootstrap重复次数设置为1 000次。
1.5 降解菌毛栓孔菌(Trametes hirsuta)FJ001对PLA薄膜的降解性能研究
选取其中一株降解菌毛栓孔菌()FJ001为模式菌,研究其对PLA薄膜的降解性能。
1.5.1 失重法测量降解菌毛栓孔菌()FJ001对PLA的降解率
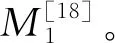
PLA膜失重率(%)=(-)/×100。
式中:为PLA薄膜初始质量,g;为PLA薄膜剩余质量,g。
1.5.2 外源营养物质对降解菌毛栓孔菌()FJ001降解性能的影响
将筛选的降解菌以2%的接种量接种于分别添加了1%葡萄糖、1%干酪素、1% SDS、1%蛋白胨及不添加其他外源营养物质的PLA薄膜液体培养基,培养30 d,期间每隔5 d,放瓶收集薄膜并计算PLA薄膜的失重率,绘制生长曲线,每种培养基做3个平行,并重复3次试验。
1.5.3 扫描电子显微镜观察降解菌毛栓孔菌()FJ001对PLA塑料薄膜表面的降解情况
PLA薄膜降解实验结束后, 收集实验组及对照组PLA薄膜,用双蒸水多次洗涤,自然风干,用ZEISS Gemini SEM 300发射扫描电子显微镜观察膜表面变化情况。
1.6 数据分析
采用Microsoft Excel 2013软件进行数据处理及图像绘制,并采用SPSS 18.0软件检验组间差异显著性,<0.05表示显著性差异。
2 结果与分析
2.1 两种材料喂养黄粉虫
麸皮喂养60 d的黄粉虫及其产生的粪便如图1-A所示,用PLA膜喂养60 d的黄粉虫和其产生的粪便如图1-B所示。麸皮喂养或PLA膜喂养,黄粉虫均能维持大于3个月以上生命或完成幼虫转化为蛹的生命周期。从PLA膜喂养的黄粉虫产生的粪便颜色可以判断黄粉虫有啮食PLA薄膜现象。将PLA薄膜换成PLA 350目粉末,粪便颜色皆为白色颗粒状,加入无菌水搅匀,放大160倍进行显微观察,黄粉虫粪便中未被完全消化的PLA粉末的形状与大小与未被处理过的 350目PLA粉末有明显的改变,表现为PLA粉末表面的棱角更为光滑,颗粒大小明显变小(图1-D、E),表明黄粉虫肠道能消化PLA粉末。
2.2 肠道真菌的分离与鉴定
2.2.1 降解菌的形态学观察与鉴定
将正常喂食麸皮的黄粉虫培养60 d的肠道提取液涂抹在PLA粉末固体培养基,30 ℃培养2个月以上,无任何微生物生长(图1-F);将PLA材料喂养60 d的黄粉虫肠道提取液,稀释至10倍后取100 μL提取液接种于PLA无机盐培养基,培养3 d以上,出现大量菌落(图1-G),经分离纯化得到11株微生物,其在PLA粉末固体培养基上呈现不同的菌落形态、颜色、形状,如图2所示;其具体形态特征及产孢情况如表1所示。其中编号为FJ001的菌株(图3-A)在PLA粉末固体培养基上菌丝生长旺盛,生长速度较快,本研究将其选为模式菌株,对其降解PLA的特性进行了分析。采用不同培养基培养FJ001菌株,观察其生长情况,结果如图3所示。在PLA粉末固体培养基上进行培养,FJ001菌株白色气生菌丝生长旺盛、无孢子、无色素产生,培养10 d后能铺满整个平板;采用PDA培养基培养后,FJ001菌株所形成的菌落形态、产孢、菌丝等与采用PLA粉末固体培养基培养的结果类似(图3-D)。FJ001菌株在含有0.2% PLA薄膜液体培养基中,30 ℃,180 r·min振荡培养过程中产生大量菌丝球(图3-B),电镜扫描显微镜观察可见明显丝状无孢子及产孢结构(图2-G、H)。采用只含有三乙酸甘油脂的无机盐固体培养基培养FJ001菌株,菌种无生长现象(图3-C)。接种到只含有干酪素的无机盐固体培养基中,可见明显的透明圈(图3-F)产生,初步判断该菌产生蛋白酶而不是脂肪酶的形式对PLA进行降解作用,蛋白酶促降解PLA机理可参考Qi等研究结果。

A,麦麸喂养60 d的黄粉虫及其产生的粪便;B,350目PLA薄膜喂养60 d的黄粉虫及其产生粪便;C,黄粉虫啮食聚乳酸薄膜;D,PLA粉末喂食黄粉虫粪便放大160倍显微观察;E,未处理聚乳酸粉末放大160倍显微观察;F,麦麸喂养60 d的黄粉虫肠道提取物接种在PLA无机盐培养基微生物生长情况;G,PLA喂养60 d的黄粉虫肠道提取物接种在含有PLA无机盐培养基中生长情况。

图2 十株菌株在PLA粉末固体培养基上培养情况
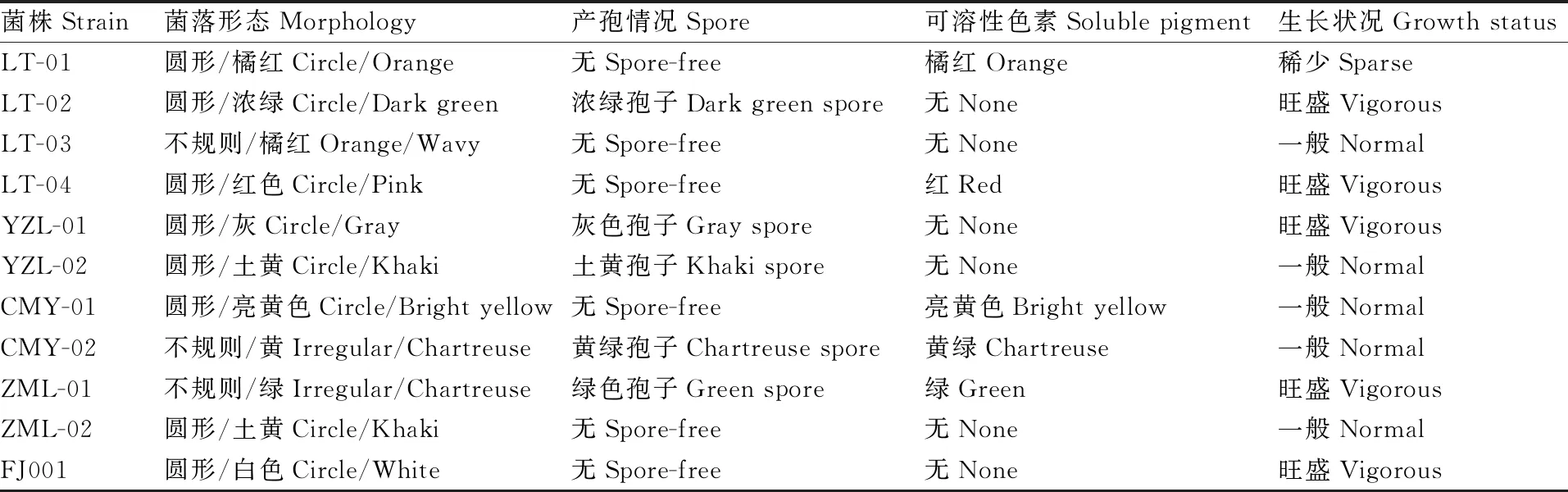
表1 十一株筛选菌株在PLA粉末固体培养基上培养情况

A,FJ001接种在PLA粉末固体培养基上培养10 d生长状态;B,FJ001接种在PLA薄膜液体培养基10 d摇瓶培养;C,FJ001接种在三乙酸甘油酯无机盐培养基生长状态;D、E,FJ001接种在PDA培养基培养10 d正反面;F,FJ001菌株在酪氨酸培养基形成的透明圈;G、H,电镜观察菌丝。
2.2.2 降解菌的分子生物学鉴定
系统发育树基于ITS序列,将菌株FJ001与属部分物种、属部分物种和属部分物种一起来重建它们的系统发生关系,从而鉴定分类地位。从系统发育树上可以看出(图4),菌株FJ001与菌株 MN856345.1WZ-219聚在一个进化发育分支上,且自展支持率为100%,两者序列相似性达到了99%以上,并与属其他物种处于不同的分支,从分类上属于一个属但属于不同的种。由此可以鉴定,菌株FJ001为属的。目前,本实验室筛选到的PLA降解菌毛栓孔菌()FJ001保藏于中国典型培养物保藏中心(CCTCC)。
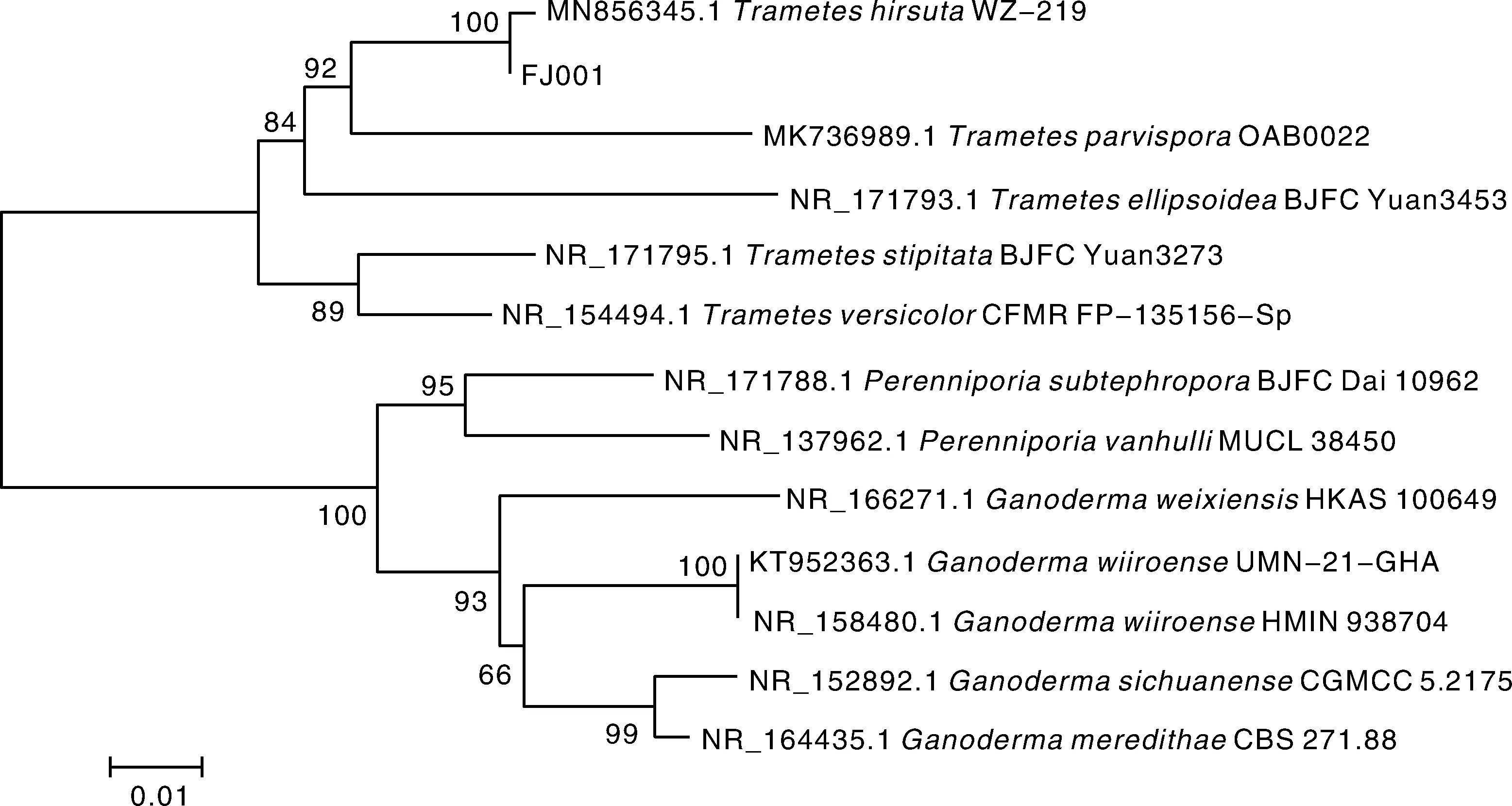
图4 降解菌FJ001菌株系统发育树
2.3 外源营养源对降解菌FJ001降解性能的影响
将降解菌FJ001以2%的接种量接种于分别添加了1%葡萄糖、1%干酪素、1%十二烷基磺酸钠(sodium dodecyl sulfate, SDS)、1%蛋白胨及不添加其他物质的PLA薄膜液体培养基中,经30 d的培养,每隔5 d进行称量,计算PLA薄膜的失重率,绘制降解曲线,如图5所示。结果表明,FJ001菌株在只含有0.2%的PLA薄膜的培养基上,培养30 d后,PLA薄膜的降解率达到了18.8%;在添加1%干酪素或添加1% SDS的条件下,PLA降解率为8.0%左右,远低于无添加外源营养源的PLA薄膜液体培养基中的降解率,表明这两种物质对FJ001菌株降解PLA薄膜具有抑制的作用。在添加1%葡萄糖条件下,PLA薄膜的降解率为20.1%。0~15 d,葡萄糖的添加对该菌的降解性能无促进作用,20 d后其表现优于PLA薄膜液体培养基。葡萄糖作为可直接利用的碳源,更容易被FJ001菌株所利用,在葡萄糖添加的培养前期,菌株侧重于菌量的积累,在生长中后期,相应的降解蛋白酶积累较多,从而提高了该菌株的降解能力。
图5 降解菌FJ001在不同营养条件下的降解性能
2.4 对PLA薄膜膜片的降解性能测定
将降解菌FJ001接种于PLA薄膜液体培养基中,37 ℃,180 r·min条件下培养5 d或30 d后,扫描电镜观察,对照组膜表面完整,无破损现象(图6-A、B);实验组可见膜表面变得易脆易破损,电镜下可见表面粗糙有破损现象,甚至有断裂现象(图6-C、D);该实验表明,降解菌FJ001对PLA薄膜具有一定的降解作用。

A,对照组PLA 膜(第10天);B,对照组 PLA 膜(第30天);C,FJ001作用下的 PLA 膜(第10天);D,FJ001作用下的 PLA 膜(第30天)。
3 结论与讨论
近年来,基于PLA作为新兴环保材料在自然界中堆积量较少且时间较短等特点,PLA材料的应用越来越广泛,对PLA降解微生物的研究随之增多。然而,从自然界中筛选得到的降解PLA微生物的种类和数量并不乐观。放线菌是第一个被发现可降解PLA的微生物菌群,其中包含拟无枝酸菌属、东方支链淀粉菌等,这一研究开创了人们利用微生物降解PLA的新策略。Butbunchu等认为,干旱和超干旱环境中可能存在PLA降解菌,范森等运用高通量对3种不同土壤菌群结构分析,指出土壤中生物群落丰富度和多样性越高,对PLA材料的降解作用越好,表明微生物的种类与数量对PLA材料的降解起到极大的作用。同时指出变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)是降解聚乳酸材料的优势菌群,黄杆菌科(Flavobacteriaceae)、丛毛单胞菌科(Comamonadaceae)和噬纤维菌科(Cytophagaceae)的微生物对聚乳酸材料的降解最有潜力。但是,可降解PLA的真菌的分离和相关研究尚不多见。本研究从黄粉虫肠道中筛选到可降解PLA的微生物,从形态特征上初步判断以真菌为主,相比其他学者筛选到以细菌、放线菌为主的微生物,本研究建立的方法更加容易筛选到具有降解PLA塑料潜力的丝状真菌。
国内外主要用三种方法筛选降解PLA微生物:直接采集土壤样品,涂布于含有PLA的培养基上,观察平板菌落周围的透明区域作为PLA降解的指标,再进行分离筛选;在土样或者培养基上增加PLA材料,富集和驯化降解PLA微生物,再进行分离筛选;再者将有降解聚乳酸潜力的微生物加入含有聚乳酸的土样或者培养基上,有目的地富集和提高降解聚乳酸微生物种类和能力。国内学者如贾昊等以使用聚乳酸/聚己二酸-对苯二甲酸丁二酯共混物(PLA/PBAT)地膜的土壤为样本筛选到一株多萨假单胞菌();林娟等以垃圾填埋场土样为材料筛选到的1株聚乳酸降解菌株;易力等以聚乳酸塑料饲喂黄粉虫幼虫,从黄粉虫肠道分离能降解聚乳酸塑料的克雷伯氏菌、大肠埃希菌等5株细菌。本研究以PLA塑料为单一食物长期喂养黄粉虫,改变其肠道菌群,再将肠道提取液涂抹在PLA粉末固体培养基分离出了具有降解PLA能力的微生物。通过设计添加350目PLA粉末的固体培养基作为唯一碳源选择性培养基,培养土样、暴露在空气或涂抹用正常喂养的黄粉虫肠道提取物,培养数月鲜有微生物产生。而用PLA塑料喂养黄粉虫的肠道提取物涂抹在PLA粉末固体培养基上,第3天开始有微生物长出。上述两种方法的结合,提高了筛选具有降解PLA潜力的微生物的效率。因此,利用黄粉虫啮食PLA塑料的特性,结合PLA粉末固体培养基是一种高效、快速筛选PLA塑料降解菌的方法。
本研究首次发现毛栓孔菌具有降解PLA塑料的能力,以PLA为唯一碳源的培养条件下,生长速度快、菌丝生长较旺盛。共代谢是指一些难降解有机物需要在微生物从其他底物获取碳源和能源的过程中被降解。本研究以1%的葡萄糖作为外加碳源时,培养20 d,FJ001菌株对PLA薄膜的降解率可达20.1%,对PLA的降解效果有所提高,推测其对PLA的降解存在共代谢机制。
本研究筛选到具有降解PLA塑料的11株真菌,其中一株毛栓孔菌(FJ001)在以PLA为唯一碳源的培养基上生长速度最快,菌丝旺盛,初步判断此菌能够快速降解PLA材料并利用其代谢产物合成自身所需的营养物质。本研究丰富了PLA降解菌的菌种资源,为进一步开展PLA降解研究和开发应用提供了理论基础。
