lncRNA MNX1-AS1通过调控miR-218-5p影响非小细胞肺癌细胞的增殖、凋亡及迁移
2022-06-28曹军营崔素娟刘高峰汤光耀张勇丁小勇
曹军营, 崔素娟, 刘高峰, 汤光耀, 张勇, 丁小勇
(联勤保障部队第九八八医院心胸外科,河南省郑州市450042)
长链非编码核糖核酸(long non-coding RNA,lncRNA)在细胞内转录比例比微小核糖核酸(micro-RNA,miRNA)更高,在调控蛋白编码基因和其他非编码基因的表达上同样发挥着重要的作用[1]。有研究表明lncRNA MNX1-AS1在前列腺癌等肿瘤组织中高表达,下调MNX1-AS1可以抑制癌细胞增殖、迁移和侵袭[2]。据报道miR-218-5p可能是MNX1-AS1的下游miRNA之一,参与肝癌的进展[3]。MNX1-AS1也被证实参与影响肺癌的进展和预后[4],但其与miR-218-5p的关系以及对非小细胞肺癌(non-small cell lung cancer,NSCLC)进展的作用机制尚不明确。本研究探讨MNX1-AS1对miR-218-5p表达的影响及其作用机制,为肺癌的诊断和治疗提供参考途径。
1 材料和方法
1.1 细胞培养
非小细胞肺癌细胞系HCC827、H1299、A549及人正常肺上皮细胞系Beas-2B购自中国科学院上海细胞库。细胞均在含有10%胎牛血清(Life Technologies,USA)、100 U/mL青霉素和100 g/L链霉素(Gibco,NY,USA)的RPMI-1640(Thermo Fisher Scientific,USA)培养基中,置于37 ℃ 5%CO2的潮湿培养箱中培养,待细胞融合至80%进行传代。
1.2 细胞转染及分组
MNX1-AS1-shRNA、MNX1-AS1-shRNA阴性对照(shRNA-NC)、miR-218-5p模拟物、miR-218-5p抑制剂、miR-218-5p阴性对照(miR-NC)均购自广州锐博生物有限公司。取对数期生长的A549细胞,分为4组:空白对照组、shRNA-NC组、MNX1-AS1-shRNA组、MNX1-AS1-shRNA+miR-218-5p抑制剂组。将各组A549细胞以每孔2×105个接种于6孔板中,待细胞融合至70%左右,按照上述分组,采用LipofectamineTM2000分别或同时转染MNX1-AS1-shRNA、shRNA-NC及miR-218-5p抑制剂,严格按照试剂说明书进行操作。转染12 h更换为新鲜的完全培养基,培养24 h后,提取细胞RNA。
1.3 qRT-PCR
采用Trizol试剂(Invitrogen)提取细胞总RNA,采用cDNA试剂盒(Invitrogen)将RNA反转录为互补DNA(complementary DNA,cDNA)。采用SYBR Green Master Mix试剂盒,以cDNA为模板,检测MNX1-AS1和miR-218-5p的表达。MNX1-AS1正向引物:5′-CCCGCATTTTCAGATTCAC-3′,反向引物:5′-GCTCTCAGCCTCGCCATA-3′;miR-218-5p正向引物:5′-CGAGTGCATTTGTGCTTGATCTA-3′,反向引物:5′-TAATGGTCGAACGCCTAACGTC-3′;GAPDH正向引物:5′-GTCAACGGATTTGGTCTGTATT-3′,反向引物:5′-AGTCTTCTGGGTGGCAGTGAT-3′;U6正向引物:5′-GCTTCGGCAGCACATATACTAAAAT-3′,反向引物:5′-CGCTTCACGAATTTGCGTGTCAT-3′。反应条件为:95 ℃ 10 min,95 ℃15 s,72 ℃ 15 s,共40个循环。以甘油醛-3-磷酸脱氢酶(GAPDH)和U6为内参,采用2-ΔΔCt计算MNX1-AS1和miR-218-5p的相对表达量。
1.4 双荧光素酶报告基因检测
采用双荧光素酶报告基因检测分析MNX1-AS1与miR-218-5p之间的关系。分别扩增含有miR-218-5p结合位点的MNX1-AS1 3′端非编码区野生型和突变型序列,插入荧光素酶报告基因质粒PsiCHECK2(Promega)构建MNX1-AS1 WT和MNX1-AS1 MUT双荧光素酶载体,与miR-218-5p模拟物、miR-NC共转染至A549细胞中。转染48 h后,检测荧光素酶的相对活性,实验重复3次。
1.5 RNA pull-down实验
按照RNA pull down试剂盒(Thermo Fisher Scientific,USA)说明书操作。提取A549细胞总RNA。按照试剂盒要求预处理磁珠,并将miR-218-5p模拟物及miR-NC用生物素(Biotin)进行标记,分别为Biotin-miR-218-5p及Biotin-NC;将Biotin-miR-218-5p及Biotin-NC分别与链霉亲和素磁珠孵育,使其结合;将其加入总RNA中,室温轻轻混匀,孵育30 min;而后加入洗脱缓冲液,收集磁珠拉下的RNA复合物。qRT-PCR对RNA复合物中的MNX1-AS1的水平进行定量分析。
1.6 MTT检测
取转染48 h后的各组细胞,以1×104个/孔接种至96孔板,每组设置5个复孔。分别再培养24、48、72、96 h时,每孔加入10 μL MTT溶液(5 g/L),孵育4 h。弃MTT后,加入150 μL二甲基亚砜振荡5 min充分溶解。于酶标仪(Thermo,USA)570 nm波长处检测各孔的光密度(optical density,OD)值,以时间点为横坐标,OD值为纵坐标,绘制细胞增殖曲线。
1.7 流式细胞术检测
取转染48 h后的各组细胞,消化、缓冲液重悬后,加入5 μL Annexin V,避光孵育10 min,再加入10 μL碘化丙啶(prodium iodide,PI)染色,室温避光5 min,流式细胞仪检测各组细胞凋亡率。每组重复3次。
1.8 Transwell实验
将RPMI-1640培养基稀释的基质胶均匀铺于Transwell小室上室内。将转染48 h后的细胞以1×105个/mL接种至Transwell小室上室,下室加入含20%胎牛血清的RPMI-1640培养基,置于37 ℃、5%CO2的恒温细胞培养箱中培养。24 h后,取出小室,用棉签擦拭掉上室中未穿过的细胞。70%乙醇固定30 min后,用0.1%的结晶紫染色。自来水冲洗后,于倒置显微镜下观察并计数穿过上室的细胞。随机选择5个视野,取平均值。迁移实验中Transwell小室上室不采用基质胶包被,其余实验步骤同侵袭实验。
1.9 统计学处理

2 结 果
2.1 MNX1-AS1和miR-218-5p在NSCLC细胞系中的表达
与正常肺上皮细胞系Beas-2B比较,NSCLC细胞系HCC827、H1299和A549中MNX1-AS1表达水平均显著升高(P<0.05;图1A),而miR-218-5p的表达水平显著降低(P<0.05;图1B)。其中A549细胞的变化最为显著,将其用于后续实验。
转染MNX1-AS1-shRNA后A549细胞中MNX1-AS1的表达水平显著降低(图1C),而miR-218-5p水平显著升高,共转染MNX1-AS1-shRNA和miR-218-5p抑制剂后,miR-218-5p水平降低(P<0.05,图1D)。

图1 MNX1-AS1和miR-218-5p在NSCLC细胞系中的表达a为P<0.05,与Beas-2B细胞比较;b为P<0.05,与MNX1-AS1-shRNA组比较。
2.2 MNX1-AS1靶向调控miR-218-5p
生物信息学预测发现MNX1-AS1与miR-218-5p基因序列之间存在结合位点(图2A)。miR-218-5p模拟物能够显著降低MNX1-AS1-WT的荧光素酶活性,对MNX1-AS1-MUT的荧光素酶活性无明显影响(图2B)。RNA pull down实验结果显示:Biotin-miR-218-5p通过磁珠拉下的MNX1-AS1明显高于Biotin-NC,提示miR-218-5p能特异性结合MNX1-AS1(P<0.05,图2C)。
2.3 MNX1-AS1对A549细胞增殖的影响
MNX1-AS1-shRNA组细胞增殖活力显著低于空白对照组、shRNA-NC组,但显著高于MNX1-AS1-shRNA+miR-218-5p抑制剂组(P<0.05;图3)。
2.4 MNX1-AS1对A549细胞凋亡的影响
与空白对照组和shRNA-NC组比较,MNX1-AS1-shRNA组细胞凋亡率显著增高;MNX1-AS1-shRNA+miR-218-5p抑制剂组细胞的凋亡率显著低于MNX1-AS1-shRNA组(P<0.05;图4)。
2.5 Transwell实验检测转染48 h对A549细胞迁移和侵袭的影响
与空白对照组和shRNA-NC组比较,MNX1-AS1-shRNA组细胞的迁移和侵袭细胞数显著降低,而MNX1-AS1-shRNA+miR-218-5p抑制剂组细胞的迁移和侵袭细胞数均显著高于MNX1-AS1-shRNA组(P<0.05;图5)。

图2 MNX1-AS1靶向调控miR-218-5pA为生物信息学预测MNX1-AS1与miR-218-5p的结合位点;B为双荧光素酶报告基因实验验证MNX1-AS1与miR-218-5p的靶向调控;C为RNA pull down实验证实MNX1-AS1与miR-218-5p的相互作用。a为P<0.05,与miR-NC组比较;b为P<0.05,与Biotin-NC组比较。
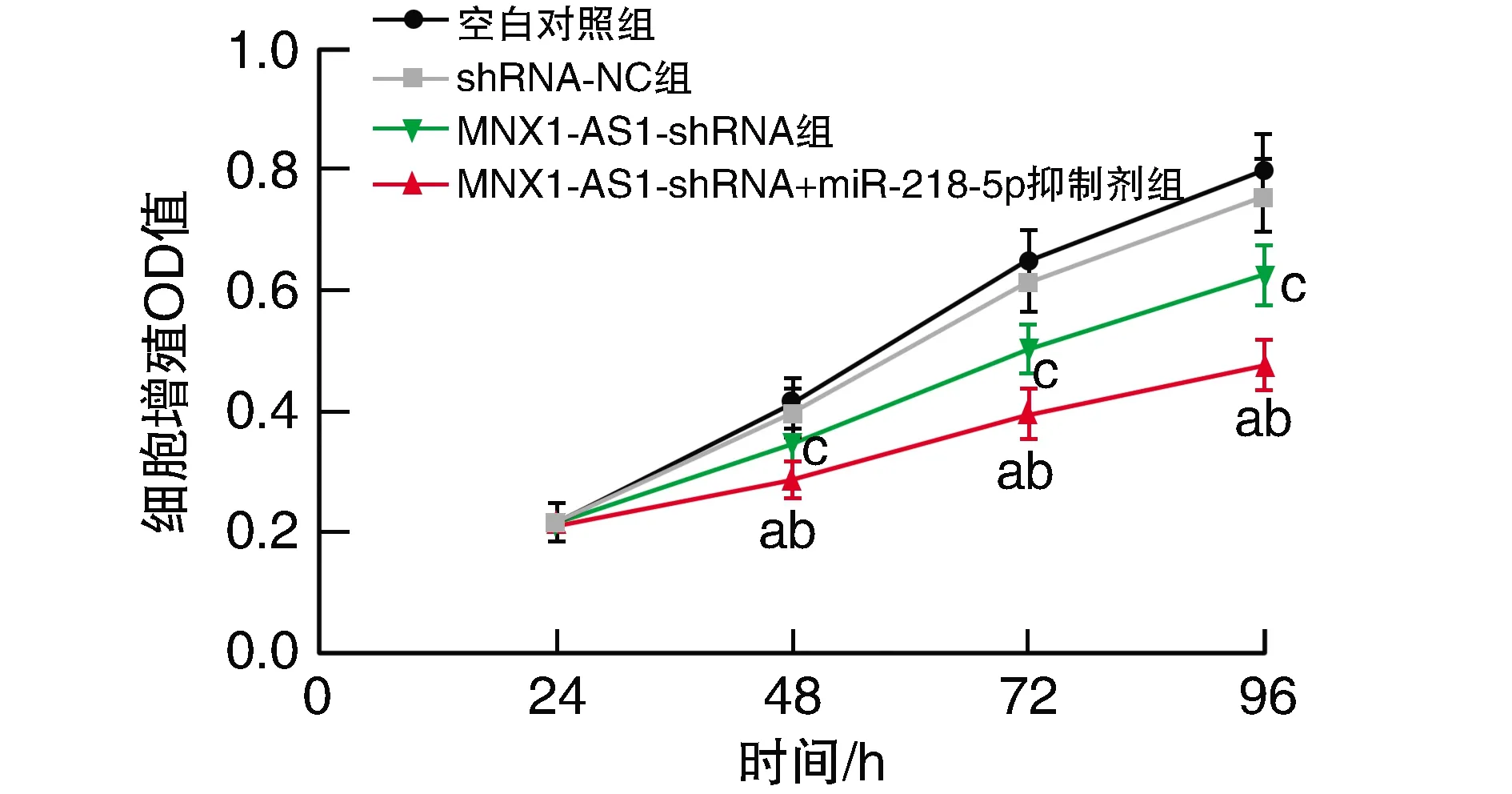
图3 MNX1-AS1对A549细胞增殖的影响a为P<0.05,与空白对照组比较;b为P<0.05,与shRNA-NC组比较;c为P<0.05,与MNX1-AS1-shRNA组比较。

图4 MNX1-AS1对A549细胞凋亡的影响
3 讨 论
肺癌的发病率和死亡率均居恶性肿瘤前列[5]。靶向治疗可有效提高患者的疗效并延长生存期,因此备受关注[6]。近几年研究发现,lncRNA具有非常重要的生物学功能,包括调控蛋白编码基因上游启动子区的转录,干扰比邻蛋白编码基因表达,作为小分子miRNA等的前体分子等[7-8]。lncRNA可调控癌细胞的生长、分化和新陈代谢等过程,扮演着抑癌和癌基因的角色[9]。周玫余等[10]研究发现lncRNA SFTA1P在NSCLC组织中的表达低于癌旁组织,同时在NSCLC A549细胞中低表达,过表达SFTA1P可以抑制A549细胞的增殖、侵袭、迁移。lncRNA、TUC338、MIR4435-2HG等均在肺癌中特异性高表达,并参与调控癌细胞的增殖活性、侵袭、迁移能力[11-12]。MNX1-AS1已被报道参与多种肿瘤的

图5 Transwell实验检测转染48 h对A549细胞迁移和侵袭的影响(结晶紫,200×)a为P<0.05,与空白对照组比较;b为P<0.05,与shRNA-NC组比较;c为P<0.05,与MNX1-AS1-shRNA组比较。
发生发展过程,如MNX1-AS1在宫颈癌组织及细胞中表达均上调,且与患者不良预后相关[13]。Gao等[14]研究发现,MNX1-AS1可通过抑制miR-4443促进胶质母细胞瘤细胞的增殖、迁移和侵袭。Yang等[15]研究发现,MNX1-AS1在肺腺癌中高表达,与患者的临床进展及不良预后密切相关。而Liu等[16]则指出,MNX1-AS1/miR-527/BRF2轴作为一个新的信号通路,通过调控肺癌细胞的增殖、迁移和侵袭,参与肺癌的进展。本研究结果显示,MNX1-AS1在肺癌细胞中高表达,干扰MNX1-AS1的表达能够抑制A549细胞增殖、迁移和侵袭,促进细胞凋亡。但目前关于MNX1-A1在肺癌中的作用及机制的相关研究较少,其机制尚不清楚。
miR-218-5p被报道在癌症的发生发展中发挥抑癌的作用,如在胶质瘤组织中表达下调,通过靶向调控HMGB1的表达抑制胶质瘤细胞的增殖、侵袭及迁移并诱导凋亡[17];miR-218-5p能够靶向结合EGFR抑制肺癌细胞的增殖和迁移,在肺癌的进展中发挥重要作用[18]。Zhang等[19]指出,lncRNA LINC-PINT通过靶向调控miR-218-5p/程序性细胞死亡4(PDCD4)抑制肺癌细胞的增殖、细胞周期、迁移和侵袭。上述研究提示miR-218-5p在肺癌发生发展中发挥抑癌基因的作用。MNX1-AS1能够靶向调控miR-218-5p,介导结直肠癌和膀胱癌细胞的增殖、迁移和凋亡等参与癌症的进展[20-21]。本研究采用双荧光素酶报告基因实验和RNA pull down实验证实MNX1-AS1能够靶向负调控miR-218-5p的表达,同时下调miR-218-5p能够挽救沉默MNX1-AS1所引起的细胞活性、迁移和侵袭能力的降低以及凋亡率的升高,提示MNX1-AS1靶向负调控miR-218-5p介导肺癌细胞的增殖、迁移、侵袭和凋亡,与现有其他肿瘤相关的研究结果一致。
综上,MNX1-AS1靶向调控miR-218-5p的表达影响NSCLC细胞的增殖、迁移和侵袭、凋亡等生物学特性。MNX1-AS1/miR-218-5p通路可能是肺癌诊疗的新靶标之一。但本研究尚未深入分析miR-218-5p的下游靶基因,因此关于miR-218-5p下游靶基因调控网络还需进一步探究,以便更好地分析MNX1-AS1/miR-218-5p在肺癌中的作用机制。
