微塑料对两种硅藻生长以及二甲基硫产生的影响❋
2022-06-28王雪丹席靖雅田继远来敬广杨桂朋
王雪丹, 席靖雅, 田继远, 陈 容❋❋, 于 娟,3, 来敬广, 王 苏, 杨桂朋,3
(1. 中国海洋大学化学化工学院, 海洋化学理论与工程技术教育部重点实验室, 山东 青岛 266100; 2. 中国海洋大学 深海圈层与地球系统前沿科学中心, 山东 青岛 266100;3. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237; 4. 青岛农业大学食品科学与工程学院, 山东 青岛 266109)
全球塑料产量从20世纪50年代的200万t增加到2019年的3.68亿t,预计产量会逐年增加[1],约有5%~10%的废弃塑料会经过各种途径排放到海洋中,塑料垃圾引起的海洋污染问题是近十年来备受关注的热点问题[2-4]。微塑料(粒径 < 5 mm)是分布广泛且降解缓慢的一种新型污染物,来源于化妆品和塑料工业生产的塑料颗粒(初级微塑料)[5-6]或较大塑料在环境条件下的破碎(次级微塑料)[7]。微塑料会直接影响浮游植物的生长、光合作用,改变其群落结构[8]。此外,微塑料与浮游植物之间的相互作用会干扰浮游动物的摄食,进而对更高营养级的滤食性生物产生潜在的威胁[8]。目前已在鲸类[9-10]、龟类[11]、鱼类[12-14]、虾贝类[15-16]以及深海生物[17-18]体内发现塑料颗粒的存在,甚至在人体胎盘[19]和血液[20]中也发现了塑料颗粒。除此之外,微塑料的比表面积大、具有较强的吸附性,可以富集水环境中的重金属、持久性有机污染物等有毒物质,进而对海洋生物造成不可逆的化学伤害[21]。
生源可挥发气体二甲基硫是参与硫生物地球化学循环的重要物质,DMS对全球温室效应具有负反馈作用[22]。DMS的前体物质-二甲基巯基丙酸内盐通过DMSP裂解酶1:1裂解产生DMS和丙烯酸盐[23]。海洋微藻是DMSP的主要生产者[24],微塑料对微藻的潜在危害可能会对全球生源硫循环产生间接影响。微藻作为海洋初级生产者,是检测微塑料对海洋环境毒害作用的最佳选择[25]。微塑料对微藻的生长、光合作用的负面影响已有相关报道[25]。微塑料粒径越小、表面电荷越正、增塑剂含量越高、浓度越高对海洋微藻的损伤越大[26-28]。目前,微塑料对微藻产生海洋活性气体-挥发性卤代烃的影响已有报道[29],对DMS的研究报道较少[30]。Yu等[30]指出,微塑料抑制海洋微藻的生长,进而降低微藻DMS和DMSP的产生。
硅藻作为黄东海优势藻,是产DMSP的主要海洋微藻[31]。本论文选用旋链角毛藻暴露在不同浓度的聚苯乙烯(Polystyrene,PS)微塑料下,以及中肋骨条藻暴露在不同浓度的聚乙烯(Polyethylene,PE)微塑料下,研究微藻的生长、光合色素含量以及DMS、DMSP产量的变化,可以为探究不同类型和粒径的微塑料对浮游植物释放甲基硫化物的影响以及全球生源硫循环的变化提供参考。
1 材料与方法
1.1 海洋微藻
本文选用两种硅藻-旋链角毛藻(Chaetoceroscurvisetus)和中肋骨条藻(Skeletonemacostatum)作为研究对象,藻种由中国海洋大学化学化工学院海洋界面化学实验室提供。实验海水取自东海,经0.45 μm醋酸纤维滤膜过滤,121 ℃高压灭菌20 min后使用。在温度为(20±1)℃、光照强度为4 000 Lux、光周期为12 L∶12 D的条件下,f/2培养基培养至指数生长期后待用[32]。
1.2 微塑料
80 nm PS微塑料(2.5%,w/v),购自天津赛尔群科技有限责任公司。将PS微塑料用灭菌的milli-Q水逐级稀释至1.5、15、150、1 500 mg·L-1四种浓度的储备液备用。PE微塑料购自Sigma公司,粒径范围为10~30 μm(平均粒径:20 μm)。使用前用超声波破碎仪(JY 92-IIN,宁波新芝生物科技)400 W下超声20 min,保证微塑料均匀分散在f/2培养基中。
1.3 旋链角毛藻16 d培养实验
PS微塑料设置5个浓度梯度,分别为0、0.05、0.5、5、50 mg·L-1。以初始浓度约为10×104cells·mL-1将指数生长期的旋链角毛藻接入300 mL含有上述 5种浓度PS微塑料的f/2培养基中。玻璃无菌瓶密封培养16 d。实验设置3个平行,避免顶空。每天按时摇匀,使用无菌注射器每2天在上午9:00取样,分别测定细胞密度、叶绿素a(Chlorophylla,Chla)、叶绿素c(Chlorophyllc,Chlc)、类胡萝卜素(Carotenoid,Car)、DMS和DMSP的浓度。
1.4 中肋骨条藻96 h暴露实验
PE微塑料设置5种 ,分别为0、12.5、25、50和100 mg·L-1。以初始浓度约为50×104cells·mL-1将指数生长期的中肋骨条藻接入150 mL含有上述 5种浓度PE微塑料的f/2培养基中,实验设置2个平行,每天按时摇匀,玻璃无菌瓶密封培养。分别在24、48、72和96 h取样,并测定细胞密度、Chla、Chlc、Car、DMS和DMSP的浓度。
1.5 细胞密度、生长抑制率、比生长率和半数有效浓度EC50
用血球计数板在光学显微镜(CX31RTSF,Olympus)下测定微藻细胞密度。生长抑制率(IR)按照公式:IR= (1-T/C)×100% 计算,其中,T和C分别指实验组和对照组的细胞浓度。比生长率(μ)按以下公式计算:μ=(lnCn- lnC0)/(Tn-T0),式中Cn和C0分别代表第n天和第0天的细胞密度,Tn和T0分别代表培养第n天和第0天。用概率单位法得到微藻的半数有效浓度EC50。
1.6 Chl a、Chl c和Car浓度的测定
取10 mL藻液过滤至0.7 μm Whatman GF/F滤膜上,用90%丙酮4 ℃ 避光冷藏24 h萃取。将提取液在4 000 r·min-1下离心10 min,取上清液用紫外可见分光光度计(UV-2550,日本岛津)分别测定480、510、632、652、665和750 nm波长下的吸光度,Chla浓度采用Porra[33]的方法计算,Chlc浓度采用Ritchie[34]的方法计算,Car浓度采用Strickland和Parsons[35]的方法计算,计算公式如下:
Chla= 16.92 × (A665nm-A750nm) - 8.54 × (A652nm-A750nm)。
Chlc= - 6.01 × (A665nm-A750nm) + 28.82 × (A632nm-A750nm)。
Car = 7.6 × (A480nm-A750nm) - 1.49 × (A510nm-A750nm)。
1.7 DMS和DMSP浓度的测定
DMS参照杨桂朋等[36]吹扫捕集-冷阱富集前处理技术进行测定。用乙醇配置一系列已知浓度的DMS标准溶液,根据浓度和峰面积的对应关系绘制标准曲线,DMS浓度由标准曲线计算得到[37]。最小检出限为0.15 ng S,标准偏差<5%。
DMSP在强碱(pH ≥ 13)条件下碱解产生DMS,向2 mL藻液中加入200 μL 10 mol·L-1KOH溶液,4 ℃冷藏24 h,DMSP以1∶1比例碱解为DMS,由测定的DMS浓度间接获得DMSP浓度[36]。
1.8 荧光标记微塑料对微藻细胞的影响
为探究微塑料对微藻的作用机理,将指数生长期的旋链角毛藻暴露于0、0.05、0.5、5、50 mg·L-1的80 nm PS荧光微塑料(购自天津赛尔群科技有限责任公司),培养7 d后用荧光显微镜(RVL-100-G,ECHO)观察并拍照,激发和发射波长分别为488和530 nm。
1.9 数据处理
实验数据采用平均值±标准偏差,用数据分析软件Excel处理数据,用origin 2018作图,用SPSS 25.0分析软件对数据进行单因素方差分析。
2 结果
2.1 PS微塑料对旋链角毛藻的影响
2.1.1 细胞密度、比生长率和生长抑制率 0和0.05 mg·L-1PS微塑料暴露下旋链角毛藻在2~6 d处于指数生长期,在第6天细胞密度达到峰值,随后缓慢降低;0.5和5 mg·L-1PS微塑料下旋链角毛藻在2~4 d处于指数生长期,在第4天细胞密度达到峰值,随后缓慢降低;PS浓度为50 mg·L-1时,细胞密度显著低于0、0.05、0.5和5 mg·L-1PS微塑料的细胞密度(P<0.01)(见图1(A))。50 mg·L-1PS微塑料暴露的旋链角毛藻的生长抑制率随培养时间的延长而逐渐增大,暴露2~16 d的生长抑制率变化范围为41.4%~93.2%(见图1(C))。0、0.05、0.5和5 mg·L-1PS微塑料下,旋链角毛藻的比生长率和生长抑制率两两之间均无显著性差异(P> 0.05)。50 mg·L-1PS微塑料暴露下,旋链角毛藻的比生长率和生长抑制率显著低于0、0.05、0.5和5 mg·L-1PS微塑料的比生长率和生长抑制率(P< 0.01)(见图1(B)、(C))。

图1 不同浓度聚苯乙烯微塑料暴露下的旋链角毛藻细胞 密度(A)、比生长率(B)和生长抑制率(C)的变化
2.1.2 单细胞Chla、Chlc和Car浓度 0、0.05、0.5和5 mg·L-1PS微塑料暴露下,旋链角毛藻的单细胞Chla、Chlc和Car浓度均迅速下降达到最低值后趋于平稳(见图2)。与对照组相比,0.05、0.5和5 mg·L-1PS微塑料暴露下的单细胞Chla、Chlc和Car浓度均无显著性差异(P>0.05)。50 mg·L-1PS微塑料暴露下,单细胞Chla、Chlc和Car浓度在第4 天开始逐渐升高,在第12 天达到高值后稍微降低(见图2)。50 mg·L-1PS微塑料暴露下10~16 d的单细胞Chla、Chlc和Car浓度显著高于0、0.05、0.5和5 mg·L-1PS微塑料的相应光合色素浓度(P< 0.05)(见图2)。
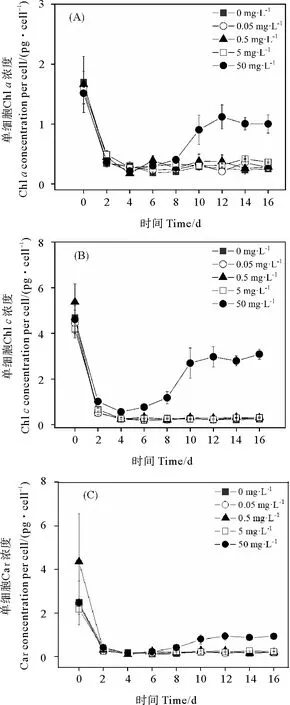
图2 不同浓度聚苯乙烯微塑料暴露下的旋链角毛藻单细胞 Chl a (A)、Chl c (B)和Car (C)的浓度变化
2.1.3 单细胞DMS浓度 0、0.05、0.5和5 mg·L-1PS微塑料暴露下,旋链角毛藻的单细胞DMS浓度在0~4 d逐渐降低,4~16 d下降达到最低值后趋于平稳(见图3)。0、0.05、0.5和5 mg·L-1PS微塑料暴露下的单细胞DMS浓度两两之间无显著性差异(P> 0.05)。50 mg·L-1PS微塑料暴露下的旋链角毛藻单细胞DMS浓度在0~6 d快速降低,6~12 d逐渐升高至4.9×10-2fmol·cell-1,随后降低(见图3)。50 mg·L-1PS微塑料暴露下旋链角毛藻的单细胞DMS浓度显著高于0、0.05、0.5和5 mg·L-1PS微塑料的单细胞DMS浓度(P< 0.05)(见图3)。
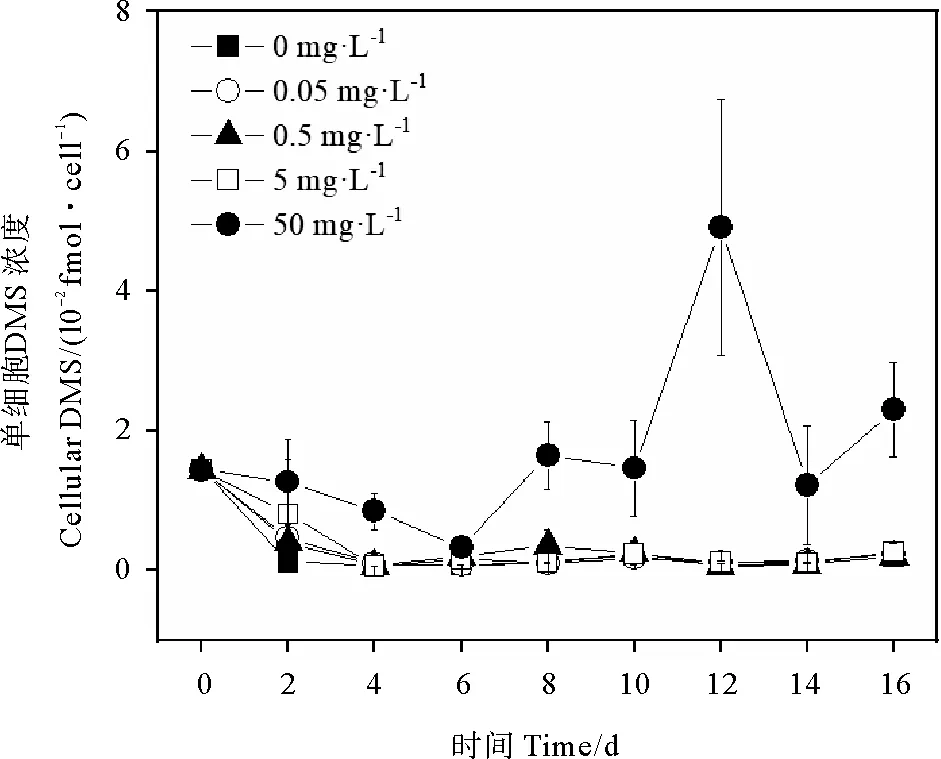
图3 不同浓度聚苯乙烯微塑料暴露下的 旋链角毛藻单细胞DMS的浓度变化
2.1.4 荧光PS微塑料对旋链角毛藻影响的观察 与对照组(见图4A)相比,0.05、0.5、 5和50 mg·L-1PS微塑料暴露下的细胞内有微弱的荧光(见图4B-4I)。0.5、5和50 mg·L-1PS微塑料暴露下,藻细胞脱落的角毛附着大量的荧光PS微塑料(见图4C、4D、4E和4I)。
2.2 PE微塑料对中肋骨条藻的影响
2.2.1 细胞密度和生长抑制率 0、12.5、25、50和100 mg·L-1PE微塑料暴露的中肋骨条藻细胞密度在96 h内随培养时间延长而增大(见图5(A))。12.5和25 mg·L-1PE微塑料暴露48 h的细胞密度显著高于100 mg·L-1PE微塑料浓度(P<0.05)。12.5 mg·L-1PE微塑料暴露48 h的细胞密度显著高于25 mg·L-1的细胞密度(P>0.05)(见图5(A))。50和100 mg·L-1PE微塑料暴露48 h对中肋骨条藻的生长抑制率最大,分别为36.1%和40.0%(见图5(B))。PE微塑料对中肋骨条藻生长的24和96 h·EC50分别为632、378 mg·L-1(见表1)。

表1 不同浓度聚乙烯微塑料暴露96 h,中肋骨条 藻细胞密度的半数有效浓度EC50
2.2.2 单细胞Chla、Chlc和Car浓度 0、12.5、25和50 mg·L-1PE微塑料暴露96 h的中肋骨条藻单细胞Chla、Chlc和Car浓度两两之间无显著性差异(P> 0.05)(见图6)。100 mg·L-1PE微塑料暴露96 h的中肋骨条藻单细胞Chla、Chlc和Car浓度随时间延长先升高,在48 h时达到峰值,随后降低(见图6)。100 mg·L-1PE微塑料暴露48 h的中肋骨条藻单细胞Chla、Chlc和Car浓度显著高于0、12.5、25和50 mg·L-1PE微塑料的单细胞Chla、Chlc和Car浓度(P< 0.05)(见图6)。
2.2.3 单细胞DMS 和DMSP浓度 0、12.5、25、50和100 mg·L-1PE微塑料暴露96 h的中肋骨条藻单细胞DMS浓度两两之间无显著性差异(P> 0.05)(见图7(A))。100 mg·L-1PE微塑料暴露48 h时的单细胞DMS浓度显著高于对照组(P< 0.05)(见图7(A))。12.5、25和50 mg·L-1PE微塑料暴露的单细胞DMSP浓度呈现先增加后降低的变化趋势(见图7(B))。0、12.5、25、50和100 mg·L-1PE微塑料暴露96 h的中肋骨条藻单细胞DMSP浓度两两之间无显著性差异(P> 0.05)(见图7(B))。
3 讨论
3.1 微塑料对海洋微藻生长的影响
微塑料对海洋微藻的生长抑制作用与微藻的种类[38]和生长阶段[39]、微塑料的类型[40]和粒径[41]以及微塑料添加剂[42]有关。我们的结果显示,PS微塑料浓度≤5 mg·L-1时,对旋链角毛藻的生长无明显抑制作用;50 mg·L-1PS微塑料明显抑制旋链角毛藻的生长。Mao等[39]和Prata等[43]的研究结果与我们的旋链角毛藻的结果相近。Mao等[39]研究表明,0.1和1 μm的PS微塑料浓度≥50 mg·L-1明显抑制滞后期和指数生长初期小球藻的生长和光合作用。Prata等[43]研究发现,41.5 mg·L-1的1~5 μm的微塑料聚合物对朱氏四爿藻生长无显著性影响。结果发现,浓度<50 mg·L-1的PE微塑料暴露24~48 h,会刺激中肋骨条藻细胞密度升高。Canniff等[44]研究结果表明130 mg·L-1的63~75 μm PE微塑料暴露5 d的近头状尖胞藻(Raphidocelissubcapitata)细胞密度明显高于对照组。Wu等[45]研究表明5 mg·L-1的1 μm PS微塑料暴露96 h时,能够显著促进铜绿微囊藻的生长。低浓度微塑料促进微藻生长的原因可能与微塑料和微藻的团聚作用有关[44]。与本文结果相近,Zhao等[46]研究表明,100 mg·L-1的1 μm PVC微塑料暴露48 h的米氏凯伦藻(Kareniamikimotoi)的生长抑制率为45.8%,生长抑制率随时间延长而减小。结果显示,微塑料暴露使微藻的生长抑制率随时间延长先升高后降低,与Ansari等[47]的结果吻合。
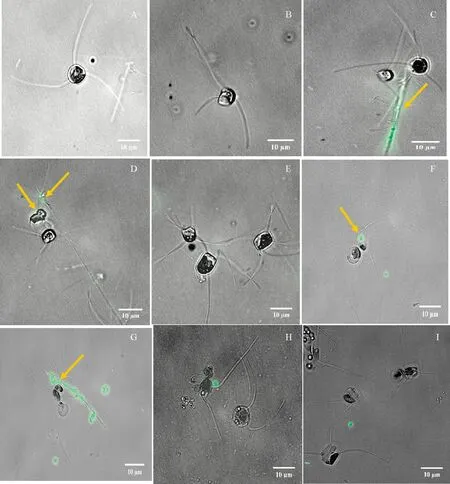
图4 0 mg·L-1 (A)、0.05 mg·L-1 (B)、0.5 mg·L-1 (C)、5 mg·L-1 (D、E)和50 mg·L-1 (F、G、H和I) 荧光聚苯乙烯微塑料暴露7 d时旋链角毛藻的荧光显微照片

图5 不同浓度聚乙烯微塑料暴露96 h的中肋骨条藻细胞密度(A)和生长抑制率(B)的变化

图6 不同浓度聚乙烯微塑料暴露下的中肋骨条藻单细胞 Chl a (A)、Chl c (B)和Car (C)的浓度变化

图7 不同浓度聚乙烯微塑料暴露96 h的中肋骨条 藻单细胞DMS(A)和单细胞DMSP(B)的浓度变化
利用不同PE微塑料浓度的生长抑制率估算了PE微塑料不同暴露时间下中肋骨条藻生长的EC50。24和96 h·EC50分别为632 mg·L-1(1.6×108个/L)、387 mg·L-1(9.6×107个/L)。PS微塑料对旋链角毛藻的生长抑制影响未采用对数浓度,所以我们根据PS微塑料对旋链角毛藻暴露96 h的生长抑制率数据,估算得到96 h·EC50为41 mg·L-1。因此,与PE微塑料对中肋骨条藻相比,PS微塑料对旋链角毛藻生长的影响更大。Bergami等[48]研究表明0.07 μm PS-NH2(氨基改性的PS)微塑料暴露14 d下特氏杜氏藻(Dunaliellatertiolecta)的EC50为12.97 mg·L-1。与本实验结果相差较大,可能原因与暴露时间、微塑料的类型和粒径有关。Song等[49]在韩国金海湾检测出粒径≥20 μm的微塑料浓度为88个/L。本研究所用的微塑料浓度远高于现场环境的浓度,仅做了96 h的EC50,因此在将结果推到现实环境时还需考虑浓度和暴露时间的影响。
Navarro等[50]认为细胞壁中的纳米尺度孔是细胞内化(cellular internalization)的途径。微塑料可能会透过微藻细胞的细胞壁和细胞膜进入细胞内。Yan等[51]发现85 nm PS微塑料通过胞吞作用(Endocytosis)进入莱茵衣藻细胞,而140 nm PS微塑料被莱茵衣藻排斥在细胞外。因此进入细胞内的微塑料数量与微塑料浓度和粒径有关[52],进入细胞内的微塑料可能对细胞内的细胞器和细胞质进一步产生影响。
3.2 微塑料对海洋微藻光合色素浓度的影响
低浓度PS微塑料(≤5 mg·L-1)对旋链角毛藻单细胞Chla、Chlc和Car浓度无明显影响。50 mg·L-1PS微塑料暴露的旋链角毛藻单细胞Chla、Chlc和Car浓度显著高于0、0.05、0.5和5 mg·L-1PS微塑料,其原因是细胞密度减小。微塑料浓度≤50 mg·L-1的1 μm PE 96 h暴露下中肋骨条藻的单细胞Chla、Chlc和Car浓度无明显变化。Yang等[53]研究表明,10 mg·L-1的80 nm PS微塑料影响蛋白核小球藻的氨基酰-tRNA合成酶的基因表达,抑制细胞生长;50 mg·L-1PS微塑料引起微藻细胞DNA损伤,增加细胞凋亡,并证实高浓度微塑料会抑制微藻细胞的光合作用。与此不同,Zhang等[54]研究表明50 mg·L-1的1 mm PVC微塑料对中肋骨条藻的生长和光合作用无明显影响。因此,微藻的生长和光合作用与微塑料的类型、浓度和粒径有关。
3.3 微塑料对海洋微藻DMS和DMSP产生的影响
目前关于微塑料对微藻DMSP和DMS的影响研究较少。结果显示,50 mg·L-1PS微塑料下的单细胞DMS浓度显著高于0、0.05、0.5和5 mg·L-1PS微塑料,其原因可能与50 mg·L-1PS微塑料显著降低细胞密度有关。与对照组相比,12.5、25、50和100 mg·L-1PE 微塑料暴露96 h的中肋骨条藻的单细胞DMS和DMSP浓度均无显著性差异。陈晓华等[55]认为微塑料通过团聚作用、物理吸附等对生物体造成可逆的物理损伤;自然环境下微塑料释放增塑剂和添加剂以及富集海水中的污染物,从而对海洋微藻造成不可逆的化学损伤;纳米级微塑料可以透过膜蛋白或者胞吞作用进入细胞体内,直接抑制微藻细胞的生长和色素含量。微塑料进一步对微藻DMS和DMSP的产量可能会产生间接影响。Huang等[56]发现裸甲藻暴露于0.1 nm、1 μm和100 μm的微塑料时,活性氧含量增加,对微藻细胞膜造成损伤。Sunda等[57]研究发现,DMSP可以作为羟基自由基的有效细胞清除剂,DMS和丙烯酸盐也可以构成抗氧化系统以清除自由基。微塑料对微藻产生DMSP和释放DMS影响的作用机制尚不明确,今后将进一步研究微塑料对微藻的抗氧化系统的影响及其分子作用机制。
4 结论
(1) 微塑料对微藻的生长抑制作用与微塑料类型、粒径、浓度、暴露时间有关。与0、0.05、0.5和5 mg·L-1PS微塑料相比,50 mg·L-1的80 nm PS微塑料显著抑制微藻生长。50和100 mg·L-1PE微塑料暴露48 h对中肋骨条藻的生长抑制率达到最大,分别为36.1%和40.0%。随培养时间的延长,高浓度PE微塑料对中肋骨条藻的抑制作用减弱。
(2) 高浓度PS和PE微塑料暴露下旋链角毛藻和中肋骨条藻的单细胞Chla、Chlc和Car浓度显著高于其他低浓度组。
(3) 与0、0.05、0.5和5 mg·L-1PS微塑料相比,50 mg·L-1PS暴露下的旋链角毛藻的单细胞DMS浓度显著升高。
