珍珠芦荟组织培养技术
2022-06-28方捷生林艺辉林秀芳马馨怡陈汉鑫
方捷生,林艺辉,林秀芳,马馨怡,陈汉鑫
(漳州市农业科学研究所,福建 漳州 363005)
珍珠芦荟(Aristaloearistata)也称为木锉芦荟,属于芦荟的小型种,叶多而短,株型紧凑,是百合科芦荟属多年生常绿肉质草本植物,原产于非洲东南等热带地区[1-2]。长期以来,芦荟的食用、观赏、药用等多种价值都为人们所重视,特别是在第二次世界大战之后,芦荟就作为一种药用植物被大面积种植。目前,世界上芦荟主要生产大国有美国、日本、韩国,现已达到生产规模化、集约化、系列化的水平[3-5]。近年来,我国也逐渐开始重视并支持芦荟相关产业的发展,市面上已有许多芦荟产品相继问世:芦荟化妆品、芦荟牙膏、芦荟酒、芦荟胶囊等[4]。珍珠芦荟叶片中含有芦荟大黄素、芦荟宁、多聚糖、氨基酸、活性酶等多种有效成分,是美容佳品,对口疮、口腔炎、口腔溃疡治疗也有一定疗效,具有消炎、抗菌、抗癌、镇痛、利尿、健胃等药理作用,同时又具有保健、食用和观赏等多种功能[6-8],芦荟虽能开花,但因雄花和雌花开花时间有差异,无法自花授粉结实,不易产生种子,因而用种子繁殖十分困难。目前珍珠芦荟的主要繁殖方法有分株和叶插,但繁殖速度较慢,无法满足珍珠芦荟资源对种苗的要求以及其种植业的发展[1,9-10]。因此,本文利用组织培养技术对珍珠芦荟的快速繁殖技术进行研究,以期建立成本低、效益高的珍珠芦荟组织培养技术体系,在短时间内繁殖大量规格一致、种性稳定的种苗,为珍珠芦荟规模化生产提供参考。
1 材料与方法
1.1 材料
本研究于2020年在漳州市农业科学研究所内以健壮的珍珠芦荟幼年植株作为材料进行离体培养。
1.2 方法
试验所用的培养基均加入卡拉胶8.0 g·L-1,pH 6.0。培养温度(25±3) ℃,光照12 h·d-1,光照强度2500 xl。
1.2.1 消毒处理 珍珠芦荟幼年植株脱土前于阴凉处晾10 d左右,期间避免浇水,降低植株内生菌,从而降低污染率。剥掉植株外层干枯叶片,切除根部,用自来水冲洗干净。在超净工作台上,用75%酒精浸泡15~30 s,放入0.1%升汞溶液中消毒8 min,最后用无菌水冲洗4~6次,用无菌滤纸滤干水分。用解剖刀切取茎尖生长点即为外植体。
1.2.2 诱导培养 将消毒好的珍珠芦荟茎尖生长点接入诱导培养基。为防止交叉感染,每瓶接种1个。诱导培养基以MS+NAA 0.3 mg·L-1+蔗糖30 g·L-1为基础,加入不同质量浓度的6-BA(0、1.0、2.0、3.0、4.0、5.0 mg·L-1,表1),研究不同浓度的6-BA对珍珠芦荟茎尖生长点的影响。每次接种40个材料,3次重复。培养35 d后观察其诱导率,诱导率=新生长的侧芽/未感染的叶片以及茎尖×100%。
1.2.3 增殖培养 将诱导出的侧芽切下来,接入增殖培养基中。选用L9(34)正交设计(表2),以MS(A)、6-BA(B)、NAA(C)、蔗糖(D)为试验因子,各因子设3个水平(MS:1/3 MS、2/3 MS、MS,6-BA:1.0、3.0、5.0 mg·L-1,NAA:0.1、0.5、1.0 mg·L-1,蔗糖:2%、3%、4%,每次接种80个材料,重复3次。培养35 d后调查其增殖系数,增殖系数=新生长的侧芽数/接入侧芽的数量。
1.2.4 生根培养 将继代增殖得到的高度2.5 cm以上的丛生芽分离,接种至生根培养基。生根培养基以1/2 MS(大量元素减半,其它成分不变)为基本培养基,分别添加IBA 0.5、1.0、1.5 mg·L-1和NAA 0.5、1.0、1.5 mg·L-1进行双因子组合试验(表3),同时以1/2 MS基础培养基作为空白对照,每处理重复3次,每次做10瓶,每瓶接种5个侧芽。30 d后统计生根率,并观察根系生长状况。生根培养基加入蔗糖20 g·L-1,并加入活性炭10 g·L-1。

1/2 MS+IBA 0.5 mg·L-1+NAA 1.0 mg·L-1+蔗糖20 g·L-1,培养20 d 图3 珍珠芦荟生根示意图
1.2.5 不同炼苗和晾苗时间对珍珠芦荟组培苗移栽成活率的影响 将完成生根培养的组培苗(根的数量在5条以上)进行炼苗和晾苗。将生根苗放置于温室大棚内进行炼苗,时间分别为0、5、10、15、20 d;炼苗后,将组培苗上的培养基洗干净,每个炼苗处理分别置于阴凉通风处晾苗0、3、5、7 d(进行炼苗和晾苗时间双因子组合试验),然后移栽到进口草炭∶赤玉土=3∶1的栽培基质中,在(25±2) ℃条件下培养。每个处理100株,3次重复,取平均值。移栽30 d后统计不同炼苗和晾苗时间对移栽成活率的影响。
1.2.6 不同基质配比对珍珠芦荟移栽成活率的影响 将完成晾苗过程的组培苗,移栽至不同配方的栽培基质中。基质分别为:①进口草炭;②进口草炭∶珍珠岩=3∶1(V∶V,下同);③进口草炭∶赤玉土=3∶1;④进口草炭∶蛭石=3∶1。每个处理100株,3次重复,取平均值。移栽30 d后统计不同处理对组培苗移栽成活率的影响。
1.3 数据处理
应用Excel、DPS软件对试验数据进行统计,用新复极差法进行多重比较。
2 结果与分析
2.1 不同植物生长调节剂浓度对珍珠芦荟芽诱导的影响
将消毒好的珍珠芦荟外植体接入诱导培养基中(图1),培养10 d,基部胀大;培养20 d左右长出侧芽。从结果(表1)可以看出,不同6-BA浓度对珍珠芦荟芽诱导有显著影响,当6-BA在0~3.0 mg·L-1范围内,珍珠芦荟的芽诱导率随6-BA浓度的提升而升高;6-BA超过3.0 mg·L-1,容易导致侧芽变异畸形,不利于侧芽生长。
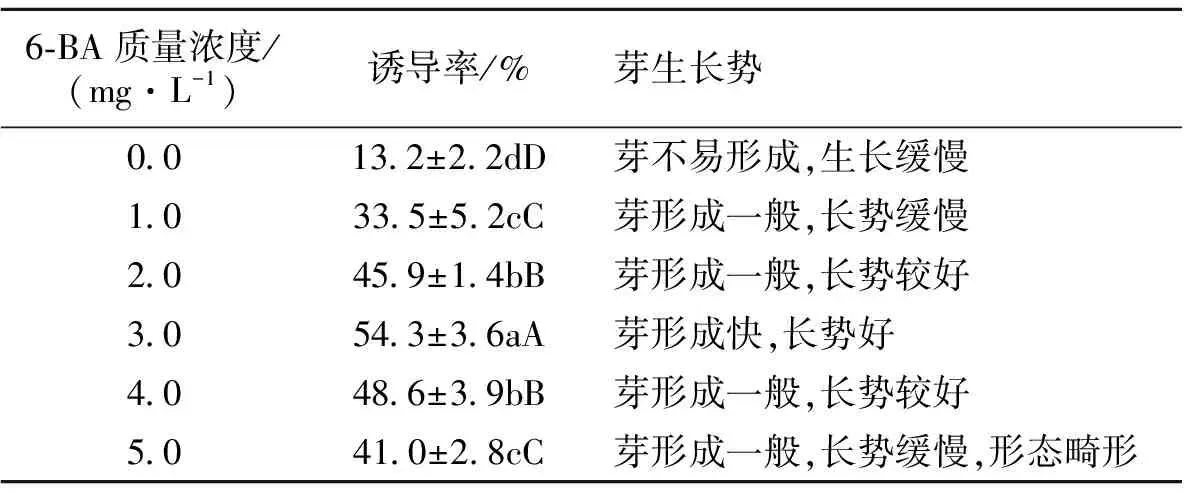
表1 不同6-BA浓度对珍珠芦荟芽诱导的影响

MS+NAA 0.3 mg·L-1+6-BA 3.0 mg·L-1+蔗糖30 g·L-1,培养30 d图1 珍珠芦荟芽诱导示意图2/3 MS+6-BA 3.0 mg·L-1+NAA 1.0 mg·L-1+蔗糖40 g·L-1,培养30 d 图2 珍珠芦荟增殖示意图
2.2 不同培养基对珍珠芦荟芽增殖的影响
将诱导出来的长度2 cm左右的侧芽,分别接种到不同的增殖培养基中,培养30 d左右观察侧芽增殖情况(图2)。由表2可知,不同处理的培养基对芦荟侧芽增殖的影响具有显著差异。对各处理进行多重比较分析可知,处理5侧芽增殖系数最高且极显著高于其它处理,其增殖系数为3.9;其次为处理4,增殖系数为3.4;而处理1增殖系数显著低于其它处理,增殖系数仅2.1。根据表2极差R值分析,试验中的4个因素对珍珠芦荟增殖的影响大小依次为MS>NAA>6-BA>蔗糖,其中以MS成分对增殖系数的影响最大。从各因素的K值获得优化的培养基配方为2/3 MS+6-BA 3.0 mg·L-1+NAA 1.0 mg·L-1+蔗糖4%;此配方组合没有在正交试验设计中,对此配方进行进一步的验证,得到的增殖系数为4.2。因此,诱导芦荟侧芽增殖的最优配方为2/3 MS+6-BA 3.0 mg·L-1+NAA 1.0 mg·L-1+蔗糖4%。

表2 不同培养基对珍珠芦荟侧芽增殖的影响
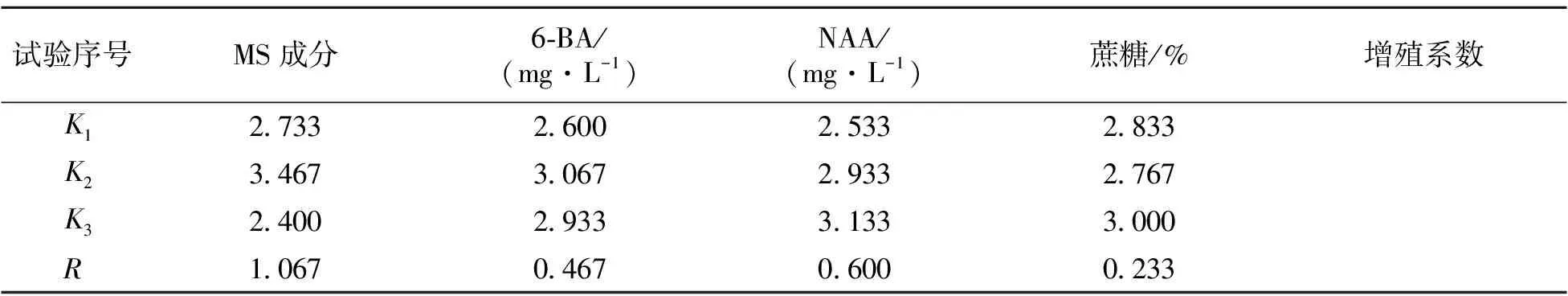
表2(续)
2.3 不同植物生长调节剂及浓度对珍珠芦荟生根的影响
以1/2 MS+蔗糖20 g·L-1为基本培养基,将增殖形成的高度2.5 cm以上的丛生芽分别接种到含不同IBA与NAA浓度配比的生根培养基中,培养20 d左右。从表3可以看出,在不同植物生长调节剂配比培养基中,珍珠芦荟的生根情况也有所不同。对其生根率进行方差分析,结果表明:与对照组相比,添加植物生长调节剂的处理对珍珠芦荟生根的影响均达到显著与极显著水平。在培养基中同时添加IBA、NAA这2种植物生长调节剂,能明显促进珍珠芦荟组培苗生根,且生根率得到明显的提高,其中以IBA 0.5 mg·L-1+NAA 1.0 mg·L-1最有利于组培苗生根,且根系较为粗壮。当IBA和NAA质量浓度均在1.5 mg·L-1及以上时,其基部会产生愈伤组织,且根的质量较差,会影响移栽成活率。因此,1/2 MS+IBA 0.5 mg·L-1+NAA 1.0 mg·L-1+蔗糖20 g·L-1是较为合适的生根培养基,其根部生长情况见图3。
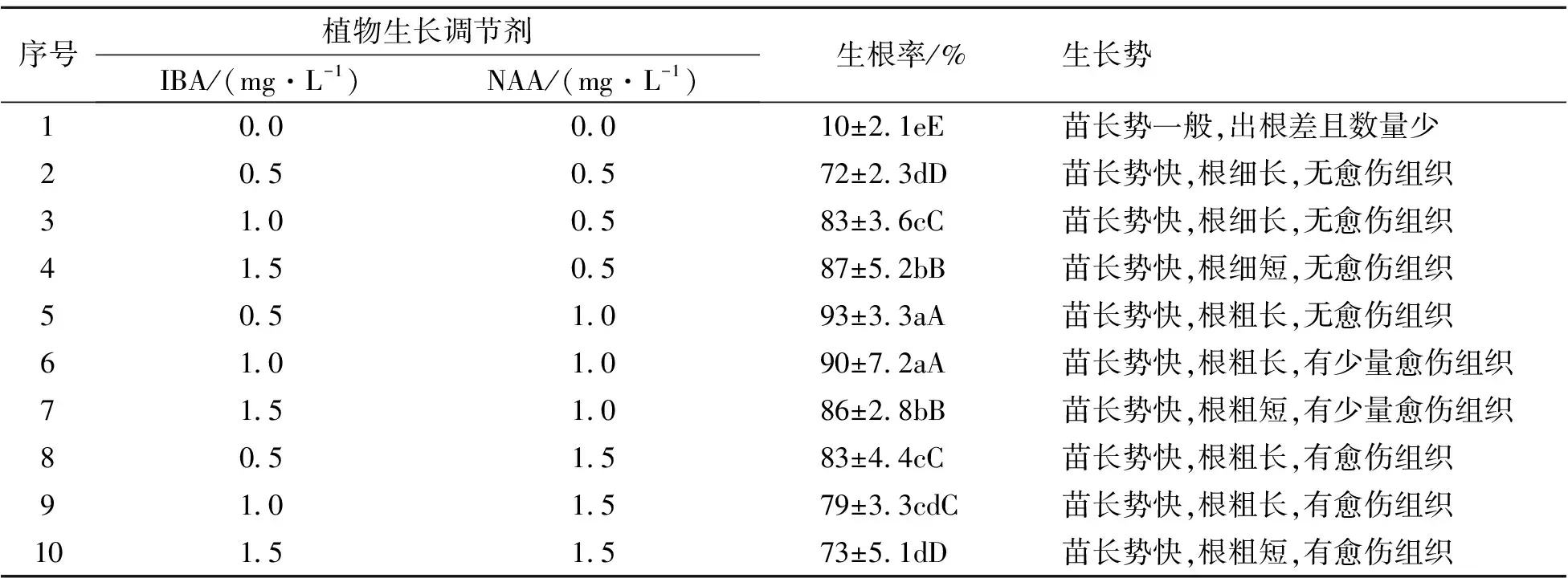
表3 不同植物生长调节剂及浓度对生根培养的影响

图4 珍珠芦荟炼苗示意图图5 珍珠芦荟晾苗示意图
2.4 不同炼苗和晾苗对珍珠芦荟移栽成活率的影响
不同炼苗和晾苗时间对珍珠芦荟移栽成活率影响较大,炼苗、晾苗见图4、图5。从表4可以看出:不进行炼苗和晾苗,直接将组培苗移栽到土培基质中,成活率很低,大部分苗腐烂或者干枯死亡。适当进行炼苗和晾苗可以显著提高其移栽成活率,当炼苗时间低于15 d,晾苗时间低于5 d时,移栽成活率相对较低,此时植株叶片含水量较高,且植株容易出现腐烂、化水;当炼苗时间高于15 d,晾苗时间高于5 d时,移栽成活率也相对较低,同时随着晾苗时间的延长,植株叶片水分蒸发过多,叶子失水皱缩,在栽培过程中不易恢复。
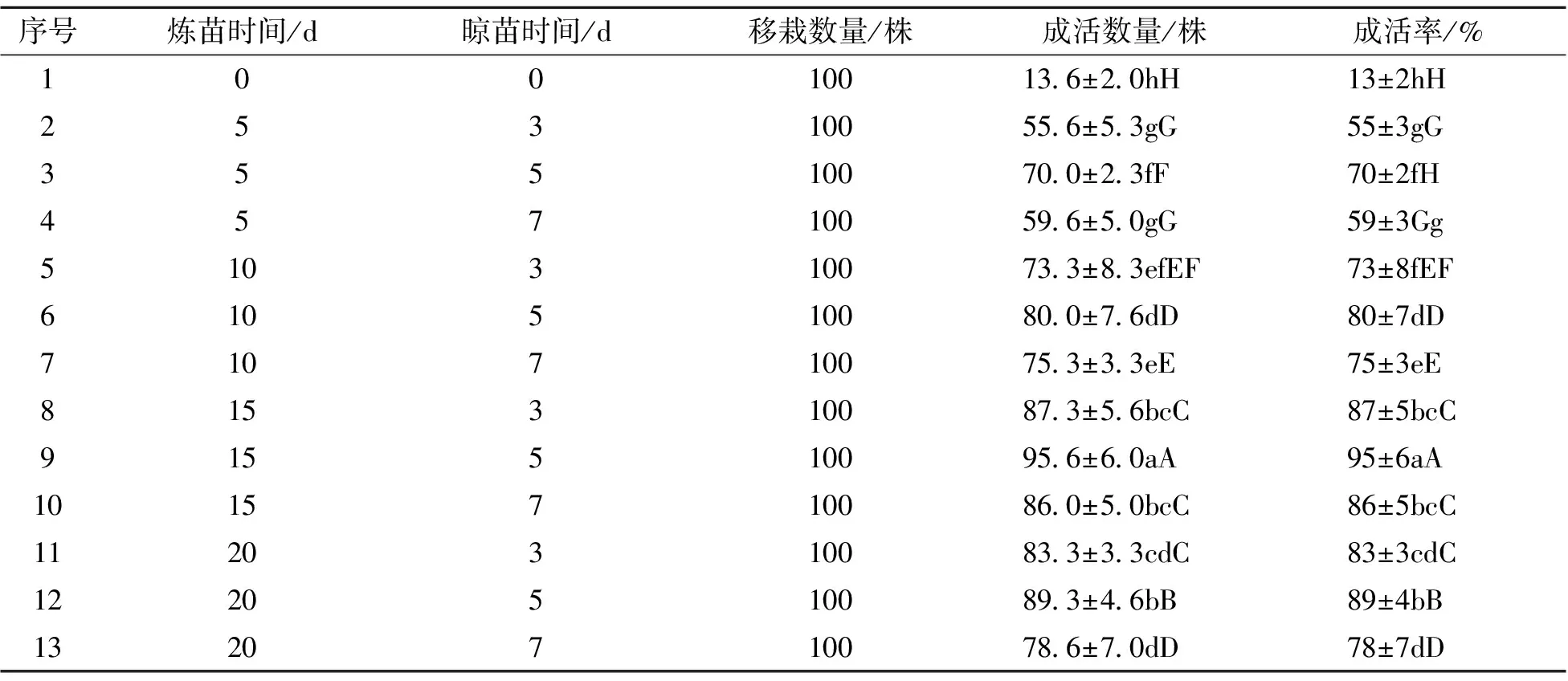
表4 不同炼苗和晾苗时间对移栽成活率的影响
2.5 不同移栽基质对珍珠芦荟组培苗移栽成活率的影响
组培苗晾苗后移栽至不同配比的栽培基质中,培养30 d后统计成活率。从表5可以看出,珍珠芦荟组培苗移栽到进口草炭∶赤玉土=3∶1基质中,成活率高达93%,明显高于其它处理;移栽至进口草炭∶珍珠岩=3∶1的基质中,组培苗成活率相对较低。由于珍珠芦荟根较粗,移栽过程中所用的草炭直径比较大,而添加的珍珠岩质地较轻,移栽时加的比例较高,在浇水过程中容易浮在上面,不利于混合;移栽至纯进口草炭的基质中,成活率最低,可能是由于纯进口草炭透气性及排水不佳,培养过程中不利于植株新根生长。因此,珍珠芦荟的移栽基质,以通气排水良好的进口草炭∶赤玉土=3∶1基质为最佳,见图6。

表5 不同移栽基质对珍珠芦荟组培苗移栽成活率的影响
3 讨论与结论

图6 珍珠芦荟基质培养示意图
珍珠芦荟采用叶插、分株等方式进行繁殖,繁殖效率低、受环境影响较大,且植株容易积累病毒。1974年,首次利用普勒多利亚芦荟种子诱导愈伤组织获得再生植株,国内外纷纷开始尝试使用组织培养的方法进行芦荟的繁殖生产[11-13]。以健壮幼年珍珠芦荟植株作为外植体,诱导率较高,且获得的植株较为健壮,有利于提高种苗质量。通过组培技术能够在较短时间内以较低成本获得大量组培苗,满足市场需求,在一定程度上缓解种苗短缺的问题。
本试验以珍珠芦荟茎尖作为材料,进行组织培养快繁技术研究,筛选出最佳的诱导、继代、生根培养基,同时探索了移栽条件对组培苗成活率的影响。在杨婷婷等[14]对芦荟愈伤组织诱导的初步研究提到,植物生长调节剂的种类及其浓度是愈伤组织诱导过程中的一个至关重要环节;不同浓度的6-BA和NAA会影响芦荟增殖,NAA的浓度会影响芦荟组培苗生根效果[15]。适当提高6-BA浓度,有助于提高珍珠芦荟诱导率,但浓度过高会降低诱导率[13],这与本试验结果相似,在本研究中,当6-BA质量浓度3.0 mg·L-1时,诱导率最高;质量浓度超过3.0 mg·L-1,容易导致侧芽变异畸形,不利于侧芽生长。增殖试验中发现MS成分对珍珠芦荟增殖系数的影响较大,不同MS成分差别主要在于大量无机盐的浓度不同,以2/3 MS为最佳,大量无机盐浓度过低或过高都不利于珍珠芦荟增殖。大多数植物生根都需要植物生长调节剂,本研究中的珍珠芦荟也不例外,在植物生长调节剂浓度较低时可以促进生长,在IBA质量浓度高于0.5 mg·L-1、NAA质量浓度高于1.0 mg·L-1会抑制生长,且长出的根系也不够粗壮。
提高移栽成活率是组织培养技术的重要环节之一,移栽前对芦荟组培苗进行炼苗,其抗性增强,成活率较高[16]。珍珠芦荟组培苗虽然有一定的光合作用能力,但在试管培养期间处在弱光、恒温、高湿、低CO2环境下生长,适应性和光合自养能力相对较差。朱峰[11]研究表明经过练苗的再生植株移栽成活率可以达到85%以上。林加根等[17]研究认为芦荟试管苗炼苗7 d后移栽成活率可达97%以上。本研究中,珍珠芦荟组培苗没有炼苗就移栽,成活率低,且栽培过程中植株恢复较慢。炼苗以温室大棚炼苗15 d左右为最佳,成活率较高,植株长势健康。与前人研究的芦荟试管苗练苗时间有所差异可能是因为品种、地域环境不同所导致。
珍珠芦荟等多肉品种,叶片较厚,肉质化程度高,叶片储水量高,移栽过程(特别是在夏天)容易出现化水腐烂现象。因此,珍珠芦荟组培苗在移栽前需要通过晾苗,利用蒸发作用降低叶片含水量,减少植株移栽过程中出现化水、落叶、植株腐烂等现象。本研究发现当芦荟试管苗晾苗时间为5 d时,植株移栽成活率最高。不同栽培基质对组培苗的成苗率、形态指标、生长量、评价指标和叶部病害发病率影响较大[18],基质的选择是组培苗移栽成活的关键,混合基质较单一基质明显有利于组培苗的成活和生长[19]。本试验选用透气性及排水较好的进口草炭、蛭石、珍珠岩以及赤玉土作为栽培基质,进口草炭∶赤玉土=3∶1的混合基质为最佳,能有效提高移栽成活率。同时移栽后的管理过程中,也需要对其培养环境进行管控,要适当控制光照强度、空气湿度,确保培养环境通风良好,以降低植株移栽过程中出现烂苗等的几率,提高其成活率。
本研究利用珍珠芦荟茎尖生长点作为外植体,建立了珍珠芦荟组织培养快速技术繁殖及生根培养和练苗移栽体系,能够快速获得大量成本较低、质量较高的珍珠芦荟种苗,可为珍珠芦荟的规模化生产提供参考。
