尾矿硫氧化微生物的分离鉴定与功能验证
2022-06-25李嘉义孙蔚旻孙晓旭孔天乐李宝琴刘振鸿高品
李嘉义,孙蔚旻,孙晓旭,孔天乐,李宝琴,刘振鸿,高品*
1.东华大学环境科学与工程学院,上海 201600;2.广东省科学院生态环境与土壤研究所,广东 广州 510650
尾矿是矿产资源开采过程中衍生出来的固体废弃物。尾矿因产量大、有毒金属浸出风险高而备受全球关注。据《中国矿产资源节约与综合利用报告 (2018)》显示,截至2017年底,我国尾矿的堆存量为195亿吨左右(王雪峰等,2018)。尾矿往往未经任何处理直接露天堆放,在雨水的冲刷作用下,尾矿中的有毒金属离子会随地表径流汇入江河或被土壤颗粒所吸附,从而造成水体和土壤污染(程睿,2021)。例如,“世界锑都”锡矿山尾矿库周边土壤存在多种有毒金属污染,其中锑、砷及汞质量分数分别高达 141.92—8733.26、14.95—363.19、0.16—5.68 mg·kg−1(孔天乐等,2020)。
自然界中的金属矿物主要以硫化物形式存在,如黄铁矿(FeS2)、辉锑矿(Sb2S3)、方铅矿(PbS)等,因此尾矿环境中往往富含硫元素(黄小龙等,2018)。硫元素循环是自然界最重要的元素循环之一,其中微生物硫氧化过程是硫元素生物地球化学循环中不可或缺的部分(Cao et al.,2018)。微生物硫氧化是指硫氧化细菌将低价态的还原性硫化物或单质硫完全氧化为硫酸盐(SO42−)或部分氧化为更高价态的硫化物的过程(刘阳等,2018)。硫氧化微生物广泛存在于各种生境中,如网箱养殖区、深海热液区、污水处理厂硝化污泥池等(陈小红等,2016;林旭等,2018;曲珊珊等,2021)。已有研究表明,硫氧化微生物代谢过程会产生SO42−,而SO42−会加快土壤中Cr、Pb等重金属离子的解吸,显著增强其活性形态(郭朝晖等,2002)。除此以外,含硫尾矿中的硫氧化过程会导致尾矿酸化,进而导致Cd、Hg、Ni、Pb、As等重金属元素的活性和迁移能力提高(王存龙等,2012),加剧重(类)金属对环境的污染(杨涛涛等,2020)。尾矿作为硫氧化过程的热点区域,会促使酸性矿山废水的产生。已有研究表明,微生物可以影响黄铁矿、砷黄铁矿、黄铜矿、白铁矿和闪锌矿溶解过程中的硫氧化速率,并且微生物对硫和中间硫化合物的利用可显著地促进尾矿酸化和黄铁矿溶解(Baker et al.,2003)。当前已有的研究对硫氧化过程机制及其环境效应进行了初步探究,但对尾矿中硫氧化微生物的分离鉴定及其对尾矿原位环境的影响仍需进一步解析。因此,本文围绕尾矿中能驱动硫氧化过程的功能微生物种群开展研究,探讨硫氧化功能微生物对尾矿酸化过程的贡献,这对于尾矿治理与修复具有重要意义。
为了解析尾矿原位条件下参与硫氧化过程的关键微生物种类和硫氧化过程对尾矿酸碱度的影响,本项目以典型矿区土壤锡矿山尾矿作为实验土壤,利用定向分离培养的方式获得原位环境中的硫氧化微生物纯菌菌株。对于分离所得纯菌,通过16S rRNA和soxB基因测序等手段确定其种属和功能基因,并验证其硫氧化速率。在此基础上,进一步通过实验室模拟的方式,验证硫氧化过程对土壤酸化过程的影响。
1 材料与方法
1.1 实验仪器和实验试剂
聚苯乙烯细菌皿,规格为90 mm×15 mm,品牌为BIOLOGIX;一次性接种环,品牌为Biosharp;涂布棒,品牌为Biosharp;无菌离心管,规格为50 mL,品牌为 BIOLOGIX;核酸提取试剂盒,品牌为QIAGEN凯杰;电泳仪,型号为LF-31DN;高压灭菌锅,型号为 MLS-3781L;恒温振荡器,型号为SHZ-82;生化培养箱,型号为LRH-250;PCR扩增仪,型号为bio-rad t100;Ged Dox xpt凝胶成像系统;pH计,型号为 LEICI/雷磁 PHS-3C;离子色谱仪,型号为ICS-600;升华硫(化学纯),广州化学试剂厂生产。
1.2 实验土壤与培养基
实验土壤采自湖南冷水江市锡矿山(27°27′N,111°33′E),去除表层土壤(约1 cm)后,用消毒铁锹收集尾矿样本(约1—5 cm),采集的样品用干冰覆盖运回实验室。本研究分离纯化所用固体培养基和液体培养基参考Huang et al.(2020)分离硫氧化菌所报道的选择性培养基,其具体成分如表1所示。液体培养基灭菌冷却后分装到50 mL的无菌离心管待用,固体培养基在液体培养基的基础上另加15 g·L−1的琼脂,而后高温灭菌,待固体培养基凝固前分装倒入平板,等其自然凝固,放于无菌操作台中待用。

表1 硫氧化菌液体培养基和固体培养基Table1 Sulfur-oxidizing bacteria liquid medium and solid medium
1.3 土壤微生物的分离与纯化
称取10 g锡矿山尾矿土于无菌锥形瓶中,并加入100 mL无菌水,随后振荡30 min,得到土壤悬浊液。在无菌环境下,移取100 μL土壤悬浊液于固体培养基上,通过稀释涂布法使土壤悬浊液均匀涂布于固体培养基上,并用封口膜将平板进行密封,密封完全后将平板倒置于生化培养箱(27 ℃)中进行培养,直至平板表面出现明显菌落。随后采用平板划线法将平板中的单一菌落分离至新的固体培养基上,并于生化培养箱中进行培养,以此重复传代,直到每个平板上的菌落从形态、颜色、光滑度以及湿润度等特征来看均表现为单一菌种后结束传代。接着用核酸提取试剂盒提取纯菌的DNA,再将得到的纯菌 DNA以 BoxAIR(5′-CTACGGCAAGGCGACGCTGACG-3′)为引物进行Box-PCR(PCR首先在95 ℃变性5 min;94 ℃变性10 s,52 ℃退火1 min,68 ℃延伸4 min,共10个循环;然后在接下来的25个循环中,每增加一个循环,延伸步骤就延长10 s)。Box-PCR所得产物通过琼脂糖凝胶电泳技术进行电泳分析,以验证菌株分离纯化情况。
1.4 纯菌物种鉴定及其硫氧化功能基因检测
本研究使用引物 27F(5′-AGAGTTTGATCCT GGCTCAG-3′)和 1492R(5′-GGTTACCTTGTTACG ACTT-3′)对纯菌16S rRNA基因序列进行扩增,并将PCR扩增产物送于上海生工生物工程有限公司进行一代测序(Lilian et al.,2021)。此外,采用引物 710F(5-ATCGGYCAGGCYTTYCCSTA-3′)和 1184R(5′-MAVGTGCCGTTGAARTTGC-3′)对纯菌的硫氧化soxB基因片段进行PCR扩增,PCR产物分为两部分,一部分通过琼脂糖凝胶电泳技术进行电泳分析,另一部分PCR扩增产物送于上海生工生物工程有限公司进行测序(储巧玲等,2018)。测序所得序列于NCBI基因库进行数据对比,以获取纯菌的物种信息。同时,使用MEGAX软件对得到的碱基序列构建系统发育树(Alignment方式选择 ClustalW,构建方式选择Maximum Likelihood),并比较分离纯化得到的纯菌与发育树中各菌种之间在系统发育学上的关系和相似性。
1.5 硫氧化功能的验证
在无菌条件下,将分离纯化得到的纯菌(200 μL菌液)分别接种于含有30 mL液体培养基和0.1 g升华硫的无菌西林瓶中。每种纯菌设置5个重复组,同时设置了3个不加菌液的空白对照组。硫氧化实验体系构建完成后将西林瓶静置放于室温条件下,最后采用离子色谱仪对各微宇宙中SO42−浓度进行检测,以验证纯菌的硫氧化功能。
1.6 硫氧化微生物原位条件模拟实验
尾矿是矿物提取残渣与水的混合物,但由于矿石碎渣保水性较差,尾矿堆积一段时间后含水率降低,会由尾矿与水的混合形态变为湿润状态。因此,为了更加真实地模拟尾矿土壤的实际状态,本研究构建了两组原位条件模拟实验,一组为淹水处理,另一组为湿润处理。具体操作如下:淹水条件下,在超净工作台中向无菌锥形瓶中加入20 g灭菌尾矿土,1 g升华硫,并且加入50 mL无菌水使尾矿土壤完全被水淹没,然后接种500 μL菌液于无菌锥形瓶中;湿润条件下,向100 mL西林瓶中加入50 g灭菌并且冷冻干燥后的干土,12.5 mL灭菌水,控制含水率在20%左右,最后加入1 g升华硫,1 mL菌液。两组实验每种硫氧化微生物均设置5个重复组,同时设置3个不加菌液的空白对照组。微宇宙构建完成后将其放于室温条件下进行培养。每间隔一段时间监测一次pH值,并计算氢离子浓度。对于淹水处理的尾矿土pH,摇匀后直接使用pH计进行测量;对于湿润处理的尾矿土,则需称取2 g尾矿,加入5 mL去离子水,振荡摇晃30 min后,用pH计测量土壤浸出液的pH。
2 结果
2.1 硫氧化功能微生物分离鉴定
本研究以锡矿山尾矿土为研究对象,以还原态硫作为唯一电子供体,通过稀释涂布平板法和平板划线法成功分离得到了24株纯菌。基于Box-PCR和琼脂糖凝胶电泳技术的对比分析,确认了12个非冗余菌株。通过16S rRNA测序和NCBI基因库比对结果发现,这 12株非冗余纯菌分别为Pseudoxanthomonasjiangsuensis、Limnobacter、Ciceribacterthiooxidans、Pseudomonasoryzihabitans、Cellvibriozantedeschiae、Methyloversatilis、Nocardioidesalbus、Microbacteriumtrichothecenolyticum、Azoarcus olearius、Thauerasp.、Stenotrophomonasrhizophila和Flavobacteriumtructae。此外,从12株纯菌的硫氧化功能基因(soxB基因片段)的PCR扩增及其琼脂糖凝胶电泳分析结果中发现,具有soxB硫氧化功能基因片段的纯菌有两株,如图1所示,标记为1和2,分别命名为Methyloversatilissp.LJY-1和Limnobactersp.LJY-2(以下分别简称为LJY-1和LJY-2)。
2.2 纯菌LJY-1和LJY-2硫氧化功能验证
硫氧化基因检测结果表明,LJY-1和LJY-2两株纯菌具有硫氧化潜能。经预实验验证,在所得到的全部12株纯菌中,仅LJY-1和LJY-2在试验条件下展现出硫氧化能力。为了进一步验证这两株纯菌的硫氧化潜力,对硫氧化微宇宙体系中SO42−浓度进行检测。在硫氧化体系中,发现前8天内所有处理组中SO42−浓度均无明显变化(图2)。经过8 d的调整期后,接种了LJY-1的处理组中SO42−浓度以 (64.55±5.90) mg·L−1·d−1的平均速率快速增长,第 22天 SO42−浓度达到了 (1154.07±81.83)mg·L−1。与之相比,在培养结束时,接种了LJY-2的处理组的 SO42−浓度为 (387.978±24.04) mg·L−1,仅略高于空白对照组 (254.78±13.63) mg·L−1。
2.3 纯菌16S rRNA和soxB基因序列分析及系统发育树的建立
基于硫氧化实验的结果,LJY-1表现出了较强的硫氧化性能。为了进一步深入了解LJY-1,本研究对LJY-1进行基于16S rRNA基因和soxB基因的系统发育分析。基于16S rRNA系统发育树结果发现,LJY-1与Methyloversatilisdiscipulorum亲缘关系最近,相似性达到了99.16%(BLAST对比得到)(图3)。除此以外,LJY-1与Pandoraea、Ralstonia、Polynucleobacter等菌属位于同一簇上,说明LJY-1与这些菌的相似性较高。基于soxB基因系统发育树结果表明LJY-1含有两个soxB基因片段(图4),将其命名为Methyloversatilissp.LJY-1soxB1和Methyloversatilissp.LJY-1soxB2,还可发现LJY-1与Methyloversatilisdiscipulorum的相似度最高,达到了86.05%(BLAST对比得到)。
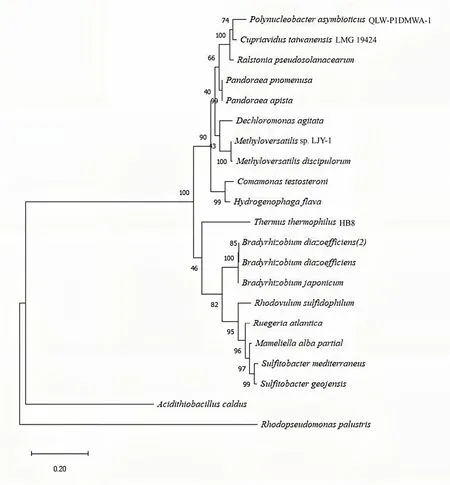
图3 菌株Methyloversatilis sp.LJY-1基于16S rRNA基因序列同源性构建的系统发育树Figure 3 Phylogenetic tree of Methyloversatilis sp.LJY-1 based on the 16S rRNA gene homology
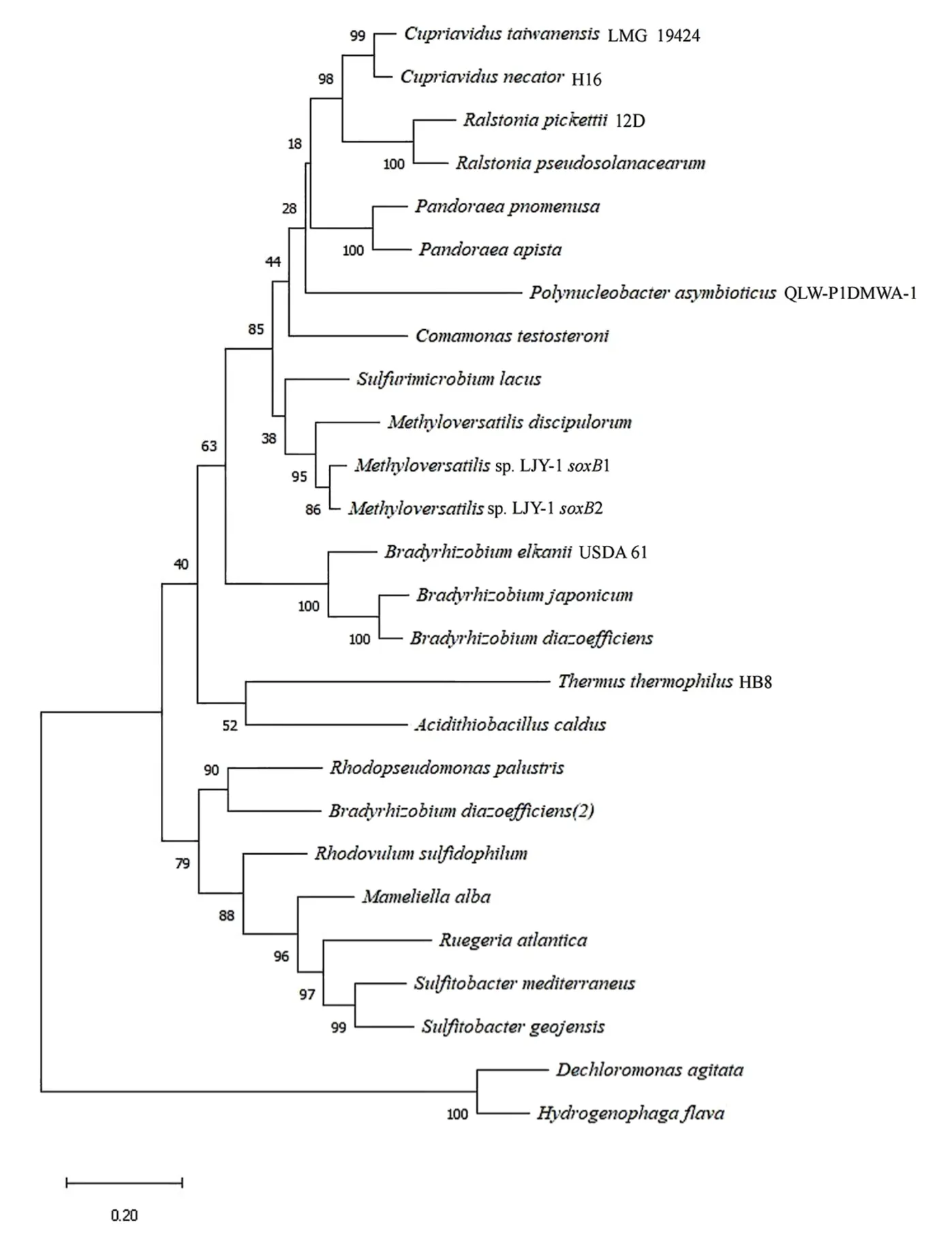
图4 菌株Methyloversatilis sp.LJY-1基于soxB基因序列同源性构建的系统发育树Figure 4 Phylogenetic tree of Methyloversatilis sp.LJY-1 based on the soxB gene homology
2.4 原位土壤硫氧化微生物对土壤酸化作用的影响
原位条件模拟实验结果表明,在淹水状态下(图5),各处理组中pH随着时间的推移均逐渐降低,尤其是接种LJY-1的实验组在培养了28 d后,pH由8.05左右降至7.30左右,氢离子浓度显著升高了 (6.10±0.35)倍,而接种 LJY-2实验组和空白对照组中氢离子浓度分别升高了 (4.74±0.64) 倍和 (3.51±0.10) 倍。类似地,湿润状态下(图6)接种 LJY-1的实验组氢离子浓度上升幅度(3.18±0.21) 倍显著大于接种纯菌 LJY-2的实验组(2.79±0.16) 倍和空白对照组 (2.59±0.66) 倍。综上所述,LJY-1对尾矿土壤酸化具有显著促进作用。与湿润状态相比,淹水状态下LJY-1实验组氢离子浓度提升更为明显,加剧了尾矿土壤的酸化程度。

图5 淹水状态下微生物对土壤酸化的影响Figure 5 The influence of microorganisms on soil acidification under flooded conditions
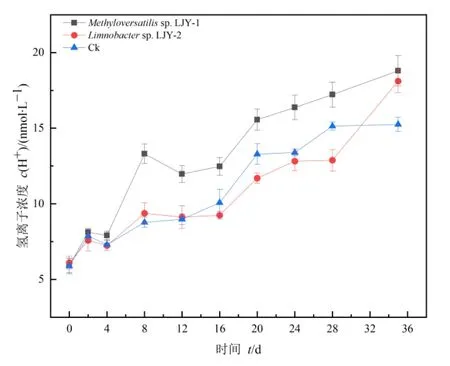
图6 湿润状态下微生物对土壤酸化的影响Figure 6 The influence of microorganisms on soil acidification under humid conditions
3 讨论
伴随着矿石的开采,尾矿产生量逐渐增多,进而带来一系列污染问题(杨勇等,2015)。自然界中含硫矿物分布广泛,种类繁多,主要以单质硫和化合态硫两种形式存在。含硫矿石开采后的尾矿含有高含量的硫化物,一般在 2.1%—2.5%之间(苏雄,2016)。微生物硫氧化是硫元素生物地球化学循环的重要过程。硫氧化菌作为硫元素循环中不可缺少的一部分,能利用硫氧化物获取能量,并把低价硫化物氧化为硫酸盐,同时产生大量氢离子,导致土壤酸化,严重影响土壤理化性质,尤其会促进土壤中重(类)金属活性和迁移性,加剧重(类)金属污染(杨涛涛等,2020)。
尾矿环境中广泛存在硫氧化微生物,soxB基因驱动的硫氧化过程被认为是硫氧化的基本和原始分子机制,在硫氧化过程中具有重要作用(Ghosh et al.,2009)。soxB基因编码硫酸盐硫酯酶或硫水解酶亚基,这是硫氧化酶系的重要组成部分,与其他物质组成的酶复合体能催化硫单质、硫代硫酸盐、硫化物进行氧化反应生成硫酸盐(Meyer et al.,2010)。例如,soxB基因能编码一种硫代硫酸盐氧化多酶,其反应中心含有一个假锰簇,是Paracoccus pantotrophusGB 17氧化硫代硫酸盐所必需的(Schneider et al.,1994)。因此,本研究采用分离纯化技术从尾矿中成功分离纯化得到 12株非冗余细菌,并结合 Box-PCR和琼脂糖凝胶电泳技术对 12株非冗余细菌的soxB基因进行鉴定。结果发现其中两株细菌存在soxB功能基因片段,即Methyloversatilissp.LJY-1和Limnobactersp.LJY-2,表明 LJY-1和 LJY-2具有硫氧化潜能。据报道,Methyloversatilis是一种甲基营养生物,能从活性甲基化合物上将甲基催化转移到其他化合物上,从而形成各种甲基化合物,或是对某些蛋白质或核酸等进行化学修饰形成甲基化产物(Chistoserdova et al.,2015)。Methyloversatilis存在于多种生境中,在华盛顿湖沉积物、火山口温泉、活性污泥等环境中均被分离纯化得到(Cai et al.,2011;Doronina et al.,2014;Smalley et al.,2015)。Methyloversatilis具有广泛代谢能力,除甲醇和甲胺外,还能够利用许多有机酸、醇和芳香族化合物(Zhang et al.,2015)。目前尚未有Methyloversatilis属微生物具有硫氧化能力的相关报道,本研究首次发现Methyloversatilis属中菌株具有硫氧化功能,这为菌株LJY-1应用于脱硫以及有机污染物转化提供了重要理论基础。此外,Limnobacter是一种能将硫代硫酸盐氧化成硫酸盐而进行化学异养生长的微生物(Spring et al.,2001)。尽管如此,本研究结果表明,LJY-2作为Limnobacter属类菌株,具有硫氧化功能基因却未表现出明显的硫氧化性能,这可能与硫氧化实验体系中未提供有机碳源,限制其生长发育有关。
为了进一步验证LJY-1和LJY-2的硫氧化功能,本研究进行了硫氧化模拟实验。结果发现,接种LJY-1的处理组中SO42−浓度快速增长,而接种LJY-2的处理组 SO42−浓度在整个周期内无明显变化,说明在模拟试验条件下,LJY-1具有快速将还原态硫氧化为硫酸根的能力。已有研究发现,Methyloversatilis在黄铁矿尾矿、中性矿山排水、S2−自养颗粒污泥等环境微生物群落中均有分布(Kisková et al.,2018;Yang et al.,2018;Zhao et al.,2021),表明Methyloversatilis在环境中广泛存在,且多出现于硫循环过程活跃的生态环境中。在本研究中,LJY-1菌株分离自锡矿山尾矿土,硫含量较高,证实Methyloversatilis可能对高硫环境具有良好适应性。
微生物硫氧化过程加快尾矿酸化。硫氧化微生物会在金属硫化物表面附着并形成微生物膜,在矿物-微生物膜界面微环境中存在着强烈的微生物氧化和化学氧化作用,两种氧化作用相互协同、共同促进,生成稳定硫酸盐的同时还会产生大量酸性废水(陆现彩等,2019)。对于采矿业来说,采矿增加了某些矿石暴露在空气和水中的表面积,从而增加了产酸率(Baker et al.,2003)。硫氧化细菌通过协助分解硫化矿物会加速酸性矿山废水的产生,进一步造成尾矿土壤的酸化(Akcil et al.,2006)。为此,有研究使用硫氧化细菌对盐碱土进行改良,降低土壤 pH(张静等,2009)。土壤酸化会促进尾矿土壤中重金属和类金属活性升高并进行迁移,甚至会破坏尾矿土壤微生物生态功能(Bolan et al.,2003)。由于矿石碎渣保水性较差,尾矿堆积一段时间后含水率降低,呈现湿润状态。本研究设置了两组原位条件的模拟实验,其中一组模拟新产生固液混合状态的尾矿,另一组模拟堆放了一段时间含水率下降后湿润状态的尾矿。结果显示,在硫氧化菌作用下,尾矿土壤在淹水状态下的酸化速度更快,酸化程度更高。基于此,矿石开采所产生的尾矿应尽早完成矿渣与废液的分离,减缓土壤酸化,削弱重金属污染物对周边环境的不利影响。
4 结论
(1)以“世界锑都”锡矿山尾矿土为研究对象,在硫氧化条件下对原位微生物种群进行分离纯化,成功获得两株具有硫氧化基因的纯菌,分别为Methyloversatilissp.LJY-1和Limnobactersp.LJY-2。
(2)通过硫氧化验证实验,本研究首次发现了Methyloversatilis中的菌种具有硫氧化功能。
(3)基于硫氧化微生物原位条件模拟实验,证实了Methyloversatilissp.LJY-1驱动的硫氧化过程,特别是在淹水条件下,会显著加快尾矿酸化过程。
