玉米ACO家族的全基因组鉴定与表达分析
2022-06-24杨利艳史瑞翔王创云张丽光郭虹霞秦丽霞王美霞
杨利艳,边 璐,史瑞翔,王创云,邓 妍,张丽光,赵 丽,郭虹霞,秦丽霞,王美霞
(1. 山西师范大学生命科学学院,中国 太原 030031;2.山西农业大学农学院,中国 太原 030031;3. 东北林业大学园林学院,中国 哈尔滨 150006)
生物与非生物胁迫对植物生长发育的影响是近年来关注的热点,抗性基因的挖掘与功能鉴定对提高作物抗逆性有着重要意义。乙烯是植物体内一种重要的激素,参与植物众多生长发育过程,如种子萌发,根生长发育,茎的生长、成熟与衰老[1,2]等;同时参与一系列重要的物质代谢,并在受到外界刺激如机械损伤、冷害、盐等胁迫和病原菌入侵等均会通过释放量的改变,进一步引起植物发生应答。
1-氨基环丙烷-1-羧酸氧化酶(1-aminocyclopropane-1-carboxylic acid oxidase,ACO)是乙烯生物合成途径中的最后一个酶也是关键酶,被认为是高等植物中乙烯应答的主要标志[3]。最早被Yang等[4]发现并命名为乙烯形成酶(EFE),后来证实需要抗坏血酸和氧作为辅助底物,因此称为ACC氧化酶。目前多种植物中的ACO基因被克隆得到,并证实ACO基因为家族基因。目前对其在植物生长发育及逆境胁迫等方向的研究已有报道。Sornchai等[5]通过导入石斛兰CpACO基因反义载体从而延长了石斛兰花期;Yuan等[6]鉴定出梨中3个ACO基因可被乙烯诱导,是控制果实成熟的主要因素;脱落酸、外部机械损伤、低温能够诱导番茄、花椰菜ACO基因的表达[7];生长素、干旱及盐胁迫会抑制植物ACO基因的表达[8];六出花属植物ACO基因在花脱落前转录水平上升了4.5倍,而在花发育的前期几乎没有变化[9]。研究显示,ACO基因的表达能够在很多植物生理活动中被快速诱导,表明 ACO 可能是调控乙烯生物合成的一个关键酶。
玉米是世界主要粮食作物之一,同时还是饲用、工业和能源开发的重要原料[10]。玉米在生长发育过程中会遇到干旱、低温和病虫害等各种生物与非生物胁迫,从而严重影响产量。植物在进化过程中为更好地适应环境变化形成了复杂的防御机制。有关玉米ACO基因的研究鲜有报道。本研究基于玉米全基因组测序数据,通过生物信息学方法对玉米基因组中ZmACO基因进行鉴定,并对其进行序列特征、理化性质、进化关系等分析,同时结合前期研究,根据粘虫取食的玉米转录组数据分析ZmACO基因在虫食前后表达量变化。
1 材料与方法
1.1 材料
1.1.1 玉米基因组数据来源 玉米PH207基因组数据、水稻ACO蛋白序列从Phytozome13(http://phytozome. Jgi. Doe. Gov/pz/)中获得,拟南芥ACO蛋白序列从TAIR(https://www.arabidopsis.org/index.jsp)中获得。
1.1.2 实验材料 植物材料:玉米 (Zeamaysssp.maysL.) 自交系B73种子由中国农业科学院生物技术所提供,用于转录组测序。玉米杂交种先玉335种子由山西省农业科学院小麦研究所提供,用于饲喂粘虫。
动物材料:粘虫 (MythimnaseparateWalker),又名东方粘虫,刚孵化的粘虫由中国农业科学院植物保护研究所提供。
1.2 方法
1.2.1 玉米ACO基因家族成员的鉴定及序列分析 利用TAIR数据库中所有的拟南芥ACO蛋白,在玉米基因组数据库进行Blastp比对搜索,筛选出玉米中所有的 ACO蛋白,运用Pfam(http://pfam.xfam.org/)分析候选ACO蛋白结构,去除无ACO蛋白典型保守结构域的成员,得到ACO家族的所有成员。通过Expasy (https://web.expasy.org/protparam/)对ACO蛋白家族的序列氨基酸数、分子量、等电点及脂肪族氨基酸数等一级结构进行分析。
1.2.2 玉米ACO染色体定位、理化性质、二级结构和亚细胞定位分析 利用在线工具MG2C(http://mg2c.iask.in/mg2c_v2.1/)制作染色体定位图。采用Expasy (https://web.expasy.org/protparam/),SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/ secpred_sopma. pl)和CELLO2.5(http://cello.life.nctu.edu.tw/)等在线软件分别对ACO的亲水性、蛋白质二级结构和亚细胞定位进行预测分析。
1.2.3 系统进化分析 将玉米ACO家族蛋白序列与拟南芥(Arabidopsisthaliana,At)和水稻(Oryzasativa,Os)已知ACO蛋白序列通过MEGA7.0中的Muscle进行比对,采用邻接法(bootstrap=1 000)构建进化树。
1.2.4 玉米ACO家族基因结构、保守基序和保守结构域分析 采用GSDS2.0(http://gsds.cbi.pku.edu.cn/)进行玉米ACO基因家族外显子—内含子结构分析,用MEME(https://meme-suite.org/meme/)进行保守基序分析,利用TBtools工具绘制玉米ACO蛋白的motif图,分析玉米ACO氨基酸序列的保守性。采用NCBI-CDD数据库(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)进行保守结构域分析,利用TBtools工具绘制玉米ACO基因家族的保守结构域。
1.2.5 玉米ACO基因启动子分析 利用TBtools提取玉米ACO家族基因的启动子序列并用在线工具Plant CARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析玉米ACO家族基因上游2 000 bp序列,预测ACO基因基序类别和功能特征。
1.2.6 转录组测序分析玉米ACO基因表达 粘虫取食玉米实验设置及转录组分析见本课题组已发表论文[11]。
2 结果与分析
2.1 玉米ACO基因家族成员的鉴定及序列分析
利用所有的拟南芥ACO蛋白和水稻ACO蛋白,在玉米基因组数据库进行Blastp比对搜索,筛选出玉米中的ACO蛋白,运用Pfam(http://pfam.xfam.org/)分析候选ACO蛋白结构,去除无ACO蛋白典型保守结构域的成员,最终得到8个ZmACO基因,分别命名为ZmACO1~ZmACO8。并获得了每个成员的全基因序列、CDS序列及相应的蛋白序列。基因片段全长在944~4 264 bp,CDS全长为888~1 359 bp,编码氨基酸长度为296~453 aa(表1)。
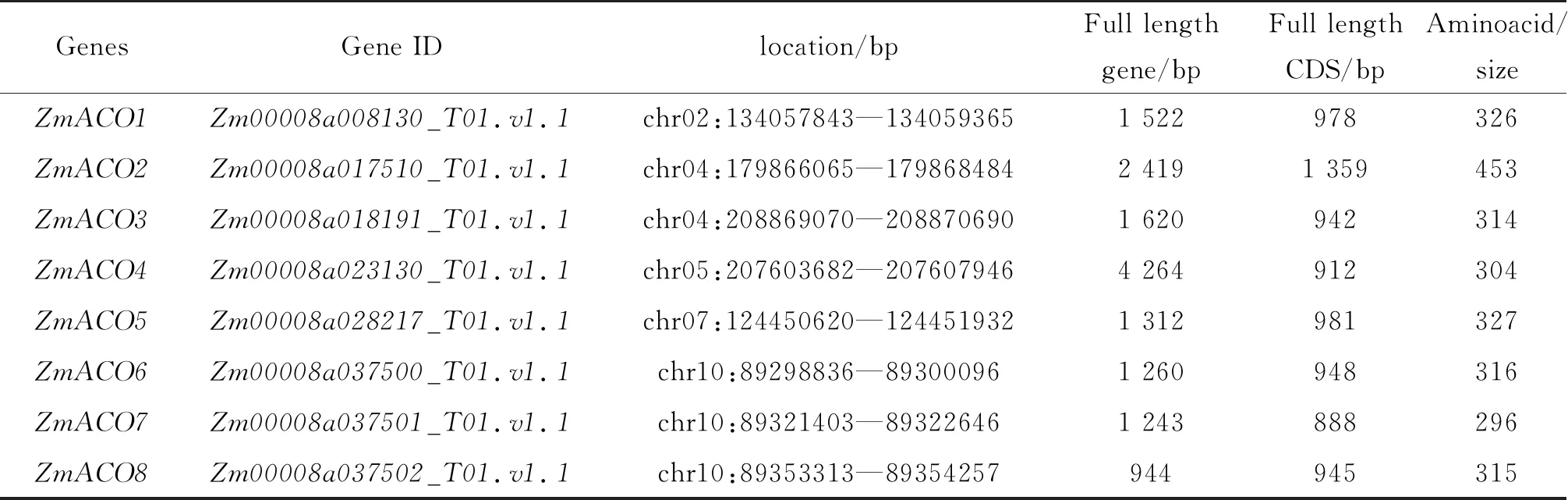
表1 玉米ACO基因家族成员的基本特征
2.2 玉米ACO染色体定位、理化性质、二级结构和亚细胞定位分析
染色体定位分析发现该家族8个基因分布于玉米的5条染色体上(图1),且均位于染色体的中下部。其中第10染色体上有3个基因(ZmACO6,ZmACO7和ZmACO8)成簇分布,且属同一亚族以不同剪接方式转录本定位于同一染色体上。第4染色体上有2个基因(ZmACO2和ZmACO3),第2,5和7号染色体上各有一个基因,分别为ZmACO1,ZmACO4和ZmACO5。且结合ZmACO进化树发现,ZmACO1(2号染色体)和ZmACO3(4号染色体)在不同染色体上发生片段重复。
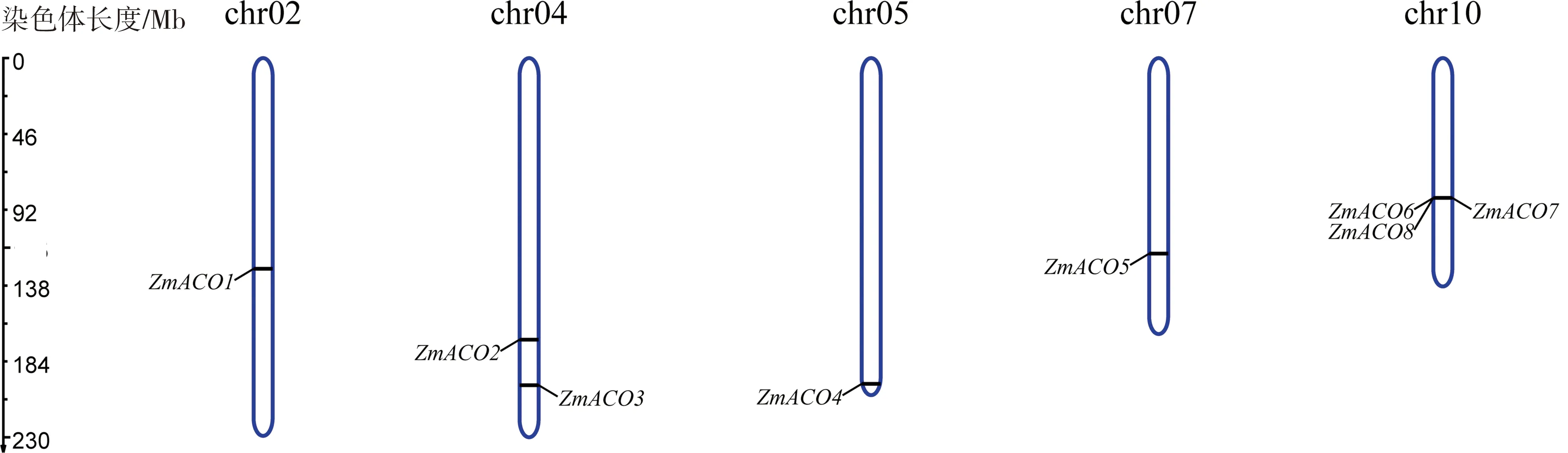
图1 ZmACOs基因在玉米染色体上的定位
通过对8个ZmACO蛋白基因家族成员理化性质的研究表明(表2),ZmACO的平均相对分子质量为32 974 260~36 437 570。理论等电点PI值为4.97~5.49,即该基因家族蛋白均为弱酸性蛋白。该基因家族不稳定系数为27.16~45.82,ZmACO1,ZmACO3及ZmACO5为亲水性不稳定蛋白,其余为亲水性稳定蛋白,脂肪系数为63.52~85.03。对ZmACO蛋白二级结构进行分析,可知该家族主要有α-螺旋、β-折叠和无规则卷曲。其中,α-螺旋为115~163个,β-折叠为56~74个,无规则卷曲为97~178个。亚细胞定位预测表明,玉米ACO家族所有成员均在细胞质中表达,推测ZmACO会在酸性亚细胞环境中发挥作用。
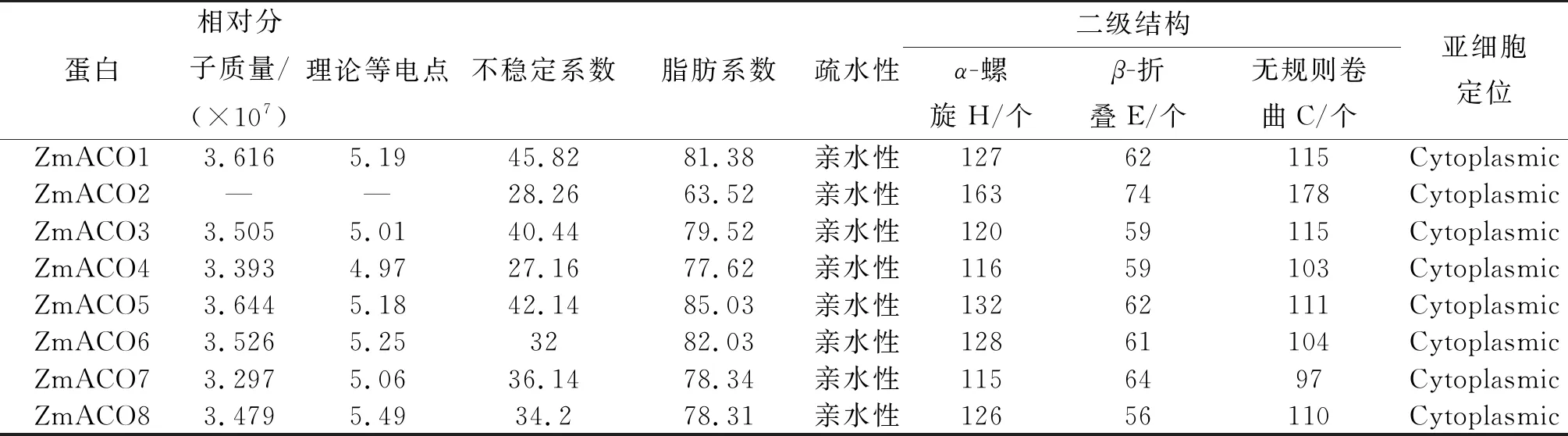
表2 ZmACOs蛋白的理化性质、二级结构和亚细胞定位
2.3 玉米、拟南芥和水稻ACO家族蛋白系统进化树分析
为进一步了解ACO基因家族的进化关系,利用单子叶植物:玉米(8个)、水稻(4个);双子叶植物:拟南芥(4个)的ACO蛋白(总计16个蛋白序列),基于邻接法构建无根进化树(图2)。结果表明,16个ACO序列蛋白被划分成ACOⅠ(7个)、ACOⅡ(2个)和ACOⅢ(7个)3个分支。8个ZmACO蛋白家族成员分布在ACOⅠ和ACOⅢ中,ACOⅡ分支中没有ZmACO蛋白家族成员。通过分析玉米、拟南芥和水稻ACO基因的同源性发现,存在3对种内旁系同源基因(玉米2对,拟南芥1对),2对种间直系同源基因(AtACO3和OsAO1、ZmACO5和OsACO4),表明在单子叶和双子叶植物分离之前就出现了ACO基因的共同祖先,ACO基因家族按照物种特异性进行扩展,以更好地适应环境变化。
经过全面的质量检查与测试,本地铁车站高压旋喷桩质量合格,承载力能达到设计与规范的要求,说明以上施工工艺和技术合理可行,具备良好的参考借鉴价值。
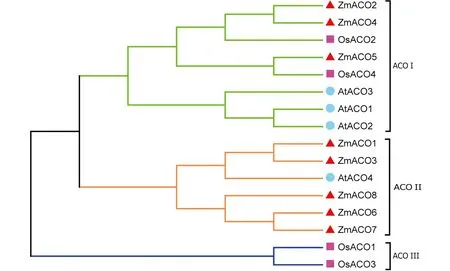
图2 ACO进化分析(Zm:玉米;At:拟南芥;Os:水稻)
2.4 玉米ACO家族基因结构、保守基序和保守结构域分析
对玉米ACO基因家族进行基因结构分析预测,结果表明:有4个基因没有5’UTR区,有4个基因有UTR区(如图3)。ZmACO8没有内含子,有1个外显子;ZmACO5,ZmACO6和ZmACO7有1个内含子和2个外显子;ZmACO1,ZmACO2和ZmACO3有2个内含子和3个外显子;ZmACO4有4个内含子和5个外显子。其中旁系同源基因ZmACO1和ZmACO3的基因结构高度相似,均有5’UTR区、3个外显子和2个内含子;旁系同源基因ZmACO6和ZmACO7的基因结构相似,均没有5’UTR区、2个外显子和1个内含子;这两对旁系同源基因均属于ACOⅠ,并且氨基酸序列同源性均在80%以上,这与他们的进化结果相对应。
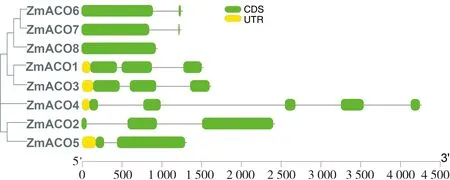
图3 ZmACOs进化树与基因结构
利用MEME在线软件分析玉米ACO家族成员的保守基序分布,共鉴定出了10个motif,结果如图4所示。所有玉米ACO家族成员中均含有motif1,motif2,motif4,motif6和motif8,并且分布位置相似,均为motif6-motif4-motif2-motif1-motif8。可见玉米ACO蛋白结构保守性较高。
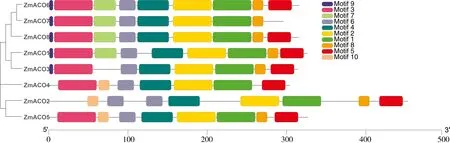
图4 ZmACO蛋白家族保守基序
对玉米ACO家族成员的氨基酸序列进行保守结构域分析显示(图5),所有成员均含有相似的保守结构域。其中ZmACO2的保守结构域最长,其余成员的保守结构域长度及位置相似,因此推断该基因家族成员可能具有相似的生物学功能。
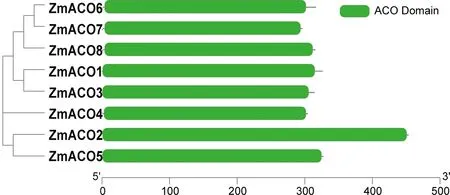
图5 ZmACO蛋白家族保守结构域
2.5 玉米ACO基因启动子分析
对玉米ACO基因家族成员启动子上游2 kb区域的顺式作用元件进行分析,预测的顺式作用元件可分为两类(表3),即植物激素调控元件和逆境胁迫相关元件。可能应答的激素包括以下6类:脱落酸(ABA)、生长素(IAA)、赤霉素(GA)、茉莉酸甲酯(MeJA)、乙烯(ERE)和水杨酸(SA)。MeJA响应元件和ABA应答元件在玉米ACO基因家族中数量最多,其中MeJA调控元件在ZmACO3中最多(14个),在ZmACO5和ZmACO8的含量最少(2个);ABA作用元件在ZmACO6中最多(7个),在ZmACO1中最少(1个)。逆境胁迫类元件分为3类:厌氧诱导元件(ARE)、逆境应答元件(MBS)和抗寒响应元件(MYC)。其中MYB和MYC元件数量最多,且只有ZmACO5不含逆境胁迫相关元件,因此推测玉米ACO家族在响应逆境胁迫中ZmACO5可能不发挥作用。
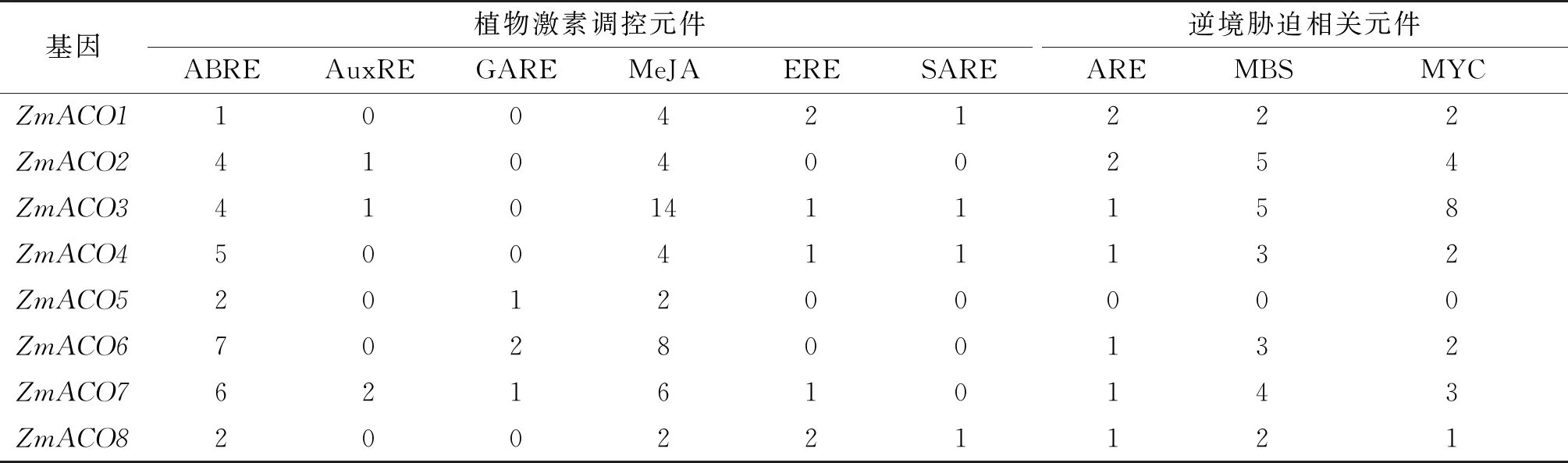
表3 ZmACO基因家族上游顺式作用元件
2.6 玉米ACO对粘虫取食的响应
根据ZmACOs基因在转录组数据中表达量的高低,筛选出粘虫取食前后表达量差异最高的基因见图6。ZmACO6和ZmACO7在粘虫取食前后表达量差异相同且最明显,ZmACO5和ZmACO8取食前后表达量差异较小,ZmACO4的表达在取食前后无差异,ZmACO1和ZmACO3在取食前后均无表达,因此推测ZmACO6和ZmACO7在玉米响应粘虫取食过程中发挥重要作用。
3 结论与讨论
本研究通过blastp比对和保守结构域筛选,确定了8个ZmACOs基因家族成员。染色体定位显示ZmACO2和ZmACO3在同一条染色体上,但是在进化树中却分布在不同的亚族,这可能是这两个基因mRNA的表达模式不同。ZmACO2和ZmACO5的氨基酸同源性比ZmACO2和ZmACO3高,且不在同一条染色体上,推测ZmACO2和ZmACO5在同一亚族的原因可能是氨基酸同源性高,保持紧密连锁[12]。玉米ACO基因家族编码蛋白为296~453 aa,保守结构域同源性最高均在多肽中部,最大差异在C端,这与前人的研究相吻合[13]。
系统进化树分析表明,在ACOⅠ中,多个玉米ACO基因发生聚类,并且在基因结构、保守基序、保守结构域中均高度相似,说明ZmACO1,ZmACO3,ZmACO6,ZmACO7和ZmACO8在后期进化而来且功能可能相似。ZmACO5和OsACO4是一对种间直系同源基因,亲缘关系更近。
ZmACO6和ZmACO7的氨基酸序列同源性最高,其次为ZmACO1和ZmACO3,ZmACO2和 ZmACO5同源性最低,这3对基因在系统进化树上分别处于同一分支,为重复基因。表明玉米中一些ACO基因成员可能经历基因复制及分化进程,这3对基因可能是在物种进化过程中,全基因组复制时不同数目的内含子插入导致局部复制所产生[8]。
基因的外显子与内含子可作为揭示基因家族各成员之间进化关系的重要印迹[14]。在ZmACO基因家族成员中,只有ZmACO8没有内含子,推测其可能是较为原始的类型。其他成员具有1~4个内含子,可能是在ZmACO8进化过程中通过外显子重排产生。ZmACO4具有4个外显子,其阅读框经内含子多次插入,属于家族中较新的成员。
启动子是控制基因转录起始的关键性结构,位于基因5’端的上游,精准调控RNA聚合酶与DNA的结合,通过上下游顺式元件调控基因表达[15]。本研究对启动子元件分析发现,ZmACOs基因启动子区均有激素与逆境胁迫响应元件分布,该结果表明乙烯(ET)与其他激素如SA,IAA,MEJA,ABA及GA等存在相互作用,共同参与植物的防御响应[16],也为乙烯参与干旱、低温和厌氧等[17]提供了合理的解释。
研究发现MeJA处理在整个贮藏期间增强了苹果基因MdACO1及MdACO2等的表达,对乙烯生物合成和信号通路相关基因的表达进行了差异调节[18]。外施茉莉酸和乙烯能够提高植物防御素PDF1.2基因的转录和翻译水平,这说明茉莉酸与乙烯信号途径存在着不同程度的交互作用,并且是机械伤害、虫害诱导的植物防御必要措施[19]。
ABA处理能够显著提高苹果乙烯生物合成基因ACO1/2和ACS1/3的表达,同时促进苹果乙烯信号转导的ERS1/2、ETR2和ERF3/4/5在贮藏过程中表达量的增加,显著促进了乙烯的积累[20]。还有研究发现,ABA作为上游调节因子启动呼吸跃变型果实成熟可能是通过诱导乙烯合成而实现。外源ABA可增加乙烯合成相关基因的转录水平,促进乙烯的生成,而使用ABA抑制剂则具有相反的作用[21]。ACO基因的表达和乙烯的产生与PEG处理的干旱胁迫密切相关。前人研究发现,ACO以基因家族的形式存在于多种植物中,在乙烯合成过程中有关键的作用;植物ACO基因的表达受到激素(IAA,ABA和乙烯)、环境胁迫(机械损伤、高温、低温、臭氧、高盐、干旱、淹水和病原体侵染)和生长发育过程(植物开花、果实成熟、衰老)的诱导[22]。上述研究为本研究结果中玉米ZmACOs基因启动子上具有众多诸如MEJA,ABA和低温诱导相关元件提供了合理的注解。综上所述,ZmACOs基因可能在玉米生长发育及逆境胁迫响应中发挥重要调控作用,可以作为作物改良的重要基因,后期需进一步证明。
来源于不同物种的ACO可对多种环境胁迫具有响应,例如机械损伤割胶对橡胶树HbACO7基因表达有影响,且证实HbACO7基因编码具有生理活性的 ACO 酶,能体外催化ACC产生乙烯[23];在低温和干旱胁迫下,转基因烟草的向日葵HaACO1基因表达量高于野生型烟草[24];过表达马铃薯StACO1基因的烟草,可增强对钾胁迫的耐受性[25]。
本研究中,对粘虫取食玉米前后ACO基因家族各基因的表达量进行统计分析后发现,ZmACO6和ZmACO7在取食前后基因的相对表达量差异最大,推测这两个基因与玉米的抗虫响应密切相关。
