β-地中海贫血症患者血清铁调素hepcidin、GDF15表达及与预后的关系
2022-06-24谢玉文陈会荣
李 秀,谢玉文,陈会荣
(湖北省汉川市人民医院 检验科,湖北 孝感 431600)
地中海贫血症也可称为海洋性贫血,因血红蛋白之中珠蛋白链生成数量减少所致。以往调查显示,我国地中海贫血疾病基因携带者主要集中于广西以及广东等地区,分别占当地人口数目约20%-25%[1-2]。地中海贫血症在发病初期症状具有一定隐匿性,随着病情恶化,会产生慢性溶血性贫血症,使得机体血液运氧能力减弱。有报道称,地中海贫血一般具有贫血症状、无效红细胞生成以及铁过载所致骨质疏松或者内分泌失调等[3-4]。地中海贫血症可以分为两大类,分别为α-地贫及β-地贫。现阶段,临床对于β-地中海贫血症仍无有效治疗手段。了解β-地中海贫血症患者预后相关因素,对改善其预后具有重要指导意义。以往研究表明,铁调素hepcidin能够通过抑制肠对铁元素的吸收与人体单核巨噬细胞系统对其的释放,有效调控铁代谢状态,在地中海贫血发病机制中发挥着重要作用[5]。生长分化因子15(GDF15)是联系“红系”细胞生成以及hepcidin调控铁代谢水平重要分子蛋白。有报道称,GDF15能够用于评估人体无效造血情况[6]。当前,关于β-地中海贫血症患者预后相关因素的研究较少。本研究主要探究β-地中海贫血症患者血清hepcidin、GDF15表达水平,并分析其与预后关系,旨在为临床诊治提供参考依据。
1 资料与方法
1.1 临床资料选取2017年2月-2019年2月汉川市人民医院106例β-地中海贫血症患者作为研究组。纳入标准:(1)与《血液病诊断及疗效标准》[7]中β-地中海贫血症有关诊断标准相符;(2)初次就诊,以往无输血或者相关治疗史。排除标准:(1)合并重要脏器(比如心、肝、肾等)功能异常;(2)合并感染性疾病、白血病或者糖尿病等;(3)肿瘤患者;(3)没有按要求接受治疗。并选取同期50例体检健康者纳入对照组。所有研究对象或其家属对研究知情,签署知情同意书。研究经医院伦理委员会审核。依据《血液病诊断及疗效标准》[7],将β-地中海贫血症患者分为轻型组、重型组与中间型组。
1.2 方法
1.2.1临床资料收集 以自拟调查表收集2组临床资料,主要为性别、年龄、谷丙转氨酶(ALT)、谷草转氨酶(AST)、血红蛋白(Hb)、血小板(PLT)、网织红细胞(RET)、红细胞分布宽度(RDW)等。
利用Au-5800全自动生化分析仪(购自贝克曼公司)进行血清ALT、AST水平检测;采用CAL8000血液细胞分析仪(购自迈瑞公司)检测血清Hb、RET及RDW;Vi-CELL XR全自动细胞计数仪(购自贝克曼库尔特公司)检测PLT。抽取两组晨起空腹静脉血3 ml,15 min离心处理后分离血清样本,3 000 r/min,置于-80℃条件下保存待测,酶联免疫吸附法进行hepcidin与GDF15水平检测。
1.2.2随访 对患者进行2年随访,详细记录其生存情况,分为生存组与死亡组。
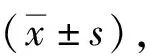
2 结果
2.1 研究组与对照组一般资料比较见表1。2组性别、年龄比较无显著差异(P>0.05)。

表1 一般资料比较[例
2.2 4组血清hepcidin、GDF15水平比较见表2。轻型组、重型组与中间型组血清hepcidin水平明显低于对照组(P<0.05),轻型组、重型组与中间型组比较无显著差异(P>0.05);GDF15为:重型组>中间型组>轻型组>对照组(P<0.05)。
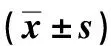
表2 4组血清hepcidin、GDF15水平比较
2.3 不同预后组临床资料比较见表3。两组性别、年龄、ALT、AST、Hb、PLT、RET、RDW比较无显著差异(P>0.05);死亡组Hb、hepcidin水平明显低于生存组(P<0.05),且GDF15水平明显高于生存组(P<0.05)。

表3 不同预后组临床资料比较[例
2.4 预后影响因素Logistic回归分析预后为因变量,取单因素分析结果中有显著差异因素作为自变量,变量与赋值见下表4;Hb、hepcidin为预后独立保护因素(P<0.05),GDF15为预后独立危险因素(P<0.05),见表5。
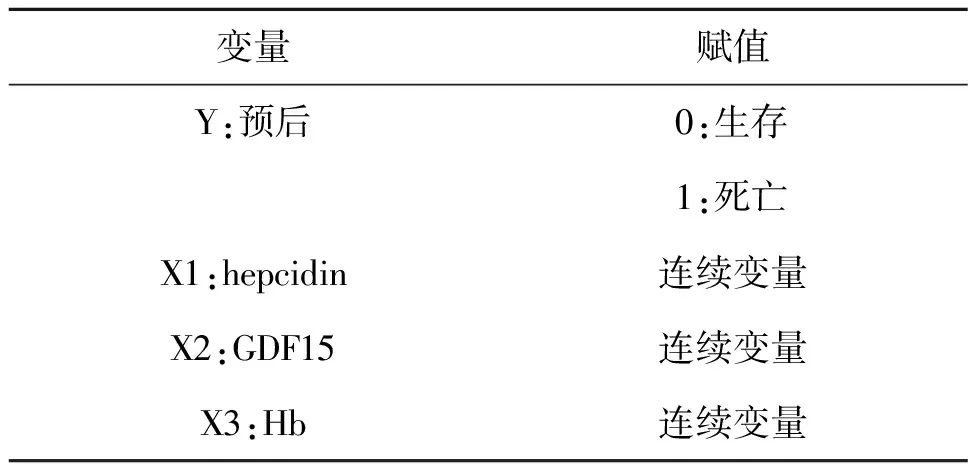
表4 变量与赋值
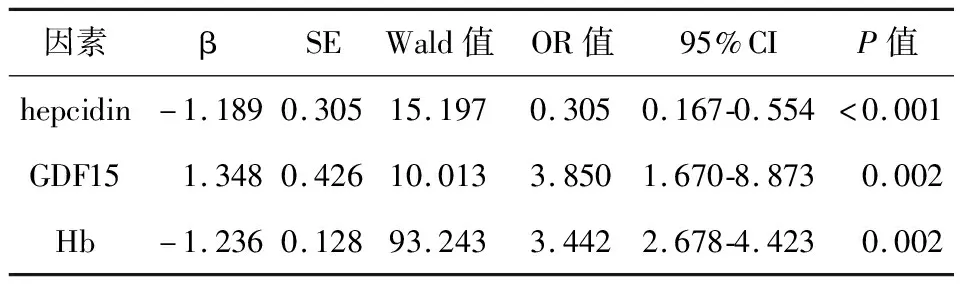
表5 Logistic回归分析
3 讨论
hepcidin能够靶向作用于人体内膜铁转运蛋白,从而负性调节铁水平,因此被称为铁调素[8]。有报道称,hepcidin结合相应膜铁转运蛋白之后,一方面导致铁通道关闭,从而影响十二指肠吸取铁原素,另一方面,可减少单核巨噬细胞铁原素释放量,最终降低血清铁水平[9]。以往有研究表明,相较于健康人群,β-地中海贫血症患者hepcidin水平更低,且重型地贫患者稍低于中间型[10]。本研究中,轻型组、重型组与中间型组血清hepcidin水平较对照组明显降低,且不同分型组间比较无显著差异,与上述研究结论基本一致。说明β-地中海贫血症患者血清hepcidin水平呈异常降低趋势。hepcidin表达水平影响因素众多,比如铁缺乏、“红系”细胞增多、感染、缺氧以及贫血等,均能对hepcidin的表达产生抑制作用,使得血清铁水平升髙[11]。
以往研究表明,GDF15可作为多种病变的有效生物标志物,包括多种肿瘤、心血管疾病、类风湿关节炎、糖尿病以及慢性肾脏病等[12]。人体处于正常生理状态时,各器官中GDF15呈现为低表达[13]。有报道称,GDF15表达水平升高与GDF15介导的相应信号通路活化有关,亦有可能对铁调素产生抑制作用,由此提高无效造血以及铁吸收过量所致多种疾病发生机率[14]。亦有研究表明,GDF15基因可能属于可调控基因,相关因素(比如肿瘤、急性损伤或者炎症等)能够诱导其表达[15]。有报道称,无效造血增加所致疾病中,GDF15水平明显升高,可见于白血病前期综合征与地中海贫血等[16]。本研究显示,GDF15水平为:重型组>中间型组>轻型组>对照组,组间差异显著,与上述报道基本一致,进一步证实了β-地中海贫血症患者存在血清GDF15异常升高变化,且重型患者升高程度最大。地中海贫血症产生机制主要为珠蛋白合成障碍使得α与非α珠蛋白动态平衡失调,其中α珠蛋白增加,β珠蛋白大量聚集于红系细胞膜表面,引起细胞膜氧化损伤,同时对骨髓造成损害,形成恶性循环(未成熟“红系”细胞髓内调亡-大量无效红细胞产生-贫血)。有研究指出,生理浓度GDF15能够适当促进hepcidin合成与分泌,但过高浓度GDF15能够对hepcidin表达产生明显抑制作用,引起铁过载[17]。在无效红系生成过程中,原红细胞调亡可以对GDF15表达产生诱导作用,使其表达水平升高,有效抑制铁调素,加快肠道铁吸收,并使巨噬细胞释放更多铁,造成铁过载。本研究经Logistic分析发现,Hb、Hepcidin属于患者预后保护因素,而GDF15则为预后危险因素,表明Hb、Hepcidin水平越低,GDF15水平越高,β-地中海贫血症患者死亡风险越大。应对地贫患者血清Hepcidin及GDF15水平予以重视,根据其检测结果及时采取针对性治疗措施,有助于改善患者预后。
综上,β-地中海贫血症患者血清hepcidin与GDF15表达水平分别呈异常降低、异常升高趋势,均属于患者预后独立影响因素,在指导临床治疗与预后评估方面具有重要价值。本研究具有样本量较少的局限性,且为单中心研究,有待后续大样本及多中心研究进一步补充、完善与论证。
