高产β-甘露聚糖酶黑曲霉菌株的分离与鉴定
2022-06-23王佰涛刘德海陈晓飞刁文涛李珊珊
王佰涛,刘德海 *,陈晓飞,刁文涛,李珊珊,雷 高
(1.河南省科学院生物研究所有限责任公司,河南 郑州 450008;2.河南省微生物工程重点实验室,河南 郑州 450008)
β-甘露聚糖酶属于糖苷水解酶(glycoside hydrolases,GH)家族,能够水解甘露聚糖中的β-1,4-D-吡喃糖苷键,降解甘露聚糖等多聚糖为具有2~10个单糖单位的寡糖组成的产物[1],其广泛应用于食品、饲料、造纸及制药等行业,尤其在食品、饲料领域应用前景广阔[2-3],食品方面:β-甘露聚糖酶作为特殊的酶应用于果汁加工过程中降低果汁的粘度、提高果汁的澄清度[4];在面团中添加经β-甘露聚糖酶处理15 min的2.0%魔芋葡苷聚糖,能够显著抑制二硫键的断裂,防止面团水分的散失,维持面团的拉伸能力[5];用于生产功能性低聚糖甘露寡糖(manno-oligosaccharides,MOS)[6-7],甘露寡糖有很好的生物调节功能,能够有效降低人体胆固醇水平,减轻便秘,降低血糖,是良好的食品添加剂[8];用于降解瓜尔豆胶(guar gum,GG)生产功能性可溶性膳食纤维半乳甘露聚糖(partially hydrolysed guar gum,PHGG)[9]等,能起到较好的增香效果。饲料方面:β-甘露聚糖酶作为第三代饲料酶成为研究的热点[10],作为半纤维素酶类的一种,其可降解饲料豆粕中β-甘露聚糖抗营养因子,降低肠道黏度,提高豆粕中营养物质消耗率,提高猪的生长性能[11-12]。
β-甘露聚糖酶广泛存在于植物[13]、动物和微生物中[14],微生物来源的β-甘露聚糖酶具有活力高、成本低、来源稳定、提取方便等优点[15],是最主要的来源,如细菌中的枯草芽孢杆菌(Bacillus subtilis)[16]、尼氏芽孢杆菌(Bacillus nealsonii)[17]、地衣芽孢杆菌(Bacillus licheniformis)[18]、乳酸菌[19];真菌中的曲霉菌(Aspergillussp.)[20]、青霉菌(Penicilliumsp.)[21]等,其中黑曲霉(Aspergillus niger)不产生毒素,是公认的安全菌株(generally recognized as safe,GRAS)[22-23],为β-甘露聚糖酶在食品及饲料领域应用提供了安全保障。
目前,仅通过外观形态、生理生化分析及单一基因序列分析对产β-甘露聚糖酶的菌株进行筛选、鉴定会引起判断误差,因此,通过多个基因序列联合鉴定方法较为科学合理[24]。本研究从河南南阳西峡县西坪镇后塘沟村魔芋种植土壤中分离、筛选高产β-甘露聚糖酶的菌株,并结合菌落形态观察、内转录间隔区(internal transcribed space,ITS)基因序列分析及β-微管蛋白(β-tubulin)基因BenA序列分析对筛选菌株进行鉴定[24-25],旨在为相关菌株的鉴定及生产应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
土壤样品:河南南阳西峡县西坪镇后塘沟村魔芋种植地。
1.1.2 主要试剂
2×ExTaqMaster Mix(Dye):北京康为世纪生物科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)真菌通用引物ITS1、ITS4,BGI D2000 plus脱氧核糖核酸(DNA)Ladder:北京六合华大基因科技股份有限公司;真菌基因组DNA提取试剂盒、魔芋胶、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、硫酸链霉素(纯度650~850 mcg/mg):北京索莱宝生物科技有限公司;甘露聚糖(纯度>99%):美国Sigma公司;D-甘露糖(纯度99%):上海麦克林生化科技有限公司;本研究所用试剂均为分析纯或生化试剂。
1.1.3 培养基
保藏培养基采用察氏酵母膏琼脂培养基(Czapek yeast exatract agar,CYA)[26]:硝酸钠3.0 g,磷酸二氢钾1.0 g,氯化钾0.5 g,七水硫酸镁0.5 g,酵母膏5.0 g,蔗糖30.0 g,琼脂15.0 g,蒸馏水1 000 mL。121 ℃高压蒸汽灭菌20 min。
富集培养基[27]:魔芋胶5.0 g,蛋白胨10.0 g,KH2PO41.0 g,MgSO4·7H2O 1.0 g,蒸馏水1 000 mL,pH7.0。121 ℃高压蒸汽灭菌20 min后加入100 μg/mL链霉素。
分离培养基采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[28]:取洗净去皮的马铃薯200 g,切成片状或丝状,加蒸馏水1 000 mL,煮沸15 min,用纱布过滤,加20 g琼脂、20 g葡萄糖,再加热使其溶化,补蒸馏水至体积为1 000 mL。121 ℃高压蒸汽灭菌20 min。
产酶培养基[29]:魔芋胶1.0 g,麸皮2.0 g,玉米面1.0 g,K2HPO40.3 g,MgSO4·7H2O 0.3 g,CaCl20.2 g,蒸馏水100 mL,pH6.0,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
QYC-2102C全温培养摇床:上海福玛实验设备有限公司;ME204E电子天平、FE28型实验室pH计:瑞士Mettler toledo公司;DRP-9052型电热恒温培养箱:上海森信实验仪器有限公司;K-8D电热恒温水槽:上海精宏实验设备有限公司;Varisokan Flash多功能酶标仪:美国赛默飞世尔科技公司;TGL-16B离心机:上海安亭科学仪器厂;DYY-6C电泳仪:北京六一生物科技有限公司;SW-CT-ICU超净工作台:上海博讯实业有限公司;Biometra TGRADIENT PCR仪:德国Waterman公司;QYC-Axio Image M2 全自动正置荧光显微镜:德国Zeiss公司。
1.3 实验方法
1.3.1 产β-甘露聚糖酶菌株的分离及筛选
分离:多点取样四分法处理后,无菌操作条件下称取土壤样品5.0 g于250 mL三角瓶中,加入100 mL灭菌蒸馏水,振荡混匀10~15 min,然后取2.0 mL土壤悬浊液加入到100 mL富集培养基中,30 ℃、180 r/min条件下培养1 d。按10倍梯度将富集培养液分别稀释到10-3、10-4、10-5,取稀释度为10-3、10-4和10-5的稀释液0.1 mL分别涂布于分离培养基平板上,每个稀释梯度设置3个平行,于30 ℃条件下培养3~5 d,挑取长势较好的真菌菌落采用平板涂布稀释法重复以上操作,直至平板上出现单菌落,转接入固体斜面保藏培养基,30 ℃条件下培养3 d,4 ℃保藏备用。
筛选:将分离纯化后所得的真菌菌株接种于发酵培养基,每个菌株作3个平行,于30 ℃、180 r/min条件下培养40 h,测定β-甘露聚糖酶酶活力,筛选产β-甘露聚糖酶酶活力较高的菌株。
1.3.2 高产β-甘露聚糖酶菌株的形态学观察
将筛选得到的高产β-甘露聚糖酶菌株点接种于察氏酵母膏琼脂培养基(CYA),于30 ℃条件下培养7 d获得单菌落,测量菌落直径,观察其菌落形态,颜色质地,有无色素产生,并利用显微镜进行显微特征观察,显微镜下观察孢子的形状、大小、颜色和孢子梗的形态特征等。
1.3.3 高产β-甘露聚糖酶菌株的分子生物学鉴定
ITS基因序列的PCR扩增:采用真菌基因组DNA提取试剂盒提取菌株HKS016的基因组DNA。以其为模板,采用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对菌株的ITS基因序列进行PCR扩增。PCR扩增体系:2×ExTaqMaster Mix 25 μL,ITS1 1 μL,ITS4 1 μL,基因组DNA 1 μL,双蒸水(ddH2O)22 μL。PCR扩增条件:94 ℃预变性4 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s,共30个循环;最后72 ℃末端延伸10 min。
BenA基因的PCR扩增参照文献[30-31]。
PCR扩增产物经1%琼脂糖凝胶电泳检测出现明显电泳条带后,委托华大基因科技股份有限公司进行测序。将ITS及BenA测序结果分别提交到美国国立生物技术中心(national center for biotechnology information,NCBI)的GenBank数据库,采用基本局部比对搜索工具(basic local alignment search tool,BALST)进行同源性搜索,然后选择同源性较高的模式菌株的基因序列进行多序列同源性比对后,利用MEGAX软件中的邻接法(neighbor joining,NJ)构建系统发育树。
1.3.4β-甘露聚糖酶活力的测定方法[32]
按照国标GB/T 36861—2018《饲料添加剂β-甘露聚糖酶活力的测定分光光度法》进行测定。
酶活力定义:在37 ℃、pH为5.5的条件下,每分钟从质量浓度为3 mg/mL的甘露聚糖溶液中释放1 μmol还原糖所需要的酶量为一个β-甘露聚糖酶活力单位(U)。
2 结果与分析
2.1 产β-甘露聚糖酶菌株的分离及筛选结果
经过富集培养、分离纯化后分离得到5株真菌菌株,再经复筛筛选得到1株高产β-甘露聚糖酶的菌株,β-甘露聚糖酶活力达到2.67 U/mL,对该菌株经多次传代及发酵产β-甘露聚糖酶酶活力分析,发现该菌株具有较好的遗传稳定性,将该菌株命名为HKS016,并保藏于中国普通微生物学菌种保藏中心(China general microbiological culture collection center,CGMCC),保藏编号为CGMCC No.22413。
2.2 菌株HKS016的形态特征
菌株HKS016在CYA培养基上培养后的菌落及细胞形态见图1。
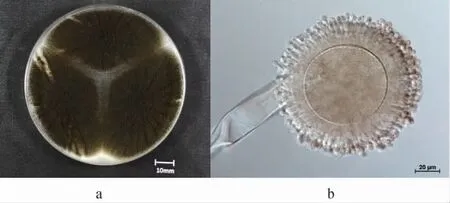
图1 菌株HKS016的菌落(a)及细胞(b)形态Fig. 1 Colony (a) and cell (b) morphology of strain HKS016
由图1a可知,菌株HKS016的菌落直径为64~67 mm,呈黑褐色,具有放射状皱纹,质地丝绒状,反面浅黄色,无渗出液产生,无可溶性色素产生。由图1b可知,菌株HKS016的分生孢子梗发生于基质,孢梗茎壁平滑透明,直径为7~18 μm;分生孢子头球形,直径为60~160 μm;顶囊近球形,直径为45~75 μm;产孢结构双层,梗基(6~13)×(2.5~3.5)μm,瓶梗(7~15)×(1.5~3.0)μm;分生孢子近球形,直径为2.5~4.5 μm,表面粗糙。结合菌落及孢子形态,根据《真菌鉴定手册》[33]及相关文献报道[34],初步将菌株HKS016鉴定为黑曲霉(Aspergillussp.)。
2.3 菌株HKS016的分子生物学鉴定
2.3.1 菌株HKS016 ITS基因序列的分析
菌株HKS016的ITS基因的PCR扩增产物委托华大基因科技股份有限公司进行测序,测序结果显示其ITS基因序列的碱基长度为562 bp,ITS基因序列的比对结果见表1。
由表1可知,菌株HKS016的ITS基因序列与模式菌株黑曲霉(Aspergillus niger)KACC45072T(登录号JX500090)、百岁兰曲霉(Aspergillus welwitschiae)CBS139.54T(登录号NR137513)均具有100%的相似性。采用同源性较高的模式菌株的ITS基因序列构建系统发育树,结果见图2。

表1 菌株HKS016 ITS基因序列的分析结果Table 1 Analysis results of ITS gene sequence of strain HKS016
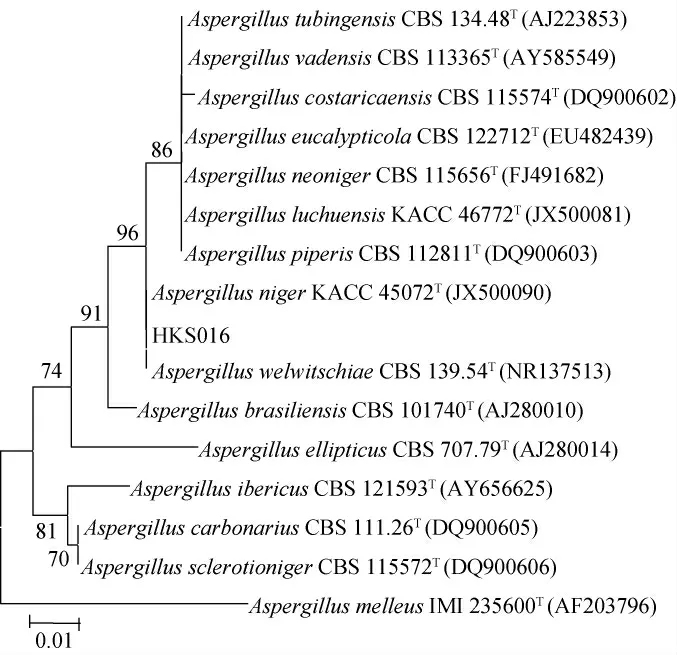
图2 基于ITS基因序列菌株HKS016的系统发育树Fig. 2 Phylogenetic tree of strain HKS016 based on ITS gene sequence
由图2可知,菌株HKS016与模式菌株Aspergillus nigerKACC45072T(登录号JX500090)和Aspergillus welwitschiaeCBS139.54T(登录号NR137513)在同一分支上。由表1及图2可知,相似性98%以上的模式菌株均属于曲霉属(Aspergillussp.)、系统发育树中与曲霉属聚于一支,初步将菌株HKS016鉴定为曲霉属(Aspergillussp.)中的一种。
2.3.2 菌株HKS016BenA基因序列的分析
现在多位科研工作者运用ITS测序的方法从分子水平对曲霉菌进行菌种鉴定,也发现ITS序列仅能将大多数曲霉鉴定到属水平,不能对曲霉属的物种进行有效区分,因此,需要利用曲霉的β-微管蛋白(β-tubulin)基因Ben进行曲霉种水平的鉴定[25,30],菌株HKS016的BenA基因的PCR扩增产物委托华大基因科技股份有限公司进行测序,测序结果显示其BenA基因序列的碱基长度为502 bp,BenA基因序列的比对结果见表2。
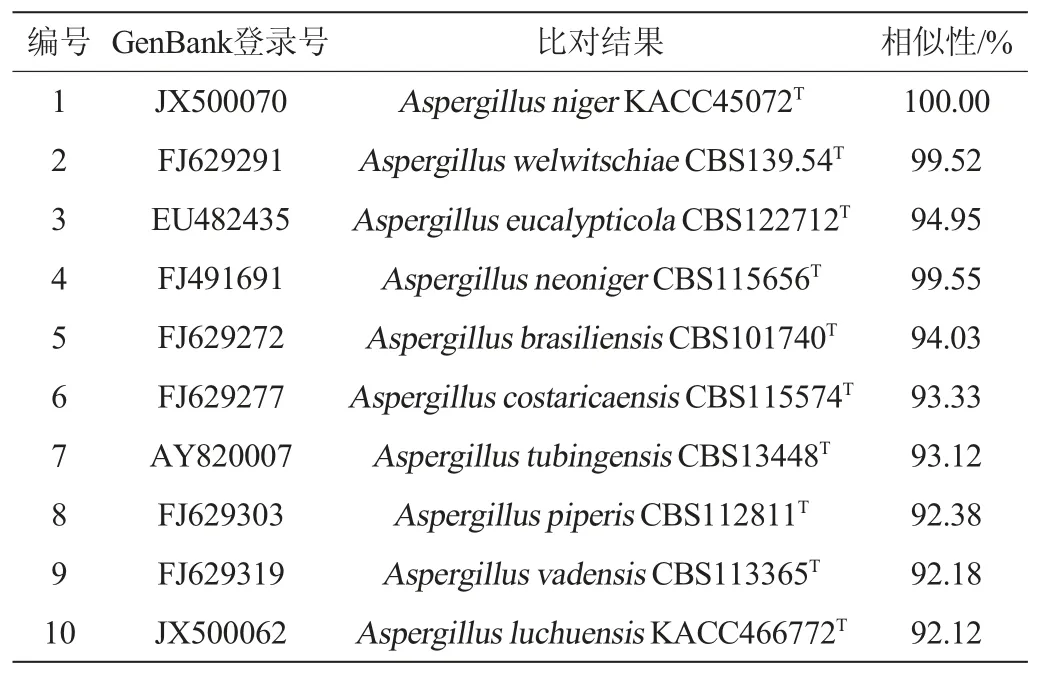
表2 菌株HKS016 BenA基因序列的分析结果Table 2 Analysis results of BenA gene sequence of strain HKS016
由表2可知,菌株HKS016的BenA基因序列与模式菌株Aspergillus nigerKACC45072T(登录号JX500070)具有100%相似性,与模式菌株Aspergillus welwitschiaeCBS139.54T(登录号FJ629291)具有99.52%的相似性。采用同源性较高的模式菌株的BenA基因序列构建系统发育树,结果见图3。
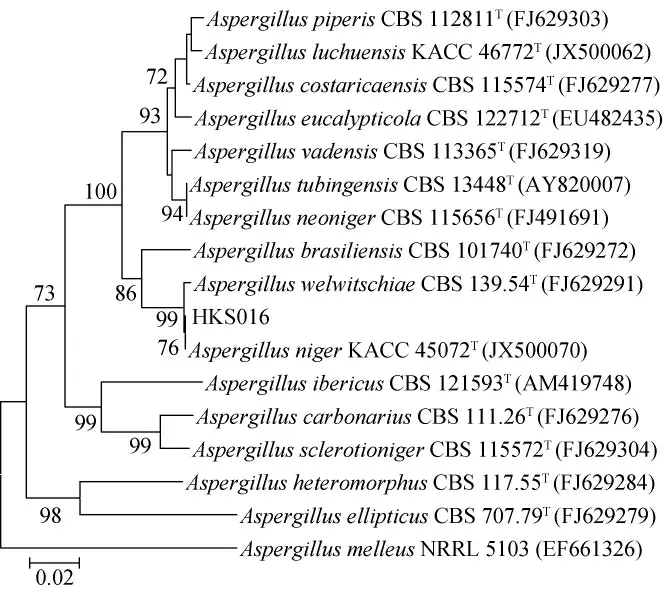
图3 基于BenA基因序列菌株HKS016的系统发育树Fig. 3 Phylogenetic tree of strain HKS016 based on BenA gene sequence
由图3可知,菌株HKS016与模式菌株Aspergillus nigerKACC45072T(登录号JX500070)和Aspergillus welwitschiaeCBS139.54T(登录号FJ629291)在同一分支上,可以将菌株HKS016鉴定为黑曲霉(Aspergillus niger)。
依据菌株HKS016分子生物学ITS序列、β-微管蛋白(β-tubulin)基因的比对分析,结合菌落形态、孢子形态观察,将菌株HKS016鉴定为黑曲霉菌(Aspergillus niger)。
3 结论
本研究以河南南阳魔芋种植土壤为试验材料,通过富集培养、测定产β-甘露聚糖酶酶活力,筛选出一株能高效生产β-甘露聚糖酶的菌株HKS016,其β-甘露聚糖酶酶活力为2.67 U/mL。经形态观察、ITS基因和β-微管蛋白基因BenA序列分析,将该菌株鉴定为黑曲霉菌(Aspergillus niger),保藏于中国普通微生物学菌种保藏中心(CGMCC),保藏编号为CGMCC No.22413。
