重组人Dickkopf相关蛋白3在弥漫性大B细胞淋巴瘤患者中的表达及其临床意义
2022-06-23许京淑徐奔向国强向航
许京淑,徐奔,向国强,向航
(恩施土家族苗族自治州中心医院血液病科,湖北 恩施 445000)
临床上约30%的霍奇金淋巴瘤淋巴瘤为弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)[1]。DLBCL患者临床表现特异性小,确诊时多为中晚期,严重影响治疗效果[2]。目前DLBCL主要通过影像学检查与病理学联合诊断,但以上技术在判定患者预后方面具有一定局限性。DLBCL患者免疫表型、病理学等特征差异较大,表现为高度异质性,进一步增加了治疗的难度[3]。有学者认为DLBCL临床治愈率较低、预后差,与其缺乏特异性的标志物密切相关[4]。近年来癌症筛查技术取得了长足发展,其中在乳腺癌、胃癌及结肠癌等肿瘤中发挥重要作用的Wnt信号通路的抑癌因子分泌型蛋白Dickkopf相关蛋白3(Dickkopf-associated protein 3,DKK3)引人关注[5]。在癌细胞中,DKK3基因可调控c-myc以及细胞周期蛋白D1等靶基因,进一步阻滞下游信号通路Wnt而抑制肿瘤侵袭、转移[6]。研究发现,DKK3低表达是胃癌、乳腺癌等不利的预后因素,因此,鉴定肿瘤组织的DKK3表达水平对判定肿瘤预后可能有一定帮助,而DKK3对DLBCL预后的影响尚缺乏研究依据[7]。本研究主要探讨DKK3蛋白水平在DLBCL患者中的变化及其与预后的关系。
1 资料与方法
1.1一般资料 纳入2017年12月至2019年12月恩施土家族苗族自治州中心医院收治的56例DLBCL患者,将术中切除的DLBCL组织与癌旁组织作为检测标本。纳入标准:①经病理确诊为DLBCL且符合《恶性淋巴瘤诊断治疗学》[8]分类标准;②年龄≥18岁;③临床资料完整;④进行R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱、泼尼松)方案或R-CHOEP(依托泊苷联合R-CHOP)方案或多柔比星、长春新碱等化疗;⑤生存期预计≥3个月。排除标准:①合并免疫系统疾病、肝肾功能重度异常者;②继发其他肿瘤;③DLBCL复发者;④失访者;⑤原发中枢神经系统的DLBCL;⑥精神疾病史及认知障碍者。其中男30例、女26例,年龄29~72岁,平均(53±7)岁;Ann Arbor分期:Ⅰ期9例,Ⅱ期19例,Ⅲ期17例,Ⅳ期11例;疾病类型:生发中心型42例,非生发中心型14例。本研究获得恩施土家族苗族自治州中心医院医学伦理委员会批准,患者或家属均签署了知情同意书。
1.2方法
1.2.1免疫组织化学法检测DKK3蛋白表达 制作组织微阵列蜡块后切成厚度约4 μm的组织切片,常规脱蜡水化后,用磷酸盐缓冲液冲洗3次,浸入0.01 mol/L的枸橼酸盐缓冲液,抗原修复后加入3% H2O2室温孵育10 min,室温下羊血清孵育1 h,加浓度为1∶80的一抗DKK3(北京新力生物科技公司生产,批号:ab35847)抗体于4 ℃过夜;次日取出用磷酸盐缓冲液冲洗,加入二抗工作液,37 ℃孵育15 min,磷酸盐缓冲液冲洗3次,滴加以辣根过氧化物酶标记的工作液,37 ℃孵育15 min,磷酸盐缓冲液冲洗3次,采用二氨基联苯氨显色,纯水终止反应,苏木精复染,返蓝、中性树胶封片[9]。
1.2.2染色结果判定标准 随机挑选并观察光学显微镜下每张切片的3个高倍视野,采用半定量的方法进行结果判定。着色细胞比例评分:0%为0分,1%~10%为1分,11%~50%为2分,>50%为3分;染色强度评分:阴性为0分,淡黄色为1分,棕黄褐色为2分[10]。总评分=着色细胞比例评分×染色强度评分,总评分≥4分判定为阳性,<4分判定为阴性。
1.3随访及预后评价标准 行门诊或电话随访,随访截至2020年12月31日。根据世界卫生组织制订的疗效标准[11]评价术后1年患者的临床疗效。完全缓解:病灶彻底消失;部分缓解:病灶最大直径减少≥50%,稳定≥1个月;无缓解:病灶未变化或缓解不明显。总有效率=(完全缓解例数+部分缓解例数)/总例数×100%。在随访结束时统计分析中位无进展生存期。
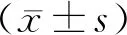
2 结 果
2.1DKK3在DLBCL组织和癌旁组织中的表达 免疫组织化学检测结果显示,DLBCL组织中DKK3蛋白阳性表达率明显低于癌旁组织[42.86%(24/56)比83.93%(47/56)](χ2=7.782,P<0.001),见图1。

注:DLBCL为弥漫性大B细胞淋巴瘤,DKK3为Dickkopf相关蛋白3
2.2DLBCL患者DKK3蛋白表达与临床特征的关系 不同性别、年龄、累及部位、乳酸脱氢酶水平、疾病类型以及有无B症状的DKK3阳性表达率比较差异无统计学意义(P>0.05),但临床分期Ⅰ~Ⅱ期的DKK3阳性表达率高于Ⅲ~Ⅳ期,国际预后指数评分0~2分的DKK3阳性表达率高于3~4分(P<0.05)。见表1。

表1 DLBCL患者DKK3蛋白表达与临床特征的关系
2.3DKK3蛋白表达与DLBCL患者预后的关系 术后1年DKK3阳性表达的DLBCL患者的总有效率明显高于DKK3阴性表达患者[79.17%(19/24)比53.13%(17/32)](χ2=4.051,P=0.044),DKK3阳性表达的临床疗效优于DKK3阴性表达患者(Z=2.127,P=0.014),见表2。至随访结束,DKK3阳性表达的DLBCL患者中位无进展生存期长于DKK3阴性表达患者[(36±6)个月比(22±4)个月](t=9.775,P<0.001)。

表2 DKK3蛋白表达与DLBCL患者预后的关系 (例)
3 讨 论
DLBCL是临床常见的淋巴瘤类型之一,目前治疗主要以化疗为主[12]。60%~70%的DLBCL患者使用利妥昔单抗、阿霉素、环磷酰胺、长春新碱和泼尼松等方案可达到较好的治疗效果[13]。而部分患者在发病早期即出现远处转移,近50%的患者治疗后期出现复发,但具体发病机制目前尚不清楚,可能原发于小淋巴细胞淋巴瘤、滤泡性淋巴瘤等,也可从淋巴结外组织等发展而来[14-15]。研究发现,DLBCL患者化疗敏感性、预后与免疫组织分型、细胞学及病理学等密切相关[16]。因此,探讨DLBCL发生发展的分子机制及相关蛋白、基因等生物学特征,对进一步提高DLBCL的早期诊断率和改善患者预后尤为必要[17]。
目前,临床主要通过B超、磁共振成像及CT等影像学技术对DLBCL进行早期诊断,该类技术虽然定位准确但定性难度大。基因标志物被认为是一种无创性辅助诊断方法,目前DLBCL仍缺乏特异性检测指标。此外,影响DLBCL预后的因素较多,同时DLBCL在临床上有多种分子分型,考虑患者的分子分型与基因异常存在部分重合,任意单一因素变化均可能造成较大影响,提示DLBCL的调控基因复杂且具有显著异质性[18]。因此,在庞杂的调控基因中准确找到对DLBCL患者诊断与预后有临床意义的标志物是当前急需解决的问题。
Wnt信号转导通路可介导调控多种恶性肿瘤的增殖分化过程,其高度活化时可积聚胞质内下游蛋白(β联蛋白),使下游蛋白进入细胞核触发原癌基因转录翻译机制,导致肿瘤细胞异常增殖分化[19]。随着近年来临床筛查肿瘤标志物工作的陆续开展,发现潜在肿瘤标志物DKK3具有较好的应用前景,现研究证明其在胃癌、肠癌及输卵管癌中可作为潜在治疗新靶点[20-21]。DKK3基因是经典Wnt信号转导通路的重要负性调控因子,是一种肿瘤抑制因子,在多种癌症中低表达,在肿瘤增殖分化中起关键作用[22]。DKK3基因高表达可调控c-myc以及细胞周期蛋白D1等靶基因,从而下调下游信号通路Wnt发挥抑制肿瘤侵袭转移的作用[23]。此外,有研究发现过表达DKK3可通过介导血管内皮生长因子受体2抑制肿瘤血管生成[24]。目前研究发现在多种肿瘤细胞中DKK3基因处于低表达状态,值得注意的是DKK3基因表达缺失的直接原因为该基因启动子区的高甲基化,在胃癌组织中肿瘤细胞主要通过高甲基化或启动子甲基化沉默DKK3基因[25]。当前异常的启动子甲基化已在生殖系统及消化系统肿瘤DKK3基因中发现,其直接影响患者肿瘤恶性程度及预后,提示DKK3基因可作为肿瘤患者病情判定及评估预后的潜在标志物[26]。目前,有关DKK3基因与DLBCL的相关性研究较少。有研究报道,DKK3蛋白表达水平与卵巢癌患者总生存率呈正相关,且DKK3蛋白表达水平与患者的分期、淋巴转移、浸润程度密切相关[27]。
本研究结果显示,DLBCL组织DKK3阳性率低于癌旁组织(P<0.01),DLBCL患者DKK3蛋白表达与临床分期和国际预后指数评分之间存在关联(P<0.05),但与性别、年龄、累及部位及乳酸脱氢酶水平不存在显著性关联(P>0.05)。Dellinger等[28]研究认为,DKK3启动子中的甲基化标志着子宫内膜癌预后不良,提示DKK3高表达可能抑制肿瘤组织细胞的分化、增殖及浸润过程。本研究结果为DKK3蛋白表达水平与其他肿瘤发生发展存在相关性提供了支持。本研究结果同时提示DKK3蛋白阳性表达患者的总有效率高于DKK3蛋白阴性表达(P<0.05),无进展生存期明显长于DKK3蛋白阴性表达者(P<0.01),提示DLBCL患者预后与DKK3表达情况存在关联,表明DKK3阳性患者术后生存期更长,提示其作为抑癌基因对DLBCL患者预后产生积极影响。以上证据表明,DKK3基因过表达在诊断DLBCL中的潜在价值,DKK3表达增强可能是DLBCL发生发展的重要因素之一。未来对DKK3蛋白不同活化程度的DLBCL患者可采取不同的治疗方式,同时做到积极随访及密切监测以改善患者预后。
综上所述,在部分DLBCL患者组织中DKK3阳性表达,且其阳性表达率与患者临床分期及国际预后指数评分相关,DKK3蛋白阴性表达预示着预后较差,其有望成为DLBCL临床诊断、治疗及判断预后的新指标。
