门静脉高压性肠病
——一种不该忽视的门静脉高压并发症
2022-06-23李姗姗杨长青
李姗姗, 杨长青
同济大学附属同济医院 消化科, 同济大学医学院消化疾病研究所, 上海 200065
引起门静脉高压最主要的因素是明显增加的肝内血管阻力(intrahepatic vascular resistance,IHVR)和门静脉血流量,其升高的机制可大致归纳为两方面:(1)肝脏内部结构的明显变化(即形成IHVR的结构成分);(2)肝内血管张力的病理性增加(即IHVR的动力成分)[1]。门静脉高压可影响整个消化道,从而造成血流动力学改变,并在其微循环失调、血管收缩剂和血管扩张剂平衡打破的基础上,建立了一个氧自由基、一氧化氮、TNFα、内皮素-1、前列腺素等过量和/或其他引起细胞损伤的多发因素的环境,导致消化道黏膜损伤,从而出现一系列黏膜改变及病理异常,最终形成门静脉高压性胃肠病[2-3]。门静脉高压性肠病(portal hypertensive enteropathy,PHE)虽与门静脉高压性胃病(portal hypertensive gastroenteropathy,PHG)类似,但由于其内镜下表现多种多样且缺乏特异性,诊断标准并未统一,个体差异性大,各地专家共识同中存异,且近些年对其的相关研究所甄选的患者个体差异亦较大,外加部分患者病变位于小肠,由于患者本身及当地医疗条件限制或患者本身患有严重食管静脉曲张,使得胶囊内镜或小肠镜检查无法开展而致确诊率受限,因此,PHE的发病率在不同国家及我国不同地区报道不一。虽同样有出血风险,尤其可能是部分肝硬化伴门静脉高压患者慢性隐形失血及贫血或营养不良的主要原因,但临床上相较于食管胃静脉曲张和PHG,PHE仍容易被忽视,影响患者预后。
1 PHE的分类
PHE的前提是必须有门静脉高压的形成。按照解剖学部位的不同,将其分为门静脉高压性小肠病和门静脉高压性结肠病。前者可进一步分为门静脉高压性十二指肠病、门静脉高压性空肠病和门静脉高压性回肠病。按照病变特点可分为内镜下改变和病理学改变。本文将根据解剖学部位依次对各种类型PHE的内镜下改变及病理学改变进行阐述。
1.1 门静脉高压性小肠病
1989年,Thiruvengadam和Gostout[4]发现在肝硬化伴PHG的患者中,部分患者十二指肠和空肠可见樱桃红斑点样黏膜改变。在门静脉高压十二指肠病中,毛细血管扩张被认为是门静脉充血最主要的特征[5]。内镜下,红斑是最常见的表现,也可见圆形多发糜烂样病变,部分因在Kerckring皱襞上而呈环形或新月形。有的糜烂灶上可见凝血块,呈溃疡改变的病灶,其上可见血栓。马赛克征和绒毛扩张并不常见,此类通常出现在PHG中。
1.1.1 门静脉高压性十二指肠病 十二指肠病变主要以类型多变、分布不均、形态不均、常以两种或两种以上混合病变出现为特点,不只是患者之间,同一个患者也可同时存在多种病变。这些表现反映了局部黏膜微循环改变的多变性。值得一提的是,在门静脉高压患者内镜检查下,正常的小肠黏膜外观并不意味着在血流动力学上没有受到门静脉高压的影响,这或许也是各地发病率差异较大的原因,毕竟不是所有患者适宜在十二指肠处取病理组织,单凭借内镜来诊断此病存在一定的主观因素。
有学者认为,伴有严重PHG的患者其门静脉高压十二指肠病发生率更高;也有观点认为,肝功能障碍的严重程度与十二指肠病变范围有关,与其表现和类型无关;另有学者认为,十二指肠的病变发生率与肝功能障碍的恶化有关,但上述结论存有争议[6-8]。或许门静脉高压性十二指肠病发展的决定因素不是门静脉高压本身,而是由于高压开始产生充血改变的“扳机点”。这个“扳机点”可能因人而异,且随着每个患者整体侧支循环特点的不同而不同。一旦这个“扳机点”被触发,充血状态将使胃病变加重,进而因充血导致的病变分布将更加广泛,进一步影响小肠部分[5]。
1.1.2 门静脉高压性空肠回肠病 门静脉高压性空肠回肠病的不同病损表现的发病机制仍缺乏令人信服的理论支持。目前,根据动物模型机制实验[9],考虑门静脉高压导致静脉充血,使小肠黏膜层低氧缺血,从而使动静脉分流和小肠血流再分布;而肠壁通透性增加、细菌移位、过量的肥大细胞介导的炎症应答,以及杯状细胞增生致使上皮细胞异常重塑,黏膜下层血管增生,共同导致了门静脉高压性空肠回肠病的内镜和病理表现。
内镜下表现主要分为血管相关与非血管相关病变(或炎症性改变)。前者包括血管发育不良、血管扩张和静脉曲张,后者包括炎症性病变、红斑、绒毛水肿、鲑鱼卵样改变、息肉样病变等(图1)。血管发育不良包括红色斑点、蜘蛛静脉,以及伴有扩张血管的淋巴滤泡。血管扩张又被分为分支状扩张血管和细线圈样血管,通常呈扁平状,轻度隆起,但不是特异性表现,在慢性肾衰竭、主动脉瓣狭窄及老年患者中也可见到。血管新生被认为是门静脉高压侧支循环发展的两个机制之一,是适应门静脉高压的同样重要的表现;而另一个机制则是之前存在的门静脉与系统循环之间的血管通路扩张开放。小肠静脉曲张类似于典型的食管胃静脉曲张,呈结节状,周围见马赛克征,伴或不伴浅蓝色改变。血管扩张、红斑和静脉曲张可能是门静脉高压性空肠回肠病临床出血相关最常见病因。息肉样肠病较少见,其内镜下特点为:可发生在小肠任意部位,呈凸起样,单发或多发,有蒂或无蒂,大小不等,类似息肉。其病理表现为固有层扩张扭曲的毛细血管。有报道[10]称,1例酒精性肝硬化合并糖尿病、慢性肾功能衰竭患者,其小肠表现为上百个红色息肉样病变,在行肝移植后上述病变消失。其他非特异性炎症样改变有绒毛水肿、颗粒样、鲑鱼卵样改变等。在末端回肠,绒毛相关改变的识别会变得困难,可能是因为此处绒毛较为细短所致[11]。
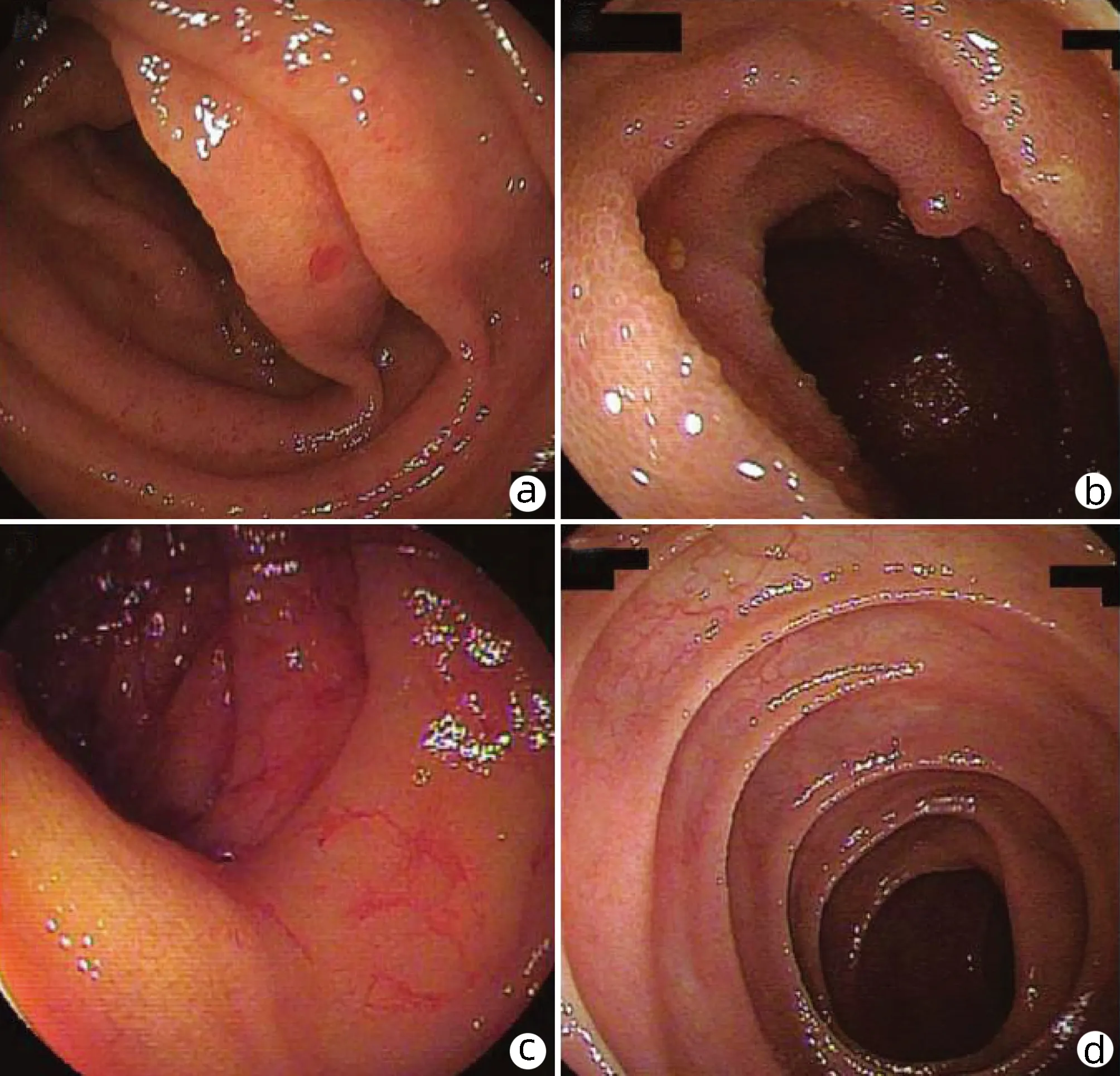
注:a,水肿;b,毛细血管扩张;c,鲑鱼卵样病变;d,正常对照[2]。
1.1.3 病理表现 门静脉高压性小肠病的病理表现可分为血管异常和非血管异常。血管异常包括黏膜毛细血管充血、血浆蛋白外溢、毛细血管生成扩张、增生、溃疡面毛细血管增生变密、血管壁增厚以及血管壁或周围组织均质红染物沉积,部分血管腔内血栓形成伴机化。非血管异常病变包括水肿、纤维增生、炎症、绒毛改变(即扩张、肿胀、变短、萎缩)、黏膜隐窝细胞核凋亡,隐窝扭曲,黏膜肌层增厚,纤维肌性增生、腺体萎缩,黏膜及黏膜下层可见增生扩张的淋巴管,绒毛/隐窝比率下降,CD34免疫组织染色确认毛细血管新血管形成[12]。有报道[5,12-15]显示,嗜酒患者的十二指肠黏膜纤维增殖和绒毛改变的发生率可能更高。
1.2 门静脉高压性结肠病 1991年,Kozarek等[16]在结肠中发现类似PHG的黏膜改变。内镜下表现主要包括黏膜非特异性炎症改变和血管相关病变。前者包括黏膜水肿、萎缩、红斑、轻度的黏膜易脆性及颗粒感,严重时可表现为急性结肠炎性改变伴黏膜自发性出血。后者包括樱桃红斑点、微血管扩张、蜘蛛痣样改变、血管发育不良样改变(图2)。结肠黏膜水肿、毛细血管扩张和充血以及毛细血管壁不规则增厚(包括小和大血管平均横截面积增加)、病理活检提示炎症(即固有层淋巴细胞和浆细胞增多)是门静脉高压性结肠病的典型表现,部分表现为急性和慢性的黏膜下炎症,类似于克罗恩病,因此病变缺乏特异性,各地确诊率差异较大[3,16]。
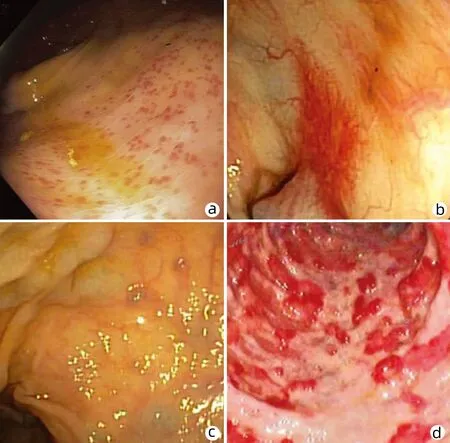
注:a,红斑[17];b,毛细血管扩张[18];c,水肿伴静脉曲张[18];d,息肉样病变伴出血[19]。
目前,门静脉高压性结肠病有两种分级方法,一种属于组织学范畴,一种属于内镜范畴。前者分为两期,早期:可见轻中度扩张、形态扭曲、壁薄、衬覆内皮细胞的静脉以及黏膜下层微静脉样改变;晚期:黏膜下静脉进一步扩张,黏膜层见扩张扭曲的微静脉及毛细血管[20]。后者分为3型:1型为平坦、羊齿状血管病变(蜘蛛样病变);2型为平坦或轻度隆起的红色病变(直径<10 mm)或樱桃红样病变;3型为轻度隆起的黏膜下层肿瘤样病变(伴中央发红凹陷)。也有研究者[21]将门静脉高压性结肠病分为3级:1级为结肠黏膜红斑;2级为结肠黏膜红斑伴马赛克征;3级为结肠血管病变(包括樱桃红斑、微血管扩张或血管发育不良样病变)。由于上述分级与患者临床表现、预后、治疗方案等未见明显关系,因此临床价值有限,目前尚无理想的分级系统对门静脉高压性结肠病黏膜异常严重程度进行有效分类。
门静脉高压性结肠病的异常黏膜很难恢复正常,外加患者多伴有凝血功能障碍,因此有出血倾向,但诱发显性出血的情况并不常见,精确的出血机制仍不清楚。一些研究报道了与门静脉高压性结肠病相关的某些临床特点,如血小板数量减少[22]、终末期肝病、胃静脉曲张以及更高的门静脉压力[3]。但其他研究并未发现门静脉高压性结肠病与肝功能障碍的严重度[23-24]、门静脉高压[25]或胃食管静脉曲张有相关性[3,24,26-27]。一些报道显示,既往有食管静脉曲张套扎或硬化治疗史的患者,门静脉高压性结肠病的发病率更高。Misra等[28-30]认为,结肠静脉曲张与门静脉高压性结肠病呈负相关,这可能与肛门直肠静脉曲张可以减缓结肠门静脉系统压力有关。因此,门静脉高压性结肠病在患有肛门直肠静脉曲张的患者中并不易见到。相反,门静脉高压性结肠病在没有肛门直肠静脉曲张的患者中发生频率更高。
2 临床表现
PHE与PHG类似,但其可在相当长的一段时间没有症状,大便潜血阳性、慢性失血是其最常见的临床表现,因此患者经常表现出缺铁性贫血。可有黑便,或急性出血而排鲜血,少见呕血,部分患者可因PHE致营养吸收功能受限,使PHE成为患者营养不良甚至发展为肝硬化代谢相关并发症的病因之一。肝硬化患者贫血的原因很多,临床医师易忽略患者贫血可能是因PHE所引起,致使患者贫血状态迁延不愈,影响预后。
3 鉴别诊断
3.1 门静脉高压性小肠病鉴别诊断 门静脉高压性小肠病镜下表现及病理变化缺乏特异性,在不确定患者是否患有门静脉高压时,诊断尤为困难。需要将其与炎症性肠病、乳糜泻、动静脉畸形、放射性肠病、家族遗传性毛细血管扩张症、家族性腺瘤息肉病相鉴别。取活检的时候要高度警惕,因血管病变可能有出血风险。结合CT与MRI,观察患者是否有侧支循环和腹水等对门静脉高压进行评估,借助瞬时弹性成像,对患者肝纤维化进行预测[31],辅助Child-Pugh评分[9],对患者肝功能进行计算,或许可成为预测肝硬化患者是否患有PHE的有效方法。有学者[32-33]建议将胶囊内镜应用于Child- Pugh C级、存在两处及以上食管静脉曲张、PHG及门静脉高压性结肠病的患者群体,以期在这部分人群中发现具有临床意义的小肠病变。
3.2 门静脉高压性结肠病鉴别诊断 门静脉高压性结肠病内镜下表现有时难以与退行性改变致结肠血管发育不良相鉴别。需要鉴别的还有其他出血的非炎症性或炎症性疾病,如缺血性肠病、放射性肠病、家族性遗传性毛细血管扩张症等,由于患者多伴有凝血功能异常、病理取样有出血的风险,此外病理活检采集时可能过浅,无法保证采集结果是否理想,病理结果不具备特异性,因此诊断上,病理并不是必须。门静脉高压所致的结肠改变还包括直肠静脉曲张、痔等。有报道[34]认为门静脉高压性结肠病的发病率随着肝疾病的严重而增加(即随Child-Pugh评分增加而增加)。终末期肝病模型(MELD)评分越高,直肠静脉曲张发病率就越频繁。部分研究[35]认为肝硬化下消化道出血主要是痔疮所致。
4 治疗
改善PHE首要考虑控制门静脉高压。对于慢性失血及缺铁性贫血患者,可给予补充铁剂、输血等对症治疗。目前还未有标准化指南提出预防PHE的措施。沙利度胺因其能抑制血管内皮生长因子,曾被用于治疗PHE。有报道[36]称,沙利度胺可使血红蛋白水平正常化,避免患者因贫血而反复输血。虽然在治疗后用胶囊内镜检查发现病变明显消退,但是临床数据有限,未来需扩大样本并评估治疗的安全性和理想的疗程。针对消化道出血患者,非选择性β受体阻滞剂、生长抑素在PHE中的作用也值得探索,一般认为,将静息心率控制在50~55次/min较为理想[3]。血管扩张样病变可借助内镜行氩离子凝固术治疗,有研究[9]显示此法用于肝硬化患者也是安全的。结肠静脉曲张病变也可用套扎、硬化治疗或氩离子凝固术,但临床相关数据有限,预防性治疗意义尚不明确。息肉样肠病可内镜治疗,但若无消化道出血症状,因患者可能存在凝血功能障碍、血小板减少等情况,因此预防性切除息肉仍需慎重考虑。其他治疗包括放射性介入治疗如经皮弹簧圈栓塞治疗,经颈静脉肝内门体分流术(TIPS)以及外科手术治疗如门体分流术、小肠切除等[37-39]。有学者[3]推荐利用评分系统对PHE进行分级,但如果分级与患者临床表现、预后及治疗方案无明显相关性,则分级对临床意义不大,因而很难在临床中推广。因此,PHE治疗需考虑患者基础条件、临床症状,选择适合的治疗手段并结合当地专家经验,量体裁衣,因人而异。
5 目前的困惑与挑战
(1)内镜下表现及病理结果缺乏特异性,诊断标准缺乏统一性[3]。
(2)因部分患者基础条件差,患有重度食管静脉曲张或凝血功能障碍,可能无法耐受经口小肠镜,而部分地区医疗条件有限,胶囊内镜无法普及,因此实际PHE的发病率应高于目前文献所报道的范围。
(3)临床症状隐晦,常被临床医生忽视,致使部分患者贫血原因长期无法明确,仅能依靠反复输血等保守治疗,致使患者生存质量下降,影响预后。
(4)由于尚无降低门静脉压的特效药物,又因临床数据不足,尚无系统治疗或预防PHE的指南共识[9,39]。
(5)食管曲张静脉硬化或套扎治疗后是否会诱发或加重PHE,仍有争议。
(6)PHE与肝硬化病因、门静脉高压严重程度、食管胃底静脉曲张、PHG、临床实验室结果、Child-Pugh评分等是否相关仍存有争议,PHE中各部位病变之间是否相关以及内镜下各类型病变之间是否相关仍需进一步探索[11]。
(7)有报道[2]认为内镜下鲑鱼卵样改变可能与血小板减少、脾大等有关,由于数据有限,其是否具有临床意义仍不明确。
(8)目前仍缺乏可普及的、具有临床意义的内镜下分级系统。
6 小结
PHE内镜下表现特异性不强,临床症状多较隐晦,常被临床医师所忽视,致使部分患者反复表现出消化道出血、缺铁性贫血及营养不良,影响患者预后,降低了患者生活质量,并可能是患者出现肝硬化代谢相关并发症的一大病因。临床医生应根据患者情况,结合CT和瞬时弹性成像来考虑胶囊内镜等检查的必要性,并结合患者临床表现、实验室结果及经治专家经验,合理拟定治疗方案,真正做到“衡量到整体,调理至细节”的临床理念。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:李姗姗负责文章撰写,查阅资料;杨长青负责对文章的知识性内容作批评性审阅,指导文章方向及最后定稿。
