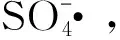钴基催化剂在高级氧化过程中的性能研究
2022-06-23王敬明
王敬明
(安徽理工大学 材料科学与工程学院,安徽 淮南 232001)
我国工业生产的飞速发展产生大量有机废水。在化工业方面,有接近10%~20%的有机污染物会随着废水排出[1-3],日常生活中也产生大量的有机污染废水,对环境造成极大的危害[4-6]。废水中的有机物吸光性强,会降低水体透明度,而且含有毒性,对人体和环境危害呈不可逆性。最新研究的高级氧化法(AOPs)可有效降解有机污染物或将其转化为小分子物质,从而减轻有机污染物对微生物的抑制作用,提高其生物降解性和去除率,能够在很大程度上改善水质环境[7-9]。
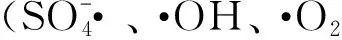
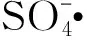
1 材料与方法
1.1 供试材料
六水合硝酸钴、尿素、硫代硫酸钠、氢氧化钠、乙醇等试剂(分析纯,国药化学试剂集团有限公司),过一硫酸钾、罗丹明B(分析纯,Aladdin)。实验主要仪器:BSA224S-CW电子天平(赛多利斯科学仪器有限公司);KD2200DA数控超声波清洗器(昆山市超声仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(巩义予华仪器有限公司);UV-2600紫外可见分光光度计。
1.2 实验方法
1.2.1 钴基催化剂的制备 采用湿热法[22]合成催化剂,通过配制0.03 mol/L硝酸钴和0.15 mol/L尿素溶解到100 mL去离子水中,形成混合溶液[23],在300 r/min转速搅拌5 min,并短暂超声处理后,取30 mL混合的溶液转移到50 mL高压反应釜中,在95 ℃下水热反应6 h,反应后沉淀物用去离子水和乙醇反复洗涤离心得到粉末颗粒样品,并在60 ℃鼓风干燥箱中干燥12 h,取出收集到样品管中备用。
1.2.2 RhB的降解 探究催化剂用量、PMS用量、初始pH等参数对RhB降解效率的影响,在50 mL罗丹明B水溶液(100 mg/mL)加入5 mg的钴基催化剂,搅拌30 min使溶液中污染物和催化剂达到吸附解吸平衡,再快速加入0.5 ml PMS水溶液。并用稀硫酸和氢氧化钠调节溶液pH值,每间隔3 min,取0.5 mL收集的样品用1 mL饱和硫代硫酸钠溶液淬灭,使用紫外可见分光光度计,在有机物的最大吸收波长下测定残留溶液的浓度,得到实验数据,利用公式Ct/C计算降解速率[24],C代表原始液体的吸光度,Ct代表t时刻液体的吸光度。
1.2.3 RhB循环降解实验 通过实验对催化剂的循环使用性能进行评价,将反应后的催化剂通过砂芯漏斗的过滤膜抽滤收集,清洗、干燥再次用于下一个反应,在原有的降解条件下继续进行降解实验,从而评价催化的稳定性和重复利用性,并对回收的催化剂进行表征分析,判断催化剂的理化性质是否发生变化。
1.3 产物测试与表征
使用Rigaku TTR-IIIX射线衍射仪对制备的催化剂样品以及PMS氧化后样品的晶体结构进行表征分析;扫描电子显微镜(SEM Flex-1000)观察催化剂样品的表面形貌;X射线光电子能谱仪(XPS)测试催化剂的化学组成。
2 结果与分析
2.1 Co(CO3)0.5OH·0.11H2O催化剂的表征
图1a为成功制备Co(CO3)0.5OH·0.11H2O催化剂XRD图谱,其衍射峰与Co(CO3)0.5OH·0.11H2O的标准卡片(JCPDSNo.48-0083)的峰位置一致,强衍射峰2θ=10.0°、17.5°、30.4°、33.8°、35.5°、36.5°、39.5°所对应晶面指数(100)(020)(300)(221)(040)(301)(231)符合Co(CO3)0.5OH·0.11H2O的晶形结构,说明成功制备Co(CO3)0.5OH·0.11H2O催化剂。图1b为成功制备Co(CO3)0.5OH·0.11H2O催化剂SEM图,图显示样品为毛绒球状结构,其针尖长度大小约3 μm,毛绒球状结构显著增加比表面积,可为有机染料提供更多的活化位点和反应接触面积,从而加快反应进度,提高有机物降解速率。
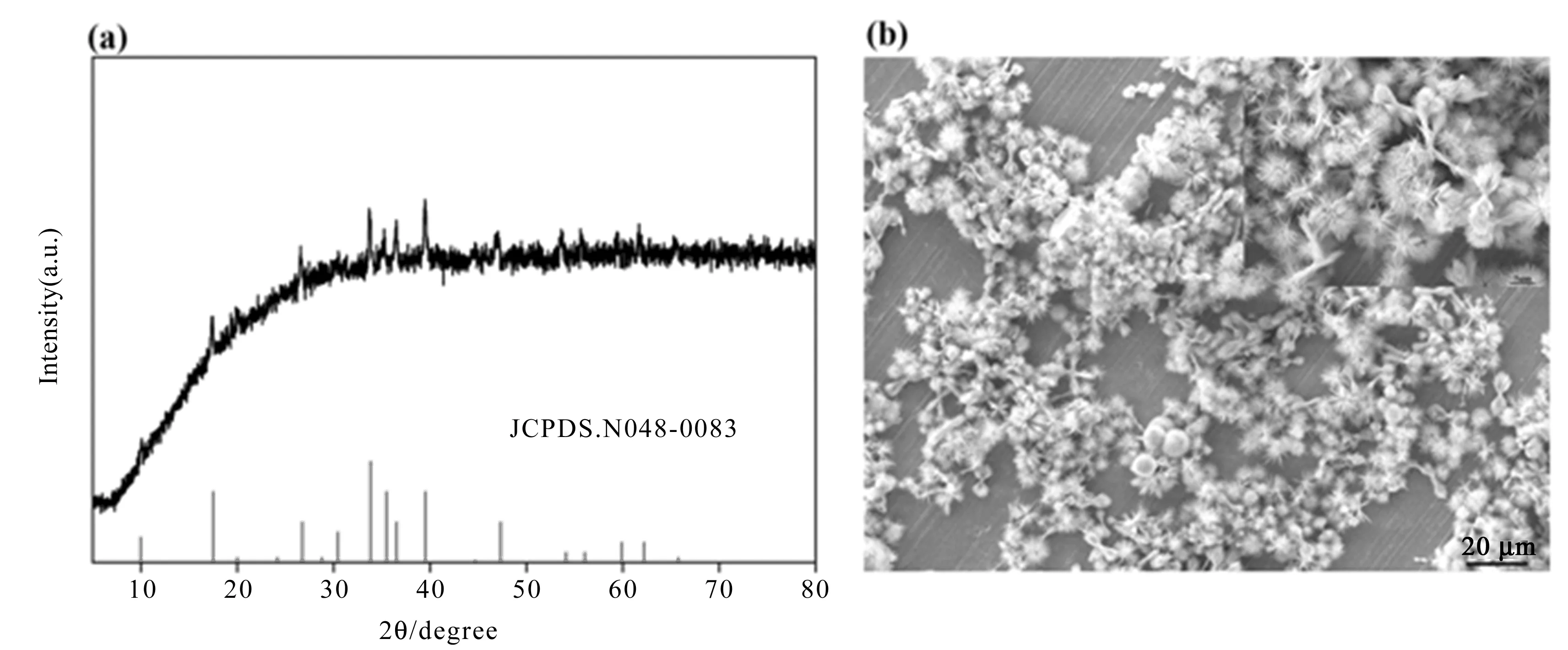
图1 Co(CO3)0.5OH·0.11H2O催化剂的XRD和SEM图谱
2.2 不同条件对RhB降解影响
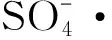
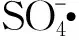
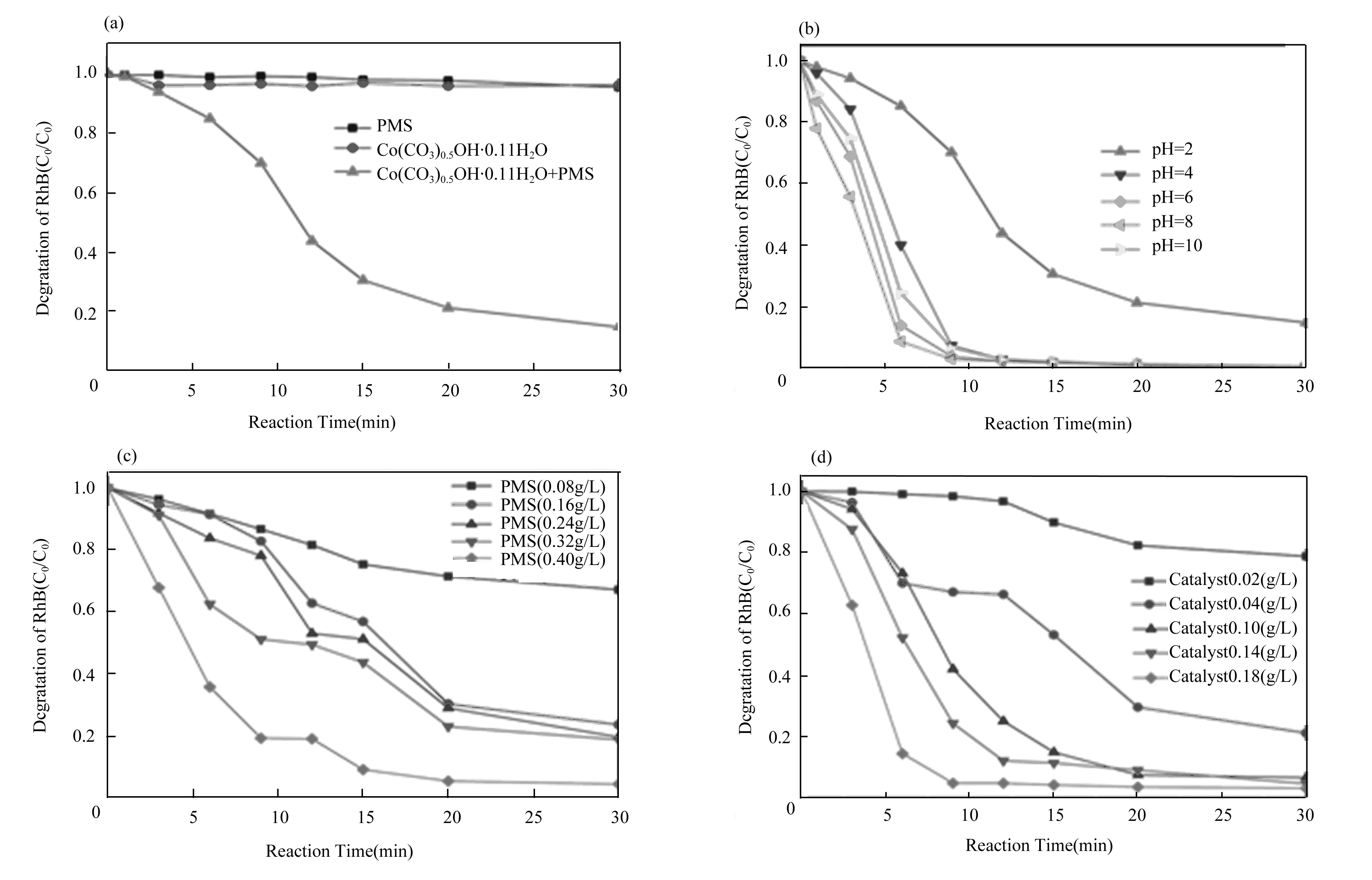
图2 PMS用量、催化剂用量、初始pH等参数对RhB的降解效率的影响
2.3 催化剂的循环降解实验
在固定20 min时间间隔,测定降解率。催化剂经重复8次使用后仍然保持86.28%以上的催化降解率,具备循环使用能力,在降解催化过程中具有重要的意义。
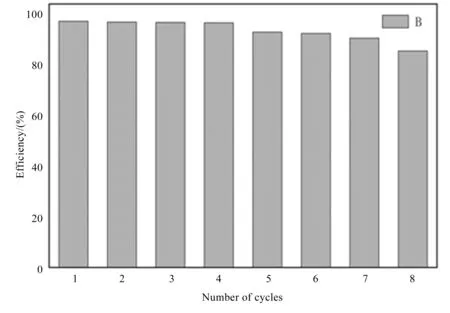
图3 催化剂循环使用对RhB的降解效率的影响
2.4 PMS体系催化降解有机物的研究
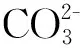
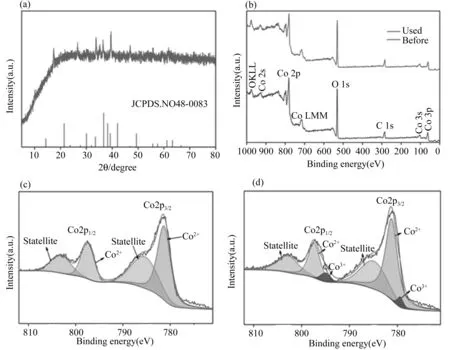
图4 Co(CO3)0.5OH·0.11H2O的XPS图谱,以及催化氧化后XRD图谱
2.5 PMS高级催化氧化机制
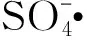
CO2++H2O→COOH++H+
(1)
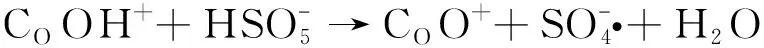
(2)

(3)
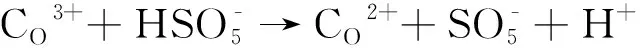
(4)
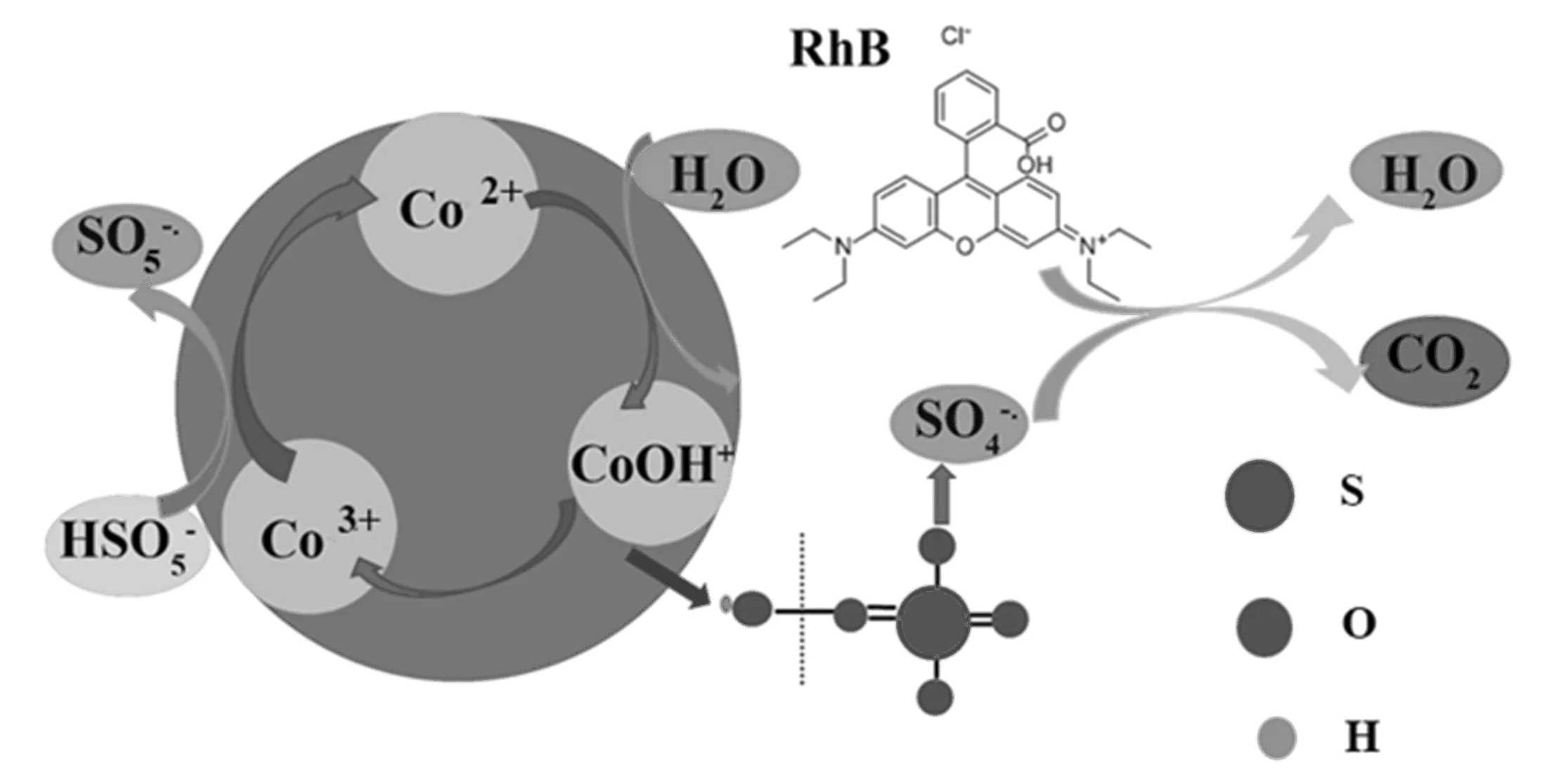
图5 Co2+和Co3+转化示意图,以及高级催化氧化降解有机物原理
3 结论