基于异源包被诺氟沙星间接竞争酶联免疫分析方法
2022-06-23张慧敏丁德杰蒲顺昌
陆 宁, 张慧敏, 邢 爽, 丁德杰,陈 鑫, 高 瑾, 张 潮, 蒲顺昌*
(1.亳州学院 生物与食品工程系,安徽 亳州 236800;2.药食同源功能食品亳州市重点实验室,安徽 亳州 236800)
诺氟沙星(Norfloxacin, NFLX)别名氟哌酸,化学名称为1-乙基-6-氟-1,4-氧代-7-(1-哌嗪基)-3喹啉羧酸,化学结构式如图1所示,属于第三代喹诺酮类抗菌药物,为灰白色至淡黄色结晶粉末[1-2]。NFLX杀菌效果好,能够抑制消化道内致病细菌的DNA旋转酶作用,阻碍致病菌DNA的复制、转录、修复和重组,对细菌有较好的抑制作用[3-4]。但NFLX也具有一定的毒副作用,会引起过敏反应、神经系统损伤、消化系统损伤、泌尿系统损伤、心血管系统损伤等,还会破坏人体内的菌群平衡,人体长期摄入含有NFLX的食品,会导致NFLX在人体内积累,对人们的健康造成潜在威胁,严重时可能会危害生命[5-6]。我国规定动物源性食品中诺氟沙星的限量标准为不得超过10 ng/mL[7]。有些不法商贩会将NFLX作为蜂药、兽药等用于蜜蜂、畜禽、渔业养殖,长期使用会使蜂蜜、畜禽、水产体内存有大量NFLX残留,严重威胁人类健康[8]。因此,诺氟沙星的检测越来越引起人们的重视。

图1 诺氟沙星化学结构式
目前,针对诺氟沙星的检测方法主要有毛细管电泳法(Capillary electrophoresis,CE)、高效液相色谱法(High performance liquid chromatography,HPLC)、液相质谱法(Liquid Mass Spectrometry,MS)、液相色谱-质谱联用法(Liquid chromatography-mass spectrometry,LC-MS)、酶联免疫吸附法(ELISA)等[9-12]。其中,HPLC、MS和LC-MS检测结果准确、灵敏度高,但是操作步骤繁琐,对仪器设备和技术的要求高,多用于检测部门少量精确样品检测[13]。CE方法灵敏度不高、选择性较低,现阶段运用该方法进行检测的情况不多[14]。ELISA具有灵敏度高、快速稳定、特异性好、成本低、样品前期处理简单等特点,是目前高通量检测使用最为广泛的检测方法[15-16]。
本实验将NFLX与牛血清蛋白(BSA)偶联,制备免疫原免疫新西兰大白兔,从新西兰大白兔体内分离纯化得到高特异性的NFXL抗体,并通过ELISA对抗原抗体结合性能进行优化,开发出一种高灵敏度的诺氟沙星广谱特异性快速检测方法。同时,对抗原抗体的识别机制进行初步探讨,为高灵敏度抗体的制备提供理论依据。
1 材料与方法
1.1 材料与试剂
诺氟沙星标准品(美国Sigma公司);氧氟沙星标准品(美国Sigma公司);N-羰基琥铂酰亚胺(NHS)(美国Sigma公司);1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)(美国Sigma公司);N,N-二甲基酰胺(DMF)(美国Sigma公司);牛血清蛋白(BSA)(美国Sigma公司);鸡卵血清蛋白(OVA)(美国Sigma公司);氯甲酸异丁酯(美国Sigma公司);三正丁胺(美国Sigma公司);弗氏完全佐剂(美国Sigma公司);弗氏不完全佐剂(美国Sigma公司);正辛酸(分析纯,广州台山粤桥化工厂);硫酸铵(分析纯,广州台山粤桥化工厂);氢氧化钠(分析纯,广州台山粤桥化工厂);脱脂奶粉(食用级,安怡公司);酶标二抗(美国Bioworld公司);TMB显色液(实验室配制);吐温-20(北京索莱宝科技有限公司);鱼肉、蜂蜜(当地超市购买);PBS缓冲液(实验室配制);碳酸盐缓冲液(实验室配制)。
1.2 仪器与设备
ME3002E电子天平(美国Mettler toledo公司);ME204电子天平(美国Mettler toledo公司);超纯水制作仪(苏州赛恩斯仪器有限公司);4 ℃/-20 ℃冰箱(中国海尔公司);ND1000紫外分光光度计(美国Thermo公司);QL-861振荡器(海门市其林贝尔仪器有限公司);6K15冷冻离心机(美国Sartorius-Sigma公司);M2E多功能酶标仪(美国Molecular device公司);DHG-9145电热鼓风干燥箱(上海恒一科技有限公司);DK-8D电热恒温水槽(上海医用恒温设备厂)。
1.3 实验方法
1.3.1 人工抗原的制备与鉴定 采用活泼酯法,将NFLX标准品或氧氟沙星(OFL)标准品与BSA或OVA进行偶联,得到目标偶联产物NFLX-BSA、NFLX-OVA、OFL-OVA,于-20 ℃分装保存[17]。
使用紫外分光光度计对偶联产物、BSA、OVA、NFLX标准品和OFL标准品进行全波长扫描,获得紫外吸收光谱,鉴定半抗原与载体蛋白是否偶联成功。
1.3.2 动物免疫 选用健康成年新西兰大白兔进行免疫。取50 μL 1 mg/mL的免疫原NFLX-BSA与等量弗氏完全佐剂混合进行乳化,制备完全抗原。采用皮下多点注射的方式进行免疫,每只免疫350 μL剂量。3周后,取相同剂量的免疫原与等量的弗氏不完全佐剂混合进行乳化,采用相同方式进行第2次免疫,剂量不变。后续免疫均采用弗氏不完全佐剂进行混合乳化,每隔3周进行1次免疫。第4次免疫后10 d采血,混入等体积甘油,于-20 ℃备存。
1.3.3 多克隆抗体的纯化 取兔抗血清在4 ℃条件下12 000 r/min离心15 min,将1 mL上清液与2 mL醋酸盐缓冲液混合,pH调至4.8,室温下充分搅拌。向反应液中逐滴加入75 μL正辛酸,室温搅拌30 min,4 ℃下静置2 h。4 ℃条件下12 000 r/min离心15 min。上清液经125 μm尼龙网进行过滤,加入PBS缓冲液(0.1 mol/L,pH 7.4)。用2 mol/L氢氧化钠调pH至7.4。冰浴下于30 min内向反应溶液中加入0.28 g/mL硫酸铵,使其成为45%饱和溶液,4 ℃静置1 h以上,12 000 r/min离心15 min,弃上清液,沉淀用PBS缓冲液(0.1 mol/L,pH 7.4)透析3 d,得到的纯化抗体在-20 ℃条件下保存。
1.3.4 兔多克隆抗体性能检测 将同源包被原(NFLX-OVA)与异源包被原(OFL-OVA)分别用包被液(碳酸盐缓冲液)稀释至1 μg/mL后,向96孔酶标板中每孔加入100 μL,37 ℃水浴过夜。利用制备好的酶标板,采用ELISA方法对比同源、异源包被的检测结果,筛选性能较好的包被原及抗体[18]。
1.3.5 适宜包被浓度及一抗稀释倍数的确定 使用方阵滴定法,将包被原OFL-OVA浓度设置6个梯度,分别为1 000、500、250、125、62.5、31.25 ng/mL,抗体稀释倍数设置8个梯度,分别为250、500、1 000、2 000、4 000、8 000、16 000、32 000倍,进行ELISA反应操作,计算每个包被原浓度与抗体稀释倍数组合的抑制率,确定最适宜的包被浓度和抗体稀释倍数。设置酶联免疫反应参数为:一抗竞争反应时间40 min,二抗稀释倍数为5 000倍,二抗反应时间30 min,稀释液体系为PBST溶液。得出A450、IC50以及A450/IC50数量关系,筛选最优包被浓度和一抗稀释倍数。
1.3.6 二抗稀释倍数的确定 设置酶联免疫反应参数为:包被浓度125 ng/mL,一抗稀释倍数为500,一抗竞争反应时间40 min,二抗反应时间30 min,稀释液体系均为PBST溶液。二抗稀释倍数设置2个水平,分别为5 000倍和10 000倍。ELISA反应得到A450、IC50以及A450/IC50数量关系,确定最佳二抗稀释倍数。
1.3.7 二抗竞争反应时间的确定 设置酶联免疫反应参数为:包被浓度125 ng/mL,一抗稀释倍数为500,一抗竞争反应时间40 min,二抗稀释倍数为5 000,稀释液体系均为PBST溶液。二抗反应时间设置3个水平,分别为20、30、40 min进行ELISA实验,得出A450、IC50以及A450/IC50数量关系,确定最佳二抗竞争反应时间。
1.3.8 标准曲线的建立 根据前面的结果,以最优工作条件进行ELISA反应,建立标准工作曲线,并利用Origin 8.5的四参数拟合模块sigmoidal-logistic进行拟合。
1.3.9 交叉反应 将NFLX和马波沙星、莫西沙星、吡哌酸、萘啶酸、芦氟沙星、环丙沙星、恩诺沙星、普卢利沙星等8种氟喹诺酮类药物在相同条件下分别进行ELISA测定,计算其标准曲线的IC50值,以NFLX的交叉反应率(cross-reactivity,CR)为基准(100%),检测9种结构交叉反应情况。
CR=IC50(NFLX)/IC50(其余结构)×100%
1.3.10 回收试验 将1 g鱼肉组织切碎,置于15 mL离心管中,加入2 mL三氯乙酸(7.5% TCA),涡旋混匀2 min,4 ℃ 5 000 r/min离心10 min,PBST稀释50倍得到鱼肉样。蜂蜜用PBST稀释50倍得到蜂蜜样。向鱼肉样和蜂蜜样中各添加50、100、500、1 000 ng/g的诺氟沙星标准品,按照ELISA步骤测定,每个样品设4个重复,计算回收率。
2 结果与分析
2.1 人工抗原的鉴定
NFLX、BSA和NFLS-BSA的紫外扫描结果如图2所示,NFLX在波长为210 nm和260 nm处有吸收峰,BSA在波长为280 nm处有吸收峰,NFLX和BSA载体蛋白偶联后,NFL-BSA的吸收峰向左发生偏移,说明偶联物已经偶联成功。

图2 NFLX、BSA和NFLX-BSA紫外光谱扫描曲线
NFLX、OVA和NEFX-OVA的紫外扫描结果图3所示,NFLX在波长为210 nm和260 nm处有吸收峰,OVA在280 nm处有吸收峰,NFLX和OVA载体蛋白偶联后,NFL-OVA的吸收峰向左发生偏移,说明偶联物已经偶联成功。
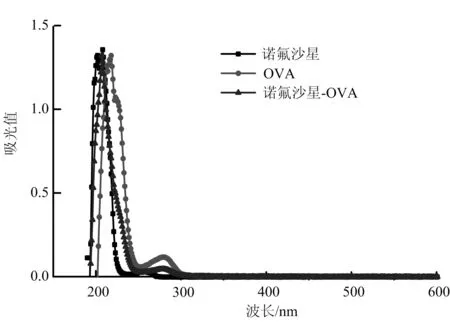
图3 NFLX、OVA和NFLX-OVA紫外光谱法扫描曲线
OFL、OVA和OFL-OVA的紫外扫描结果如图4所示,OFL在波长为220 nm和260 nm处有吸收峰,OVA在280 nm处有吸收峰,OFL和OVA载体蛋白偶联后,OFL-OVA的吸收峰向左发生偏移,说明偶联物已经偶联成功。
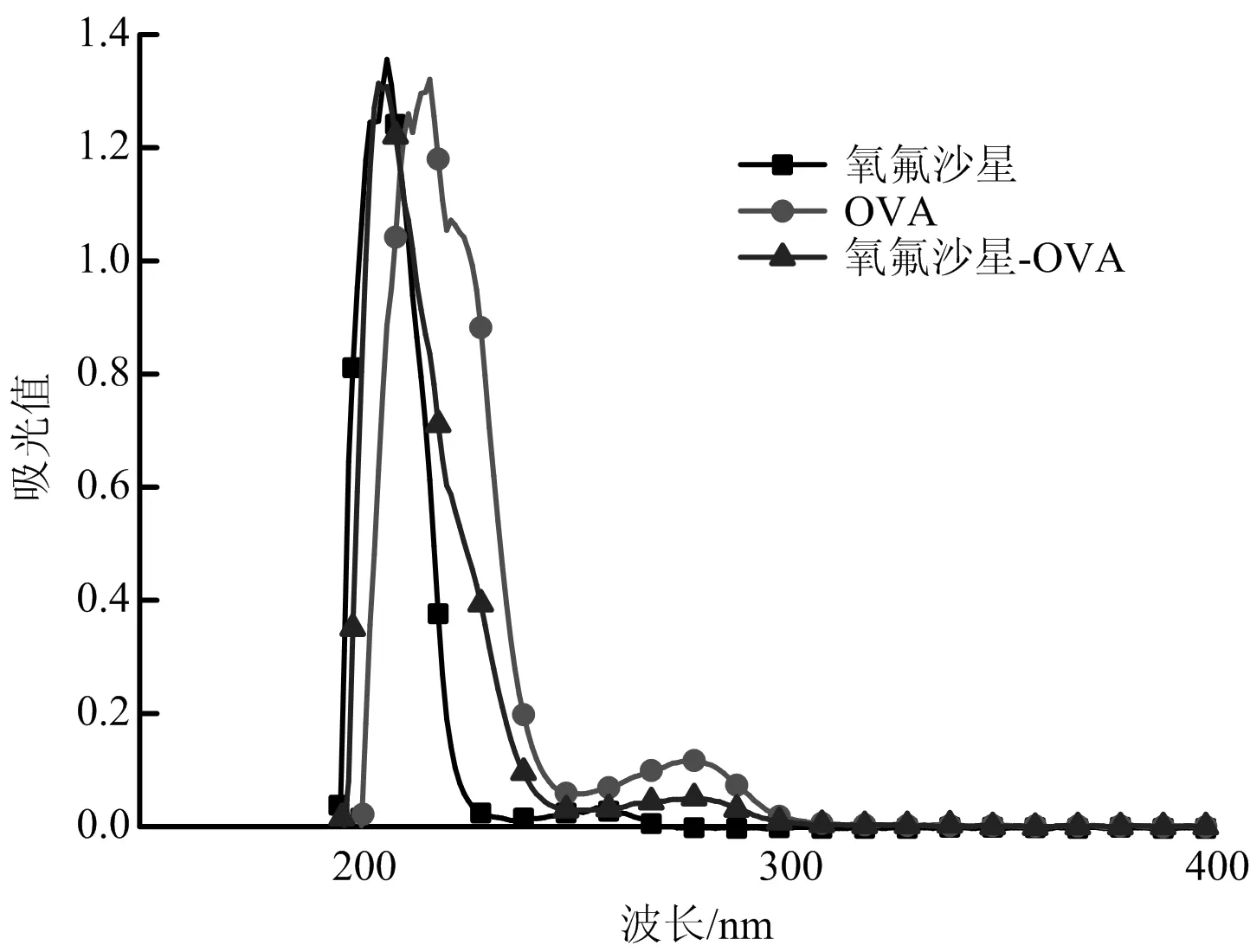
图4 OFL、OVA和OFL-OVA紫外光谱法扫描曲线
2.2 多克隆抗体性能检测
用ELISA方法检测1、2号兔多克隆抗体后,发现同源包被条件下,抗体不能识别NFLX,异源包被条件下,抗体对NFLX识别能力较强,因此选用异源包被对1、2号兔多克隆抗体进行检测筛选。如图5~6所示,1号兔抗体对NFLX标准品抑制率最高可达到88%,2号兔抗体对NFLX标准品抑制率最高可达到80%。

图5 异源包被条件下1号兔抗体对NFLX的效价抑制曲线
2.3 适宜包被浓度及一抗稀释倍数的确定
ELISA方法检测中,一般选择A450在1.0~1.5之间的包被原-抗体浓度组合,显色值过高或过低都会影响最后的检测结果[19]。因此,从方阵滴定浓度中选取A450在1.0~1.5之间,且具有较高抑制率的组合,即125、62.5、31.25、15.625 ng/mL 4个包被浓度,一抗稀释倍数选定500倍,进行进一步筛选。抑制曲线结果如图7所示,对应的抑制曲线参数如图8所示。
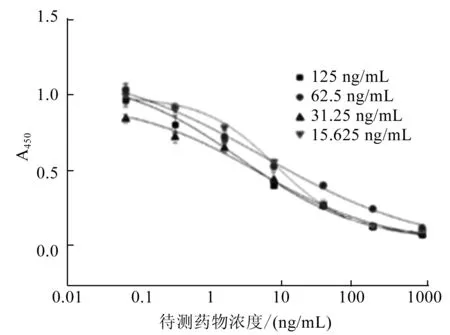
图7 不同包被浓度对NFLX的抑制曲线

图8 不同包被浓度对应的抑制曲线参数
随着包被原浓度的增高,Amax值呈现降低的趋势,IC50先减小后增大,在125 ng/mL时达到最小值,Amax/IC50值则先增后降,在125 ng/mL时达到最大值。将Amax在1.0~1.5之间、Amax/IC50较高、IC50较低的包被浓度和一抗稀释倍数作为最佳条件,最终选择包被原浓度为125 ng/mL,一抗稀释倍数为500作为最佳包被浓度及一抗稀释倍数。
2.4 适宜二抗稀释倍数的确定
如图9~10所示,随着二抗稀释倍数的增高,竞争曲线Amax值随之降低,IC50值反而增高,Amax/IC50值降低,可能是由于二抗浓度降低导致二抗与一抗结合性变差。将Amax在1.0~1.5之间、Amax/IC50较高、IC50较低的二抗稀释倍数作为最佳条件,选择二抗稀释倍数5 000倍作为最佳二抗稀释倍数条件。

图9 不同二抗稀释倍数对应竞争曲线
2.5 二抗竞争反应时间的确定
如图11~12所示,随着反应时间减少Amax值也随之降低,IC50值也降低,其中反应时间分别为20和30 min的竞争曲线Amax/IC50值相近。将Amax在1.0~1.5之间,Amax/IC50较高、IC50较低的二抗竞争反应时间作为最佳条件,确定二抗反应时间为30 min。

图11 不同二抗反应时间对应抑制曲线参数对比
2.6 间接竞争ELISA标准工作曲线
选用上述最优反应条件,绘制标准曲线如图13所示。对NFLX半抑制浓度(IC50)为4.23 ng/mL,相对标准偏差(RSD)为0.096,定量检测线性范围(IC20~IC80)为0.29~61.83 ng/mL,检测限(IC10)为0.06 ng/mL。
2.7 交叉反应实验
结果如表1所示,用该抗体建立的ELISA方法对诺氟沙星及其他4种常见氟喹诺酮类物质交叉反应率大于5%。方法可用于该5种氟喹诺酮类药物的广谱性检测。
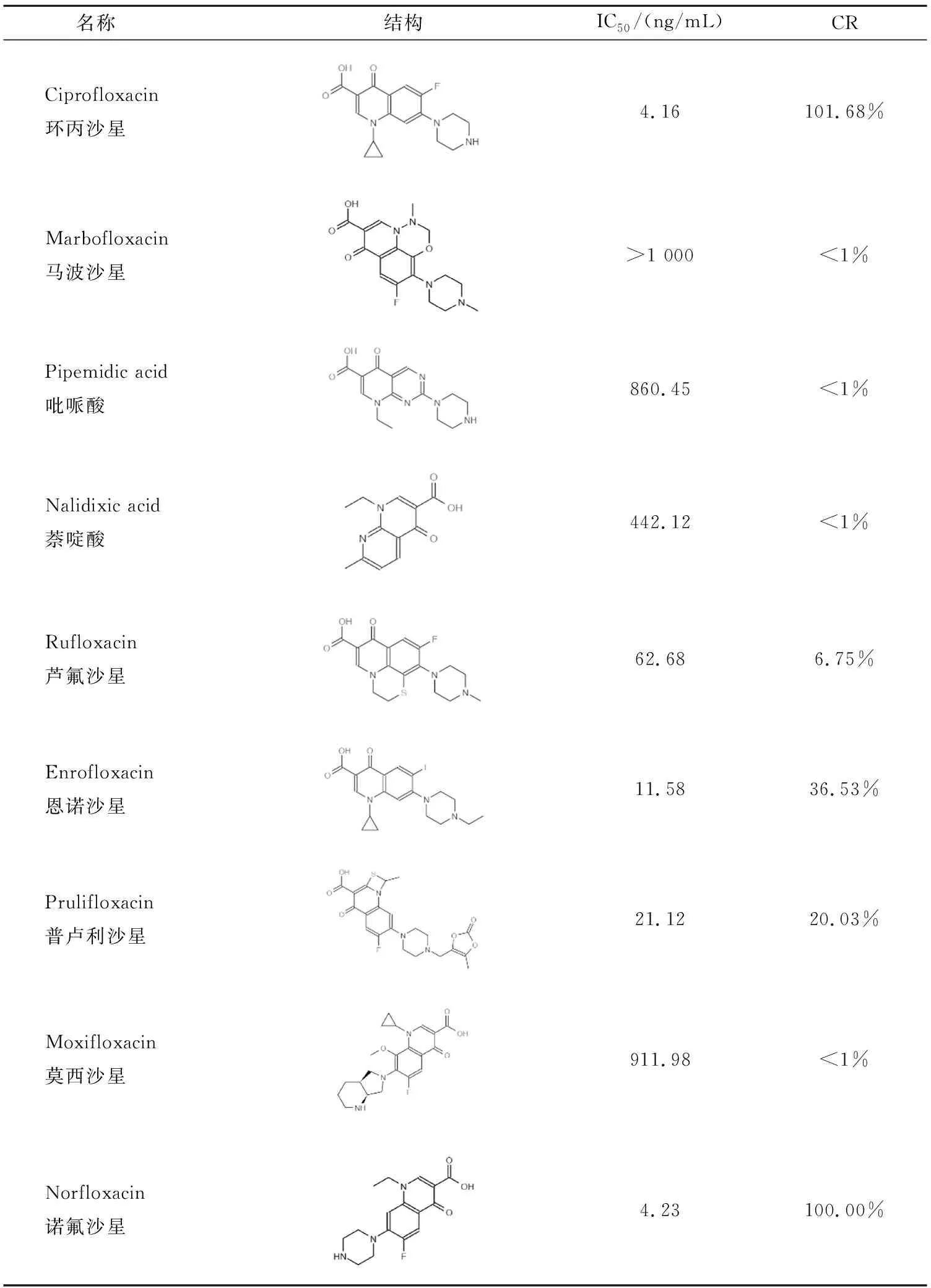
表1 抗体与9种氟喹诺酮类药物的交叉反应
2.8 添加回收试验
由表2可知,本方法对鱼肉的添加回收率在77.90%~91.50%之间,平均添加回收率为83.94%;对蜂蜜的添加回收率在71.91%~87.29%之间,平均添加回收率为80.63%。两种样品的平均添加回收率均高于80%,添加回收率范围均在70%~95%之间。证明了检测方法的准确度,可以用于实际样品中诺氟沙星残留的检测。
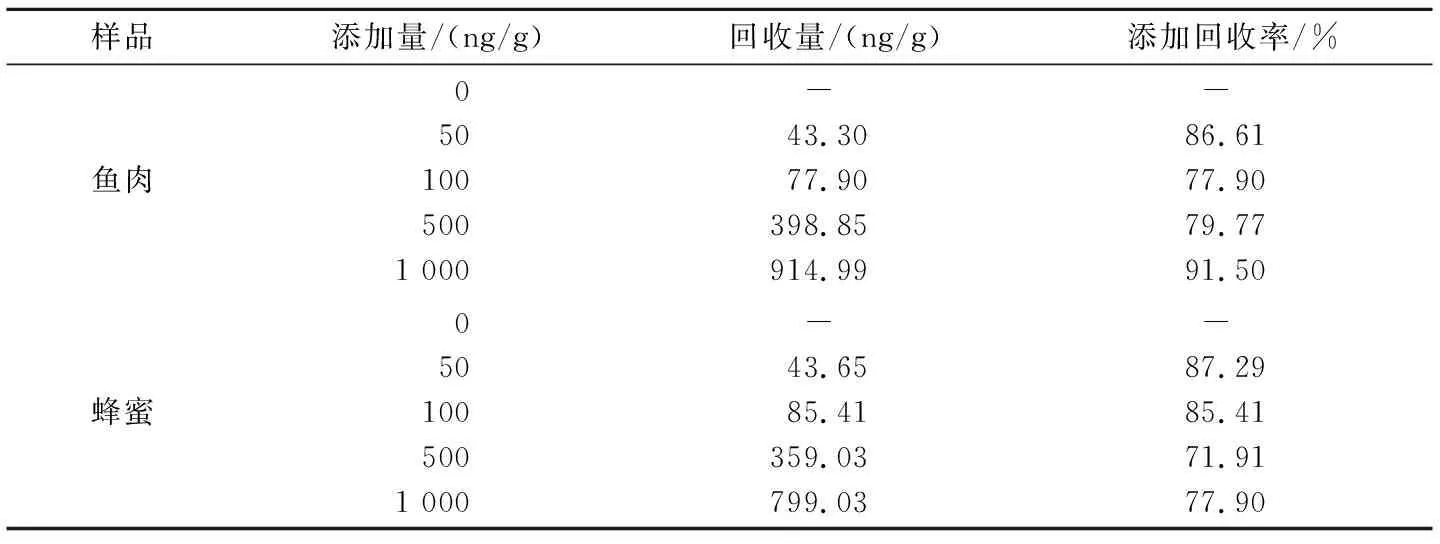
表2 鱼肉和蜂蜜样品中诺氟沙星的添加回收率
3 结论与讨论
诺氟沙星是半抗原,不具有免疫原性,需要与载体蛋白偶联,制备成合适的人工抗原,才能具有免疫原性。本文使用活泼酯法将诺氟沙星与BSA和OVA载体蛋白偶联,将氧氟沙星与OVA载体蛋白偶联。在紫外光谱的鉴定下,偶联物的吸收峰都发生了变化,说明偶联成功。
用ELISA方法检测经诺氟沙星-BSA免疫的1~2号兔抗体,最终选择灵敏度更高的异源包被(氧氟沙星-OVA)及1号兔进行诺氟沙星检测方法的建立。异源包被更灵敏的原因可能是因为诺氟沙星没有N、O杂环,而是一段碳链,没有O平衡电荷,因而其制备出的抗体更能结合该位点不具备O平衡电荷能力的结构。而氧氟沙星的N、O杂环可以有效地平衡分子电荷,使得结合部位环外氧受到的电荷影响较小,O的电荷密度较高,相对不易与抗体结合,在与诺氟沙星标准品的竞争中不占优势。所以异源包被时,针对诺氟沙星的竞争抑制率较高,效果更好。
包被原浓度的优化中,Amax值呈现降低的趋势,IC50值先减小后增大,在125 ng/mL时达到最小值,Amax/IC50值则先增后降,在125 ng/mL时达到最大值。推测当包被原浓度较大时,药物与抗体结合量小于包被抗原与抗体结合量,表现出药物对抗体竞争力降低,导致较高的IC50;如果包被原浓度过低,反应时抗体过量,药物浓度变化对竞争反应灵敏度降低。因此,只有包被抗原浓度适当时,药物和包被原的竞争力表现的最明显,抗体灵敏度最高。基于ELISA反应的条件优化,最终建立NFLX的ic-ELISA检测方法,其检测灵敏度(IC50)为4.23 ng/mL,检测限为0.06 ng/mL,是一种极为灵敏的诺氟沙星ELISA检测方法。
在交叉实验中,诺氟沙星及其他4种常见氟喹诺酮类物质交叉反应率大于5%,具有较强广谱性,可用于氟喹诺酮类药物的广谱检测。虽然环丙沙星连接N、O杂环的三元环没有碳链,但是其结构容易吸引正电荷,使结合部位环外氧电荷密度较低,相对较易与抗体结合,因此其交叉反应率较高。马波沙星、吡哌酸、芦氟沙星、莫西沙星分别是由于N、O杂环、含N六元环、强电负性S、两个含N杂环的平衡电荷能力使其不易于诺氟沙星的抗体结合,因此无交叉反应或交叉反应率较低。而恩诺沙星和普卢利沙星的交叉反应率比前几种结构较高的原因可能是三元环、结合部位附近的N、S杂环和含O杂环降低了结合部位的环外氧电荷密度,从而提高了交叉反应率。
在实际样品的检测中,鱼肉和蜂蜜中添加平均回收率均在80%以上,添加回收率范围在70%~95%之间,回收率较好,方法稳定,能够满足日常检测要求,可用于诺氟沙星等物质的广谱快速检测。