miRNA-148/152 家族成员在恶性肿瘤中的生物学功能研究进展
2022-06-23张一帆
张一帆 周 梁
(复旦大学附属眼耳鼻喉科医院耳鼻喉科 上海 200031)
microRNAs(miRNA)是长度约19~25 个核苷酸的非编码RNA,对许多生物过程至关重要。microRNA-148/152(miR-148/152)家族的成员,包括miR-148a、miR-148b 和miR-152,这 一 家 族 在 恶性肿瘤的发生发展中扮演了重要的角色。本综述从miRNA 的特征和产生、miR-148/152 家族成员结构特点、miR-148/152 家族成员与靶基因、miR-148/152 家族成员的表达与恶性肿瘤的相关性、miR-148/152 家族促进肿瘤发生发展的相关机制以及miR-148/152 家族在恶性肿瘤免疫逃逸中的作用共六部分进行了系统总结。
miRNA 的特征和产生miRNA 长度约19~25 个核苷酸,在几乎所有真核细胞中都起着重要的基因表达调节的作用。基因组通过RNA 聚合酶Ⅱ转录产生miRNA 初始体(pri-miRNA),RNAseⅢ内切酶将primiRNA 切割成miRNA 前体(pre-miRNA)[1]。核转运受体Exportin-5将pre-miRNA由细胞核转运至细胞质,随后通过Dicer 酶切割pre-miRNA 形成成熟的双链miRNA[2]。miRNA 是转录后调节因子,通过互补碱基配对与靶基因mRNA 的3'-非翻译区(3'-untranslated region,3'-UTR)中的序列结合,从而导致靶基因表达的下调[3]。越来越多的证据表明,miRNA 在广泛的生物学过程中起着关键作用,通过表达的上调和下调改变靶基因的表达,从而改变细胞增殖、死亡和能量代谢等多种生物学过程[4]。
miR-148/152 家族成员结构特点miR-148/152 家族成员包括miR-148a、miR-148b以及miR-152[5]。miR-148/152 家族成员位于人类第7、12 和17 号染色体。miR-148/152 家族成员前体具有茎环结构,该前体通过一系列核内和胞质内酶加工成成熟miR-148/152 家族成员。成熟miR-148/152 家族成员长度为21~22 个核苷酸,相同的种子序列约为6~7 个核苷酸(图1)。种子序列是miRNA 与靶mRNA 结合的重要区域。通过种子序列与靶mRNA 的3'-UTR 之间的互补结合,miR-148/152 家族成员参与了多种生物学过程。许多恶性肿瘤和正常组织中存在miR-148/152 家族成员的差异表达。因此,miR-148/152 家族成员对肿瘤的发生和发展可能至关重要。

图1 miR-148/152 家族成员的成熟序列Fig 1 Mature miRNA sequence of miR-148/152 family members
miR-148/152 家族成员与靶基因在不同的细胞环境中,相同的miRNA 可能通过结合不同的靶基因调节多种途径并引起多种表型。miR-148/152家族成员具有很多不同的靶基因,在多种生物学过程中发挥重要作用。多种生物信息学方法可用于预测miRNA 的靶基因。miRanda[6],Diana-microTCDS[7]和TargetScan[8]是 目 前miRNA 研 究 中 最 常用的3 种预测方式。TargetScan 使用多种线性回归模型将可分析元素分解为14 个特征,然后使用种子匹配(长度和频率)、3′补偿和折叠自由能作为预测特征,是目前科学界使用最广泛的miRNA 靶基因预测工具。此外,荧光素酶报告、PCR(polymerase chain reaction)和免疫蛋白印迹(Western blot)等实验方法可用于验证miRNA 的靶基因。荧光素酶报告实验可以识别miRNA 与其靶向mRNA 区域之间的直接相互作用,而qPCR 和免疫蛋白印迹可以评估由相互作用引起的转录和翻译抑制。验证miR-148/152 的靶基因需满足以下两个标准:靶基因具有带有互补序列的miR-148/152 家族成员结合位点,可以直接与miR-148/152 家族成员结合;miR-148/152 的表达能够抑制靶基因在RNA 和蛋白水平上的表达。miR-148/152 家族成员的靶基因(表1)。

表1 miR-148/152 的靶基因及其在恶性肿瘤中的功能Tab 1 Validated targets of the miR-148/-152 family and its function in malignant tumor
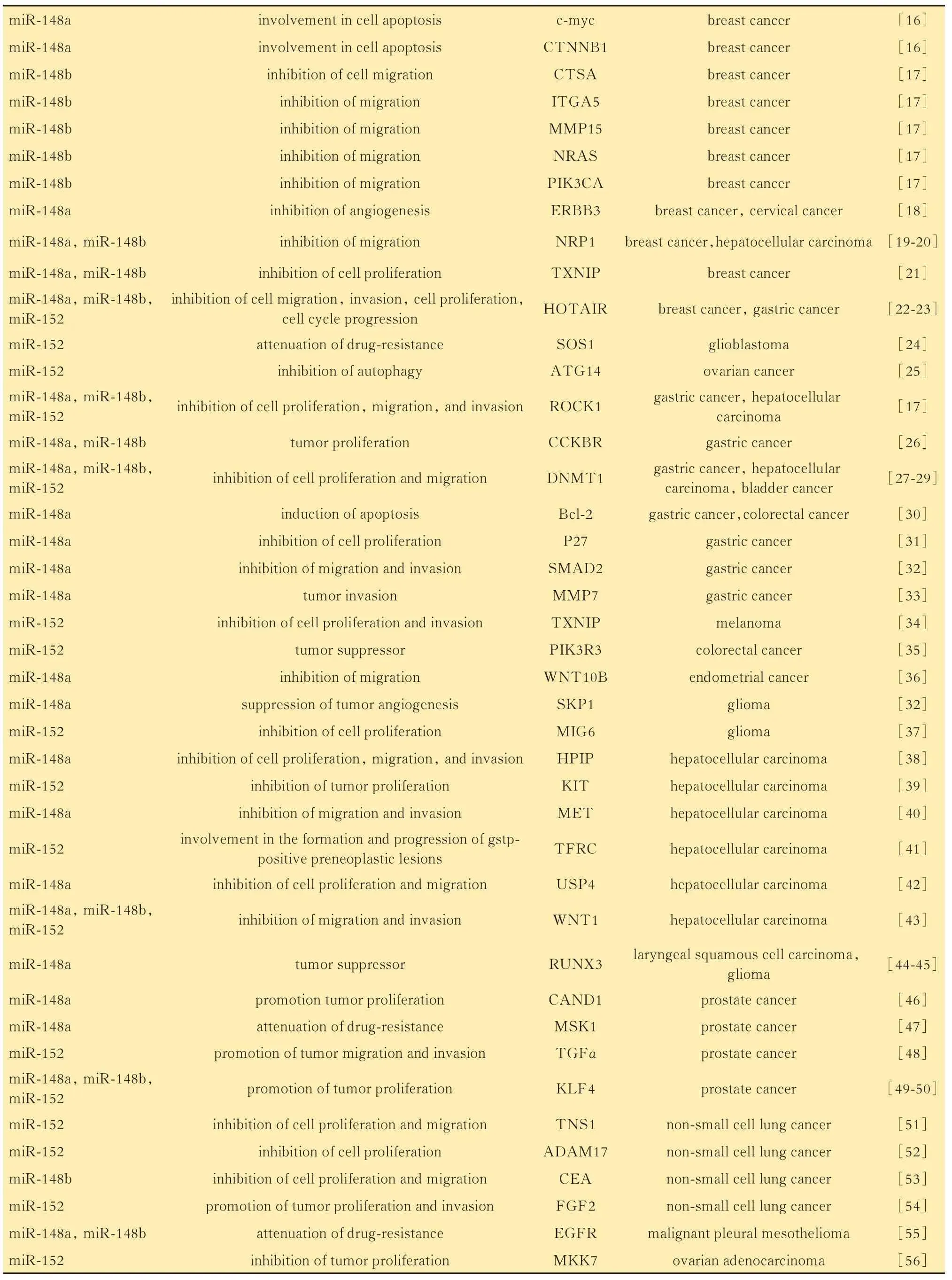
(续表1)
miR-148/152 家族成员的表达与恶性肿瘤的相关性miR-148/152 家族成员在许多恶性肿瘤中表达上调。据报道,包括miR-148a 在内的6 种miRNA在多发性骨髓瘤(multiple myeloma,MM)血浆中显著上调,高水平的miR-148a 与更短的无复发生存时间 相 关[57]。同 样 在 血 浆 中,Cuk 等[58]注 意 到miR-148b 在乳腺癌患者中明显上调。此外,Gokhale等[59]发现miR-148a 在髓母细胞瘤中过表达,并可能与WNT 信号通路相关。另外,miR-148a 在与肝细胞癌(hepatocellular,HCC)相关的乙型肝炎细胞中被上调[60]。因此,在这些肿瘤中,miR-148a 和miR-148b 可能是重要的生物标志物,并具有早期诊断的潜在价值。
在多种恶性肿瘤类型中发现miR-148/152 家族成员的表达都有下调,表明它们可能具有肿瘤抑制的作用。在肝细胞癌中,相对于肝细胞系L02,miR-148b 在肝癌细胞系HepG2、MHCC97L 和MHCC97 H 中表达下调[60]。miR-148a 和miR-152 在胃肠道肿瘤组织及其细胞系中的表达被下调,并通过靶向胆囊收缩素-2 受体(cholecystokinin B receptor,CCK2R)抑制细胞生长[26]。在卵巢癌组织及其细胞系中,miR-152 表达降低,但miR-148a 仅在卵巢癌细胞系中表达降低[61]。
miR-148/152 家族促进肿瘤发生发展的相关机制目前在许多肿瘤中都发现了miR-148/152 家族成员基因的甲基化。此前有研究发现,在胃癌中,DNMT1(DNA methyltransferase 1)的过表达能够促进miR-148a 基因启动子的超甲基化从而抑制其表达,而沉默miR-148a 会降低其对DNMT1 的抑制作用,这可能会导致DNMT1 的过表达,从而促进DNA 超甲基化[62]。Lujambio 等[63]发现使用DNA 脱甲基剂后,与正常组织相比,miR-148a、miR-34b/c和miR-9 在癌细胞中出现了特定的高甲基化相关沉默;最重要的是,他们发现与DNA 甲基化相关的抑癌miRNA 沉默可能有助于人类癌症的转移。Stumpel 等[64]鉴定出11 种miRNA,包括miR-152,它们由于CpG 甲基化而在t(4;11)阳性婴儿急性淋巴细胞白血病中下调。进一步的研究表明,髓样/淋巴样白血病(myeloid-lymphoid leukemia,MLL)中,DNMT1 是miR-152 的 潜 在 靶 基 因,miR-152 CpG岛的高度甲基化与不良的临床预后密切相关。
近年来多项研究表明miR-148/152 家族成员通过靶向多条通路从而产生对肿瘤的抑制作用。Feng 等[49]发 现 前 列 腺 癌 中miR-148-3p 和miR-152-3p 可通过抑制KLF4(Kruppel like factor 4)发挥抗肿瘤作用。除前列腺癌外,结直肠癌等多种肿瘤中都发现miR-148/152 家族成员可靶向KLF4 并抑制肿瘤的生长[50]。在乳腺癌中,miR-152 的过表达通过靶向IGF-1R(insulin-like growth factor 1 receptor)和IRS1(insulin receptor substrate 1)并抑制其下游AKT 和MAPK 信号通路来显著抑制细胞增殖、集落形成和肿瘤血管生成[10]。非小细胞肺癌中,miR-152/TNS1 轴通过Akt/mTOR/RhoA 通路抑制肿瘤的增殖和迁移[51]。
DNMT1 是一种DNA 甲基转移酶,在疾病的发生发展中发挥重要的作用。研究表明,DNMT1 在多种肿瘤中差异表达[65],并能被miR-148/152 家族成员调节其表达,包括肝细胞癌[27]、急性淋巴细胞白血病[28]、子宫内膜癌[29]等。在乳腺癌中,多项研究表明miR-148a/152-DNMT1 调节回路在肿瘤的发生发展中发挥极其重要的作用[10]。
PTEN(phosphatase and tensin homolog)是一种磷酸酶,可催化脂质第二信使PtdIns(3,4,5)P3 转化为磷脂酰肌醇(4,5)-双磷酸[PtdIns(4,5)P2][66]。PTEN 突变在多种肿瘤中频繁发生,例如子宫内膜癌[67]、多形胶质母细胞瘤[68]、皮肤[69]和前列腺癌[70]。据报道,PTEN 作为靶基因受多种基因调控。在miR-148/152 家 族 成 员 中,miR-148a 和miR-152 已被实验证实可调控PTEN 的表达[9],但相关研究仍较少,需要进一步探究。此外,一项关于膀胱癌的研究表明,miR-152-3p 通过抑制DNMT1 来调节PTEN 启动子中DNA 甲基化的状态从而调控PTEN 的表达[71]。
CAND1 (cullin associated and neddylation dissociated 1)等基因也被证明是miR-148/152 家族成员的靶基因,并调控恶性肿瘤的发生与发展。Murata 等[46]发 现miR-148a 通 过 与CAND1 mRNA的3'-UTR 结合而降低了CAND1 的表达,并促进了人 类 前 列 腺 癌 的 生 长。此 外,Bcl-2[30],p27[31]和CSF-1(colony stimulating factor 1)[11]也 被 证 明 是miR-148/152 家族成员的靶基因。
miR-148/152 家族成员与恶性肿瘤对药物的敏感性也密切相关。在胶质母细胞瘤细胞(T98G 和U87)中,miR-152-3p 通过靶向SOS1(SOS Ras/Rac guanine nucleotide exchange factor 1)增强了对顺铂的敏感性[24],在卵巢癌顺铂耐药系细胞中,miR-152的表达显著下调。进一步研究发现,miR-152 可以通过调控ATG14(autophagy related 14)减少顺铂诱导的自噬,增强顺铂诱导的细胞凋亡和抑制细胞增殖[25]。在乳腺癌中,miR-148a 和miR-152 通过调控ALCAM (activated leukocyte cell adhesion molecule)的表达,降低ER+乳腺癌的他莫昔芬耐药性[12]。
miR-148/152 家族在恶性肿瘤免疫逃逸中的作用人白细胞抗原G(major histocompatibility complex,class I,G,HLA-G)是一类在孕妇中对胎儿提供免疫耐受保护的重要蛋白。研究发现,HLA-G 也具有免疫抑制的作用,在肿瘤的发生发展中作为免疫检查点发挥重要的功能。在多种不同起源的人类肿瘤中,HLA-G 经常表达,从而抑制T细胞和自然杀伤(nature killer,NK)细胞的细胞毒活性。HLA-G 能在免疫细胞(NK、T、B、单核细胞/树突状细胞)上牢固结合其抑制性受体,抑制这些免疫细胞的功能,诱导免疫抑制。当肿瘤表达HLA-G时,可保护其免受抗肿瘤免疫的杀伤[13]。最近的研究表明,miR-148/152 对HLA-G 的转录后基因调控很强。Fu 等[14]的研究表明,在非小细胞肺癌中,miR-152 能够靶向HLA-G,调控其表达并影响肿瘤对NK 细胞的免疫逃避。研究表明,miR-148 在肾细胞癌中与HLA-G mRNA 直接结合并调控其表达。HLA-G 表达的肾细胞癌细胞系(NIH/3TS)中,miR-152 的过表达能大幅下调HLA-G 的表达并增进 其 对NK 或LAK(lymphokine activated killer)细胞介导的细胞毒性[15]。
结语目前已发现miR-148/152 家族成员在多种恶性肿瘤中差异表达并发挥不同的作用。无论是在组织中上调还是下调,miR-148/152 家族成员都参与靶基因的调节并调控多种信号通路,影响细胞的增殖、分化和凋亡。同时,miR-148/152 家族成员在增强肿瘤对药物敏感性以及免疫逃逸中都发挥了重要作用。miR-148/152 受到其CpG 岛甲基化的调节,并可能存在miR-148a/152-DNMT1 调节环路。尽管近年来对于miR-148/152 家族的研究取得了很大进展,然而,关于其在不同肿瘤和组织中的功能仍不清楚,尤其是miR-148/152 家族在肿瘤的免疫逃逸等多种生物学过程中的功能和分子机制仍亟待更多的研究探讨。
作者贡献声明张一帆 文献查阅,绘制图表,论文撰写和修订。周梁 获取资助,论文指导和修订。
利益冲突声明所有作者均声明不存在利益冲突。
