铁皮石斛羟基肉桂酰基转移酶基因家族生物信息学及其表达分析
2022-06-23龙小琴何基泽李昕燃皮鑫瑶王万军朱乾坤
龙小琴,聂 聪,何基泽,田 野,李昕燃,皮鑫瑶,王万军,朱乾坤
(西南交通大学生命科学与工程学院,四川 成都 610031)
0 引言
【研究意义】铁皮石斛(Dendrobium officinale)是兰科(Orchidaceae)石斛属(Dendrobium)多年生草本植物,富含多种活性成分,具有益胃生津、提高免疫力等功效,同时也可用于口干烦躁、病后虚热以及消化不良等症状的治疗[1]。铁皮石斛含有很多复杂的化学成分,包括生物碱、多糖、黄酮、石斛酚类化合物等[2]。铁皮石斛活性成分之一的黄酮类化合物由黄酮醇、黄烷醇、查尔酮以及花青素等不同的亚类组成[3]。一般情况下,黄酮类化合物以糖苷形式存在,具有抗菌、抗炎、抗氧化和防止血糖病等作用[4]。石斛酚在自然界中广泛存在且数目众多,因其结构中包含大量的羟基所以具有抗氧化、抗病毒以及抗肿瘤等作用[5]。石斛酚作为木质素的前体,与黄酮类化合物合成路径一致,都是通过苯丙烷途径合成[6]。羟基肉桂酰基转移酶(Hydroxycinnamoyl transferase,HCT)是酰基辅酶A 依赖的酰基转移酶,为植物酰基酶家族成员之一,该家族将酰基辅酶A 作为酰基供体,催化底物形成酯类或氨酰化合物。HCT 就是以对香豆酰辅酶A 为酰基供体,将对香豆酰酰基转移到酰基受体莽草酸上,形成对香豆酰莽草酸[7],随后再经过下游途径合成黄酮类化合物和石斛酚。【前人研究进展】 目前羟基肉桂酰基转移酶的研究在多个物种中被报道。Peng 等[8]分析了茄子表达序列标签(EST)的数据库,从Eggplant 和Solanum richardii中分离并鉴定出了精胺羟基肉桂酰转移酶(Sperminehydroxycin namoyl transferase,SpmHCT);张静茹等[9]证实了金银花羟基肉桂酰辅酶A奎宁羟基肉桂酰基转移酶(Quinatehydroxycinnamoyl transferase,HQT)能够在金银花绿原酸(Chlorogenic acid,CGA)的合成中起到正向调控作用。同样在红三叶草中也鉴定出了TpHCT1、TpHCT2,并且证实TpHCT1 参与合成木质素的前体——石斛酚,同时还发现TpHCT2 是一种能够参与咖啡酰苹果酸合成的新型转移酶[10],随后又通过动力学分析证明了TpHCT2 在羟基肉桂酰苹果酸合成途径中起关键作用[11];刘菲等[12]发现核黄素处理烟草悬浮细胞后,其苯丙烷途径中HCT 上游基因苯胺解氨酶(PAL)和HCT 下游基因过氧化物酶(POD)的活性明显上升,并且在代谢产物中酚类物质和木质素的积累显著增加。在拟南芥中,HCT沉默植株表现出植株矮小且发育不良的表型,其木质素含量大幅减小,但是类黄酮的含量积累增加,表明HCT 在这两种化合物的合成上起重要作用[13]。近年来,研究者一共从石斛属众多种类中分离得到89 种黄酮成分,吕朝耕在铁皮石斛中发现10 种黄酮成分[14];林江波等[15]利用高通量测序技术分析了铁皮石斛黄酮代谢途径的相关基因,发现在铁皮石斛中有48 个与黄酮化合物代谢相关的Unigenes,还有14 个与该过程相关的酶;黄彪等[16]利用超高效液相色谱-三重四级杆串联质谱(UPLC-MS/MS)方法对铁皮石斛中18 种酚类物质进行测定,发现铁皮石斛茎、叶、花中酚类物质含量存在差异。【本研究切入点】目前,关于铁皮石斛中黄酮类化合物和酚类物质的研究报道较少,现有报道也大多集中在黄酮化合物以及酚类物质成分检测及功能研究,而对其合成途径以及该途径中关键酶的研究较少。HCT 是在苯丙烷代谢途径合成黄酮化合物以及酚类物质如木质素中发挥重要作用的酶,但目前对于HCT 的研究鲜有报道。【拟解决的关键问题】本文拟对铁皮石斛全基因组中DoHCT基因家族进行生物学信息鉴定,并通过研究该家族基因在铁皮石斛中的表达情况来探讨HCT 的生物学功能。
1 材料与方法
1.1 材料
植物材料为实验室盆栽铁皮石斛(D.officinale)以及1/2 MS 培养基培养的铁皮石斛幼苗。
1.2 铁皮石斛HCT 基因家族的全基因组分析
从NCBI 数据库中下载铁皮石斛HCT 家族的基因组数据,获得该家族成员的基因信息,下载其氨基酸序列并在Expasy ProtParam(https://www.expasy.org/resources/protpar)中获得相应蛋白质的氨基酸长度、等电点和相对分子质量等理化性质。利用Cell-PLoc2.0 进行蛋白质亚细胞定位预测(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)。
1.3 铁皮石斛HCT 家族的系统进化树分析
下载拟南芥(Arabidopsis thaliana)、铁皮石斛(D.officinale)、大豆(Glycine max)、小麦(Triticum dicoccoides)和水稻(Oryza sativa)5 个物种相关蛋白序列并进行系统发育分析,在Clustal W 中进行序列比对,利用MEGA 7 构建系统发育树。
1.4 铁皮石斛HCT 家族的二级结构和三级结构预测及分析
通 过PRABI(https://npsa-prabi.ibcp.fr/cgi-bin/)网站分析HCT 家族的二级结构,输入相应氨基酸序列,其余参数默认,得到蛋白的二级结构图。蛋白三级结构通过SWISS-MODEL(https://swissmodel.expasy.org/interactive)在线网站预测,输入DoHCT 家族成员氨基酸序列,其他参数为默认,选择GMQE 较高的Templates 进行建模,将建好的预测蛋白模型文件在PyMOL 软件进行可视化分析。
1.5 铁皮石斛HCT 家族蛋白保守基序分析
将在NCBI 网站下载的HCT 家族蛋白序列在Clustal W 上进行比对,并通过ESPript3 进行可视化分析。HCT 家族保守基序和保守结构域通过The MEME Suite(https://meme-suite.org/meme/tools/meme)获得,同时结合MEGA 7 构建的进化树在TBtools 工具中得到其保守基序分布图。
1.6 铁皮石斛HCT 家族差异表达分析
1.6.1 模拟胁迫处理 选用实验室铁皮石斛试管幼苗,分别用含5 μmol·L-1ABA、100 mmol·L-1NaCl、10 % PEG 以及40 ℃(高温,HT)、4 ℃(低温,LT)的1/2 MS 培养基模拟胁迫处理6 h,取出幼苗,吸干溶液,每管分装0.2 g 于-80 ℃冰箱保存备用。
1.6.2 铁皮石斛RNA 的提取及逆转录 利用擎科生物科技有限公司(中国成都)的RNAprep Pure 多糖多酚植物总RNA 提取试剂盒分别提取胁迫处理后铁皮石斛试管幼苗的RNA 和盆栽铁皮石斛的根、茎、叶RNA,琼脂凝胶电泳鉴定后用酶标仪测试浓度,并用ddH2O 水将RNA 浓度调至统一,再通过宝生物工程(大连)有限公司的PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit 试剂盒进行逆转录,所得cDNA 于-80 ℃保存备用。
1.6.3 RT-PCR 通过逆转录PCR 分析DoHCT家族在不同胁迫处理下以及根、茎、叶组织中的表达情况,利用GraphPad Prism 进行差异表达绘图以及显著性分析,HCT家族引物设计如表1 所示,EF1-α 为内参基因[17]。差异表达分析的数值为各HCT基因灰度值与内参基因的灰度值相对比值,具体计算方法为:基因表达水平=(基因灰度值-空白灰度值)/(内参灰度值-内参空白灰度值),基因相对表达水平=基因表达水平/对照表达水平。RT-PCR 反应体系为20 μL 体系,所用的2×TSINGKETMMaster Mix 为擎科生物科技有限公司(中国成都)TSE001。反应体系各试剂含量为2×TSINGKETM Master Mix 10 μL;0.1×cDNA 5 μL;Forward primer 0.5 μL;Reverse primer 0.5 μL;ddH2O 4 μL。PCR 反应程序为:98 ℃预变性2 min;98 ℃变性15 s,55 ℃退火15 s,72 ℃延伸1 min,35 个循环;25 ℃延伸10 min。

表1 铁皮石斛DoHCT 家族PCR 引物Table 1 RT-PCR primers for DoHCT family of D.officinale
2 结果与分析
2.1 铁皮石斛HCT 家族蛋白理化性质分析
通过BLAST 检索发现,HCT基因家族一共有8 名成员,分别将其命名为DoHCT1(LOC110107 310)、DoHCT2(LOC110113109)、DoHCT3(LOC110 093424)、DoHCT4(LOC110093422)、DoHCT5(LOC 110093394)、DoHCT6(LOC110114390)、DoHCT7(LOC110092996)和DoHCT8(LOC110095902)。Expasy ProtParam 分析结果表明:铁皮石斛HCT基因家族的8 个HCT 蛋白序列的氨基酸长度在426~454 aa,其中氨基酸序列长度最短的为DoHCT2(426 aa),最长的为DoHCT3(455 aa);相对分子质量在46.80(DoHCT2)~49.29(DoHCT8)kDa,除DoHCT2 等电点(7.24)和DoHCT6 等电点(7.56)大于7 外,其余蛋白等电点均介于 5.64(DoHCT5)~6.47(DoHCT7);蛋白不稳定系数显示除DoHCT2(36.51)和DoHCT7(33.62)不稳定系数小于40,为稳定蛋白,其余DoHCTs 不稳定系数在47.99(DoHCT8)~57.93(DoHCT4),表明其为不稳定蛋白;DoHCTs 脂溶指数在83.38~94.52;亲水指数显示DoHCT4、DoHCT6 和DoHCT7 为疏水性蛋白(亲水指数>0),其余DoHCTs 为亲水性蛋白(亲水指数<0)(表2);另外,通过对HCT 家族蛋白质的亚细胞定位发现,该家族8 个成员均位于细胞质中。
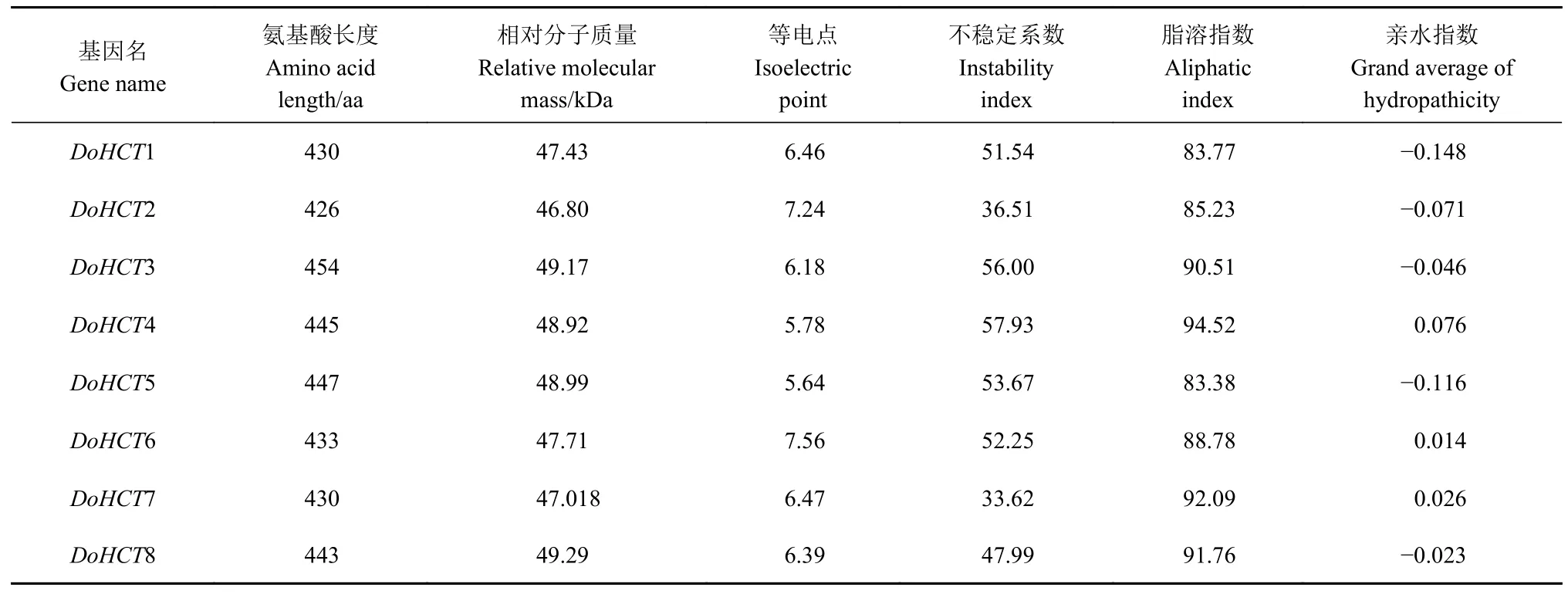
表2 铁皮石斛DoHCT 家族成员基因组信息和蛋白特征Table 2 Genomic information and protein characteristics of DoHCTs of D.officinale
2.2 铁皮石斛HCT 家族系统进化树分析
在NCBI 数据库中分别获得1 个拟南芥(A.thaliana)HCT 蛋白序列、8 个大豆(G.max)HCT蛋白序列、3 个小麦(T.dicoccoides)HCT 蛋白序列、8 个水稻(O.sativa)HCT蛋白序列以及铁皮石斛(D.officinale)的8 个HCT 蛋白序列,利用MEGA7软件对这5 个物种进行系统发育分析。如图1 所示,28 个蛋白分为5 组,其中Group Ⅰ包含9 个基因,约占进化树基因总数的32%;Group Ⅱ和Group Ⅳ分别含有6 个基因,约占进化树基因总数的21%;GroupⅢ和Group Ⅴ分别含有3 个和4 个基因,约占进化树基因总数的10%和14%。铁皮石斛HCT 家族成员分布在Group Ⅰ、Group Ⅱ、Group Ⅲ和Group V 中,其中DoHCT1 和DoHCT2 在Group Ⅰ中,与单子叶植物小麦的TdHCT 以及双子叶植物拟南芥AtHCT 亲缘关系较近;DoHCT3、4 和5 在Group Ⅱ中,DoHCT6在Group Ⅲ中,均与单子叶植物水稻的OsHCT 的亲缘关系较近;DoHCT7、8 分布在Group Ⅴ中,与单子叶植物小麦TdHCT 和水稻OsHCT 亲缘关系较接近;而Group Ⅳ中均为大豆GmHCT,与铁皮石斛的亲缘关系较远。

图1 铁皮石斛DoHCT 家族系统进化分析Fig. 1 Phylogenetic analysis on DoHCT family of D.officinale
2.3 DoHCT 家族保守基序分析
利用ClustalW 以及ESPript3 工具得到DoHCT 1~8 的蛋白多序列比对图(图2),结果表明DoHCT1~6 蛋白序列相似性较高,DoHCT7 和DoHCT8 蛋白序列相似,但与DoHCT 1~6 蛋白序列相似性较弱。
利用MEME 得到铁皮石斛HCT 保守结构基序及分布图(图3)。结果显示,DoHCT1、DoHCT3~5 包含完整的10 个Motif,DoHCT2/6 都含有9 个Motif,不同的是DoHCT2 缺少Motif 9,而DoHCT6则缺少Motif 8。DoHCT7/8 所含有的Motif 较少,其中DoHCT7 缺少Motif 2、Motif 8~10,而DoHCT8只含有Motif 1~4。值得注意的是DoHCT7/8 的保守结构域结果显示其属于转移酶超家族,除了DoHCT7的Motif7 没有在保守结构域里面,其余Motif 都在转移酶超家族的保守结构域里;而DoHCT1~6 保守结构域分析显示其属于PLN02481 超家族,在这个保守结构域内同样包含除了Motif7 的所有Motif。DoHCT7/8的保守结构域相似且与DoHCT1~6 保守结构域有一定差异,这和多重蛋白序列比对(图2)的分析结果一致。

图2 铁皮石斛DoHCT 1~8 多重蛋白序列比对Fig. 2 Sequence alignment of multiple proteins of D.officinale DoHCT1-8

图3 铁皮石斛DoHCT 保守基序及分布图Fig. 3 Distribution of DoHCT conserved motifs of D.officinale
通过NCBI 网站下载铁皮石斛基因组数据,通过TBtools 软件对其进行分析得到铁皮石斛HCT基因结构(图4)。结果显示DoHCT2/4 两个CDS 之间距离较长,内含子占比大,其余DoHCTs内含子占比较小。DoHCT1~8 都只含有两个外显子,其中DoHCT6 的CDS 序列长度在其本身基因结构长度占比最大,而DoHCT3 拥有较长的UTR 序列。

图4 铁皮石斛DoHCT 基因结构Fig. 4 Structure of D.officinale DoHCT
2.4 DoHCT 家族蛋白二级结构和三级结构分析
通过SOPMA 网站输入DoHCT 家族蛋白名称和氨基酸序列,其他参数为默认参数,得到DoHCT 家族蛋白二级结构预测结果(图5),DoHCT 家族各蛋白二级结构信息如表3 所示:其中α 螺旋和无规则卷曲在DoHCT 家族蛋白二级结构中占比较大,β 折叠与β 转角占比较小。DoHCT 家族蛋白三级结构预测结果显示,DoHCT1~8 的模板覆盖率分别为67.37%、65.26%、42.79%、40.48%、40.43%、38.65%、42.92%和24.82%。其中覆盖率最大为DoHCT1(67.37%)、覆盖率最小的为DoHCT8(24.82%)(图6)。

表3 铁皮石斛DoHCTs 蛋白二级结构信息Table 3 Information on secondary structure of D.officinale DoHCTs protein

图5 DoHCTs 蛋白二级结构预测Fig. 5 Predicted DoHCTs protein secondary structure

图6 铁皮石斛DoHCTs 蛋白三级结构预测Fig. 6 Predicted 3-D structure of D.officinale DoHCTs protein
2.5 DoHCT 基因家族差异表达情况分析
2.5.1DoHCT基因家族在根、茎、叶中的表达分析DoHCT家族成员中除DoHCT7 在铁皮石斛根、茎、叶中未检测到表达之外(图7),其余成员在铁皮石斛的根、茎、叶中均有表达。与根的相对表达相比,DoHCT1、4 在茎和叶中表达量较低,而DoHCT3、5、6 在茎和叶中表达量较高;DoHCT8则是在茎中表达量高、叶中表达量低;DoHCT2 在根茎叶中的表达水平无明显差异。
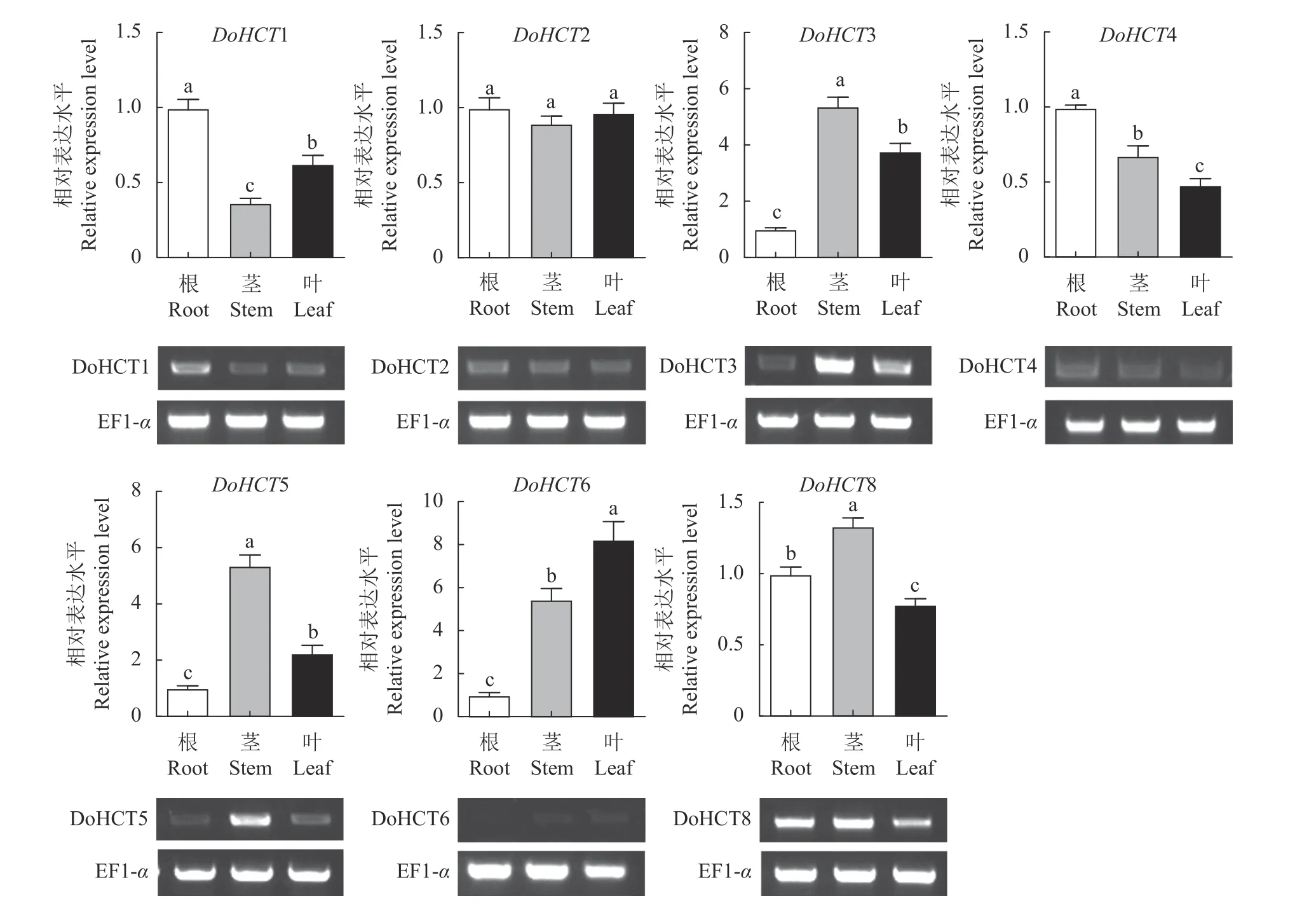
图7 DoHCTs 在根茎叶中的相对表达水平Fig. 7 Relative expressions of DoHCTs in roots,stems,and leaves
2.5.2 铁皮石斛DoHCT家族胁迫处理表达分析 通过ABA、NaCl、PEG、40 ℃(高温)和4 ℃(低温)5 种不同胁迫条件下处理6 h 后的基因表达结果显示(图8):ABA 处理下,表达显著下调的基因有DoHCT3、DoHCT5 和DoHCT6,DoHCT2、7 显著上调;在盐胁迫处理(NaCl)中DoHCT4 表达显著上调,DoHCT3、5、8 表达均显著下调,其余DoHCTs与对照相比无明显差异;PEG 处理后,除DoHCT8 表达与对照相比不明显以及在DoHCT7 中未检测到其表达以外,其余基因明显下调,且DoHCT3下调最为显著。值得注意的是DoHCTs在高温(HT)胁迫下表达均下调,在DoHCT4、7 中未检测到其表达;在低温胁迫(LT)中,DoHCT1、2、8表达显著上调,DoHCT4、6表达显著下调,而DoHCT3、5、7 的表达与对照相比无明显差异。

图8 DoHCTs 在不同胁迫处理下的相对表达水平Fig. 8 Relative expression levels of DoHCTs under different stresses
3 讨论与结论
铁皮石斛作为我国传统中药材,具有较高的药用价值。它不仅可以入药,还能加工成保健用品,同时也可用于制作化妆品[18]。铁皮石斛中黄酮类化合物和石斛酚具有多方面的生物活性。现有研究表明,黄酮类化合物在抗氧化、抗衰老以及免疫调节等方面效果显著[3,19]。石斛酚也同样具有多种药理作用。HCT 作为苯丙烷途径中合成黄酮和木质素两种物质分支点的重要酶,能够调控木质素与黄酮的含量,研究显示,沉默拟南芥AtHCT会使得木质素减少,黄酮化合物大量积累[6],这一观点被Chen 证实,他们通过在烟草和拟南芥中过表达CsHCTs,发现两种植物的酚类物质和木质素的含量都增加而黄酮含量降低[20]。Sebastien 等[13]发现在拟南芥中HCT 沉默株生长表型依赖于苯丙烷途径中查尔酮合成酶的表达,查尔酮合成酶的表达会使得植物种类黄酮化合物含量增加。
铁皮石斛多生长在悬崖峭壁,当其遭受到环境胁迫时,会形成一些次生代谢产物来应对胁迫的干扰,比如花青素、黄酮类、酚类、苯丙素等[20],现研究已证明酚类化合物如木质素以及黄酮化合物能够提高植物的抗性[13]。本试验发现,在NaCl、PEG和LT(低温)处理下,大部分HCT 基因的表达都下调,这与Chen 等[20]的结果一致。而张新业等[21]发现菊芋HtHCT同样能够响应NaCl 和PEG 的胁迫,HtHCT在NaCl 和PEG 的胁迫下其表达量均显著高于对照,这与本试验结果有出入,这可能与不同物种的HCT在面对胁迫时的表达存在差异有关。ABA 胁迫处理后,DoHCT3、5、6 显著下调,DoHCT2、7 显著上调,尤其是DoHCT7,其表达量显著高于野生型,由此我们推测DoHCT7 可能参与了ABA 信号通路,但还有待进一步证实。除了响应ABA 外,菘蓝IiHCT也能够响应外源茉莉酸甲酯(MeJA),且在 MeJA 的处理下IiHCT的相对表达量显著升高[22]。组织差异表达分析发现DoHCTs可以在植物不同组织中表达,DoHCT1、4 在根中表达量较高,与树莓PoptrHCT1、3、4、5在根中的表达一致[23],而DoHCT3、5、6 在茎和叶中表达量较高,说明DoHCTs在不同的组织中功能有所差异。综上,本文通过对铁皮石斛HCT 家族成员进行分析和鉴定,探讨了DoHCTs的生理生化性质特点、在不同胁迫处理下以及铁皮石斛根茎叶中的差异表达情况,证实了其在非生物胁迫应答中起作用,为后续深入研究铁皮石斛黄酮类化合物和石斛酚的生物合成提供数据支持。
