四川省马铃薯孢囊线虫的形态和分子鉴定
2022-06-23顾建锋邵宝林方亦午马欣欣李星月郑经武
顾建锋,邵宝林,方亦午,马欣欣,3,李星月,郑经武
(1.宁波海关技术中心/宁波检验检疫科学技术研究院,浙江 宁波 315100;2.成都海关技术中心,四川 成都 610041;3.中盛产品检测有限公司,浙江 宁波 315100;4.四川省农业科学院植物保护研究所,四川 成都 610066;5.浙江大学农业与生物技术学院,浙江 杭州 310012)
0 引言
【研究意义】马铃薯是世界上第三大、我国第四大粮食作物,是集粮食、蔬菜、饲料和工业原料于一身的优势作物。中国是世界马铃薯生产种植大国,四川种植面积则居我国首位,约73 万hm2。2012 年至今,四川省马铃薯种植面积和总产连续全国第一,马铃薯产业已经逐渐成为四川省农业增产、农民增收的一大支柱产业。近年来,四川省将马铃薯产业列为四川省特色优势农业产业,大力推进马铃薯主粮化开发战略,依靠得天独厚的地理优势和健全的良种繁育体系,极大地推动了马铃薯产业的快速发展。但在加强育种和外来品种引进力度的同时,马铃薯孢囊线虫的传入扩散风险也在加大。马铃薯孢囊线虫的监测研究对马铃薯产业的可持续发展具有重大意义。【前人研究进展】马铃薯孢囊线虫主要包括马铃薯金线虫(Globodera rostochiensisSkarbilovich,1959)[1]和马铃薯白线虫(Globodera pallidaBehrans,1975)[2],是严重威胁马铃薯产业的重要病原线虫,危害非常严重,是国际公认的最重要检疫性有害生物,也是我国重要的进境植物检疫性有害生物,2020 年被列入农业农村部《全国农业植物检疫性有害生物名录》。据国外报道,马铃薯金线虫一般会造成马铃薯减产20%,在热带地区,危害严重时造成产量损失80%~90%,甚至绝收[3]。为防止其传入,长期以来我国一直禁止马铃薯种薯的商业引进,目前尚未批准任何食用马铃薯的输入。【本研究切入点】2021 年6 月,笔者在四川省越西县发现马铃薯田块部分植株较矮,叶片黄化,长势较差,挖取植株根部,发现根系上有淡黄色至金黄色的球形孢囊,疑似马铃薯孢囊线虫侵染。目前我国尚未发现马铃薯孢囊线虫,因此亟需对该病原进行鉴定。【拟解决的关键问题】对马铃薯孢囊线虫进行分离和形态学、分子生物学鉴定,以期明确病原线虫种类,为进一步开展马铃薯孢囊线虫的监测、鉴定和防控提供参考。
1 材料与方法
1.1 样品采集
样品采自越西县竹阿觉镇古二乡马铃薯种植田块(102°41′37.3″E;28°25′46.8″N;海拔2 315.1 m),种植的马铃薯为青薯9 号种,采集时间为马铃薯花期。针对马铃薯生长不良、矮化的田块,多点采集根围土壤混合样品各约500 g,同时将马铃薯苗连根拔起,观察并采集少许根系。
1.2 线虫分离
土壤中的二龄幼虫采用改良漏斗法(宁波市镇海百川生物科技有限公司)进行线虫分离。称取土壤100 g,用双层纱布包裹,置于加有适量水的漏斗中(水量以刚盖没土壤为宜),25 ℃恒温培养24 h 后,用表面皿接取5~10 mL 线虫分离液,在Zeiss Stemi 305 解剖镜下观察是否有线虫。
土壤中的孢囊采用简易漂浮法分离。称取风干土壤100 g,置于2 000 mL 的三角瓶中,加水至水深5 cm 左右后充分摇晃,随后边加水边搅动,直至水面至瓶口处,静置片刻。将瓶口的漂浮物通过20 目和100 目滤,将100 目筛上的收集物轻轻倒入有滤纸的漏斗中过滤。过滤完毕后取滤纸在解剖镜下观察孢囊并计数。
用解剖刀切破较新鲜的孢囊,可见其中有大量虫卵。用移液器将适量虫卵转移到载玻片上,盖上盖玻片,轻轻用手指按压,部分虫卵破碎,游离出来的线虫即为孢囊线虫二龄幼虫(J2)。
1.3 形态学鉴定
1.3.1 孢囊阴门锥制作 将孢囊转移到塑料培养皿上的水滴中,于解剖镜下用解剖刀切下孢囊的后端(即颈部的对面一侧)部分,用竹针或0 号狼毛笔轻轻剔除阴门锥内的黏附物和卵,用解剖刀适当修整阴门锥的边缘。然后取一片干净的载玻片,在中间加一小滴甘油,在解剖镜下用挑针将上述修整好的阴门锥移至甘油滴的中央,用挑针往下压,使其外表面向上。在甘油滴两边对称放置两块小蜡块,加盖玻片,于64 ℃的加热板上加热,待蜡块融化后自然冷却,用中性树胶封片。
1.3.2 显微镜观察摄影及测量 用Zeiss Imager Z1 显微镜和Axioscop MRm 数码相机对J2、孢囊、阴门锥的整体形态和内部特征进行观察、摄影和测量。
1.4 根系内部线虫染色
马铃薯花期采集植株根系,采用幼苗根系次氯酸钠——酸性品红整体染色[4-5]。观察根系内部孢囊线虫的侵染情况。
1.5 分子生物学鉴定
1.5.1 孢囊和幼虫DNA 的提取 取分离得到的3 个孢囊和6 条二龄幼虫,参照王江岭等[6]的方法分别提取DNA,于-20 ℃保存待用。
1.5.2 种特异性PCR 鉴定 使用ITS5 和PITSr3 引物[7]对获取的DNA 样品进行PCR 扩增,反应同时设置一组阴性对照及一组空白对照,阴性对照的DNA 模板为大豆孢囊线虫。反应体系(25 μL):10×PCR Buffer(Mg2+free)2.5 μL,25 mmol·L-1MgCl22 μL,2.5 mmol·L-1dNTP Mix 2 μL,10 μmol·L-1引物各0.5 μL,5 U·μL-1TaqDNA 聚合酶0.4 μL,模板DNA 2 μL,ddH2O 补足。反应程序:94 ℃ 3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,35 个循环;72 ℃ 5 min。进行PCR 扩增后将产物在添加Gelred 染料的1×TAE溶液制成1%的琼脂糖凝胶电泳,以DL100 bp(TaKaRa)为Marker,用紫外凝胶成像仪观察并照相,以确认扩增是否有效。扩增产物片段大小与Marker进行比较。剩余扩增产物送杭州擎科生物技术有限公司双向测序。
1.5.3 线虫核糖体基因扩增和测序分析 分别取单个孢囊和2 条二龄幼虫的DNA 模板,采用核糖体rDNA 部分18S 基因扩增引物:988(5′-CTCAAAGA TTAAGCCATGC-3′)和 1912(5′-TTTACGGTCAG AACTAGGG-3′);1813(5′-CTGCGTGAGAGGTG AAAT-3′)和2646(5′-GCTACCTTGTTACGACTTT T-3′)[8],核糖体rDNA 28S 基因D2~D3 区扩增引物391A(5′-AGCGGAGGAAAAGAAACTAA -3′)和501(5′-TCGGAAGGAACCAGCTACTA-3′)[9],核糖体rDNAITS区扩增引物TW81(5′-GTTTC CGTAGGTGAACCTGC-3′)和AB28(5′-ATATGC TTAAGTTCAGCGGGT-3′)[10],进行上述基因PCR扩增。上述引物由上海英骏生物技术有限公司合成,PCR 扩增程序参照各引物所在文献[8-10]。进行PCR扩增后将产物在添加Gelred 染料的1×TAE 溶液制成1%的琼脂糖凝胶电泳,以DL100 bp(TaKaRa)为Marker,用紫外凝胶成像仪观察并照相,以确认扩增是否有效。18S 基因和28S 基因D2~D3 区扩增产物由杭州擎科生物科技有限公司进行双向测序,ITS序列直接测序不能获得有效序列,由上述公司进行克隆测序。
使用ChormasPro 软件对测序得到的双向峰图文件进行拼接,剔除测序结果两端多余碱基后,得到用于后续比对和系统进化分析的序列。登陆NCBI 网站中的BLAST(Basic local alignment search tool)页面(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对。在GenBank 中下载已登录的各近似种(球孢囊线虫属)的部分序列,在Clustal[11]的默认设置下进行序列比对,并在MEGA 软件下使用p-distance 设置对所得序列及其近似类群进行两两序列相似度计算(Pairwise Distance)。
通过jModeltest 软件[12],以甜菜孢囊线虫(Heterodera schachtiiMW834323)和大豆孢囊线虫(Heterodera glycinesEF611124)为外群,对得到的序列比对文件在赤池信息量准则(Akaike information criterion,AIC)标准下进行核苷酸替换模型的评估,得到相应的支持模型。使用MrBayes 3.2.3 软件[13]对得到的序列比对文件进行贝叶斯法系统进化树的构建,根据所获得的核苷酸替换模型,参照Ronquist等[13]的说明对程序做出设定。在4 条马尔科夫链(Markov Chain)下独立进行3 条热链和1 条冷链的5× 107次运行,每1 000 次运行进行一次抽样,剔除前25%可能未处于稳态时的系统进化树。采用多数一致(50%)原则,用MCMC(Markov Chain Monte Carlo)方法评估所获得贝叶斯系统进化树的后验概率值[14],在TreeGraph 2 软件中对系统进化树进行查看和编辑[15]。
2 结果与分析
2.1 田间症状
采样田块马铃薯植株较矮,叶片黄化,长势较差。拔起植株可看到部分根系上有淡黄色至金黄色的球形颗粒,为球孢囊属线虫的雌虫或孢囊(图1)。其数量较大,肉眼可见,多的有数百粒以上。

图1 四川越西马铃薯金线虫根部雌虫和孢囊Fig. 1 Cyst and female adult of G.rostochiensis on potato roots from Yuexi,Sichuan
2.2 形态特征描述
100 g 风干土壤用漂浮法分离获得孢囊100 多个,用改良漏斗法分离获得大量孢囊线虫二龄幼虫,但未发现雄虫。
雌虫:虫体近球形,具突出的颈部。白色至淡黄色。头部具有融合的唇和1 或2 个明显的唇片。颈部环纹不规则,大多数体壁变成网纹型脊,头骨架发育弱。口针锥部约占口针长的50%,与杆部区别明显,口针基部球向后倾斜,口针从头架延伸到口针长约75%处。中食道球大,几乎球形,瓣门呈新月形。排泄孔明显,位于颈基部。双卵巢充满整个体腔。阴门横裂,周围角质层轻微环形凹陷,形成阴门膜孔。阴门位于两个细的唇突状新月形区域之间。肛门与阴门膜孔间角质层约有12 个平行的脊,少数交叉相连。
孢囊(图2):孢囊球形或近球形,颈部突出,尾部圆滑,无任何突起的圆锥体状结构。其色泽金黄或黑褐色。表皮层具有“Z”字形的脊状纹。阴门锥为单环膜孔型,无阴门桥、下桥和其他内腺突,无泡状突。卵存在于孢囊中,不形成卵囊。新鲜孢囊的阴门区完整,但较老的孢囊标本部分或全部阴门膜孔丢失。肛门明显,不形成膜孔,有时可见“V”形结构。

图2 四川越西马铃薯金线虫孢囊及阴门锥Fig. 2 Cyst and cyst vulval basin of G.rostochiensis from Yuexi,Sichuan
二龄幼虫(图3):分离得到各种线虫的混合物。根据口针强壮、长约20 μm、基部球显著膨大且为幼虫的特点,容易将孢囊属线虫与其他各种线虫区分。共计分离到孢囊属线虫二龄幼虫约500 条,蠕虫形,角质层环纹规则,侧区4 条侧线。热杀死后虫体通常略腹弯,体长405~444 μm。头部圆形,轻微缢缩,4~6 个环纹。口针强壮,长19.4~21.9 μm,口针基部球近圆形,略向后倾斜,前面较平,口针锥部约占口针长的50%。食道腺向后延伸至约35%体长处。排泄孔位于近尾部约20%体长处。半月体明显,2 个体环长,位于排泄孔前1 个体环处。尾部渐变细,末端细圆,透明尾约占尾长的1/2。

图3 四川越西马铃薯金线虫卵和二龄幼虫Fig. 3 Eggs and J2s of G.rostochiensis from Yuexi population
2.3 二龄幼虫(J2)和孢囊形态测量值
对四川越西群体20 条J2 和15 个孢囊进行测计,并与国外马铃薯金线虫参考文献的资料进行比较,结果见表1。

表1 四川越西群体孢囊线虫样品与国外马铃薯金线虫测计值比较Table 1 Morphometrics of cyst and J2 of Yuexi and foreign G.rostochiensis
四川越西群体的孢囊呈球形、金黄色,阴门膜孔之间角质层脊数15~24 个,Granek 比值为2.7~4.7,二龄幼虫口针长度19.4~21.9 μm,口针基部球近圆形、略向后倾斜、前面较平,DGO 距离3.0~5.2 μm,透明尾长17.7~25.0 μm。上述特征或测计值均与马铃薯金线虫相符。
2.4 根系内部线虫染色结果
经根系透明染色后,可观察到根内有大量线虫寄生,呈粉红色(图4),其体长约400 μm,体宽略短于20 μm,和表2 中的测计值相符。进一步形态特征观察表明其与上述孢囊线虫二龄幼虫一致,因此该种线虫能入侵马铃薯根系内部。

图4 马铃薯根系内染色后的二龄幼虫Fig. 4 Stained J2s on potato roots
2.5 线虫的分子生物学鉴定
2.5.1 特异性引物扩增 特异性引物扩增后,所测试的3 个孢囊和4 条二龄幼虫均得到了430 bp 左右的明亮条带(图5),和预期的434 bp 马铃薯金线虫种特异条带大小相一致。进一步测序后得到的序列长度均为434 bp,blast 比对分析发现,和Genbank 数据库中的马铃薯金线虫序列相似度为100%。
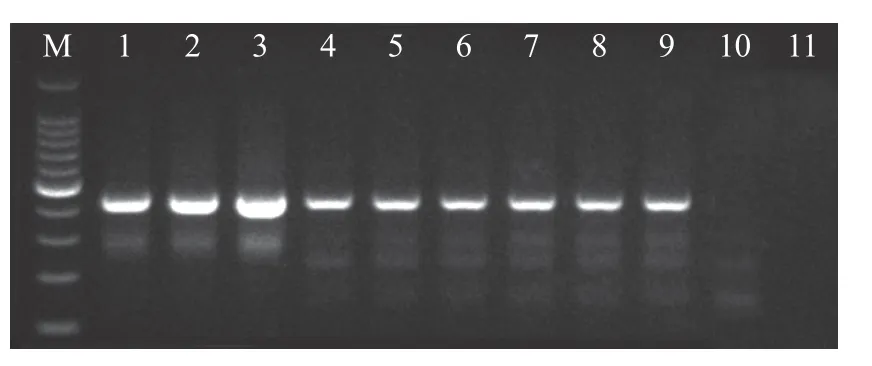
图5 四川越西马铃薯金线虫样品特异PCR 电泳图Fig. 5 Specific PCR electrophoresis of G.rostochiensis from Yuexi population
2.5.2 核糖体基因DNA 序列分析 对该四川越西分离得到的线虫群体进行核糖体rDNA 18S 区基因扩增测序,3 个模板获得的片段大小均为1 740 bp,GenBank登录号为MZ613180。该四川越西群体和其他国家和地区所报道的马铃薯金线虫群体18S 基因序列相似度为 99.41%(AY593877 1 696/1 701 bp)~ 99.94%(KJ636271 1 700/1 701 bp),和其他马铃薯白线虫的序列相似度为99.53%(Globodera pallidastrain GlobPal10 KJ636269)~99.77%(Globodera pallidaisolate GlobPal3 AY284620),和其他球孢囊属线虫的序列相似度为99.12%(Globodera achilleaestrain GlobAch2 KJ636274)~100%(Globodera tabacumisolate 1094 FJ040401 1 701/1 701 bp)。因此,核糖体rDNA 18S 区基因无法准确区分球孢囊属具体种类,但能明确该群体属于球孢囊属。
该群体的核糖体28S 区基因扩增测序所得片段大小均为953 bp,GenBank 登录号为MZ613167。该类群和其他国家和地区所报道的马铃薯金线虫群体28S 基因序列相似度为 99.06%(AY592987 947/956 bp)~ 100%(MK311333 953/953 bp),和马铃薯白线虫(G.pallida)的28S 序列相似度为97.59%(EU855119 932/955 bp)至 98.89%(LT159821 711/719 bp);和艾草球孢囊线虫(G.artemisiae)的28S 序列相似度为98.01%(EU855121 937/956 bp)~98.19%(MT233316 702/720 bp);和烟草球孢囊线虫(G.tabacum)的28S序列相似度为99.40%(GQ294492)。同样,核糖体rDNA 28S 区基因无法准确区分球孢囊属一些种类,但能明确该四川越西群体属于球孢囊属。
该群体的核糖体ITS区基因扩增产物直接测序失败,经克隆测序后,得到2 条序列,长度分别为1 040 bp 和1 041 bp,GenBank 登录号为MZ613152 和MZ613153,两序列相似度为99.33%(1 035/1 041 bp)。该四川越西群体和其他国家和地区所报道的马铃薯金线虫群体ITS基因序列相似度最高,为 97.90%(JF907553 981/1 002 bp)~ 99.90%(GQ294513 1 040/1 041 bp),同时和其系统发育关系中的烟草球孢囊线虫的序列相似度为 97.26%(FJ667945 924/950 bp)~ 97.90 %(GQ294525 1 024/1 045 bp),和 马铃薯白线虫的序列相似度最高为 96.5%(LT159833)。从系统发育树(图6)上可以看出,该四川越西群体和其他国家和地区所报道的马铃薯金线虫群体(源于NCBI 网站)聚类在了具高置信度(后验证概率=100)同一分支,表明该四川越西群体确为马铃薯金线虫。

图6 基于四川越西马铃薯金线虫与近似种ITS 区DNA 序列的系统发育树Fig. 6 ITS phylogenetic tree of G.rostochiensis from Yuexi population and similar Globodera species
2.6 鉴定结论
孢囊属线虫属于孢囊线虫亚科,该科常见的有球孢囊线虫属线虫Globodera、刻点孢囊线虫属线虫Punctodera、仙人掌孢囊线虫属线虫Cactodera、孢囊线虫属线虫Heterodera[19]。刻点孢囊线虫属孢囊呈卵形、肛门区域形成膜孔;仙人掌孢囊线虫属孢囊呈柠檬形、有简化的阴门锥;孢囊属线虫呈柠檬形、有突出的阴门锥;而球孢囊属线虫孢囊呈球形、无阴门锥、肛门区不形成膜孔,可与近似属明显区分。该四川越西线虫群体孢囊呈球形、无阴门锥、肛门区不形成膜孔,明显为球孢囊属线虫。
据Subbotin 等[19]报道,球孢囊属线虫包括10 种线虫。此后,2012 年美国Idaho 州发现艾灵顿氏球孢囊线虫G.ellingtonae[20],2013 年,南非杂草上发现西开普敦球孢囊线虫G.capensi[21],2017 年南非发现厄加勒斯球孢囊线虫G.agulhasensis[22],在南非杂草上又发现桑德维尔德球孢囊线虫G.sandveldensis[23]。因此,目前已经报道的球孢囊属线虫共计14 种[23,24]。据Subbotin 等[19]的检索表,G.mali孢囊角质层薄、透明;G.zelandica二龄幼虫口针平均长度≥27 μm;G.leptonepia二龄幼虫口针平均长度<19 μm;G.bravoae二龄幼虫透明尾长>31 μm 。G.capensis、G.millefolii、G.artemisiae、G.agulhasensis、G.sandveldensis等5 种线虫大多寄生于菊科植物,Granek 比值平均值≤2。因此待测样品很容易与上述9 种线虫区分。四川越西群体与烟草孢囊线虫G.tabacum的区别是肛门和阴门膜孔之间角质层脊数[18(15~24)个vs 7(5~15)个];和G.ellingtonae的区别是肛门和阴门膜孔之间角质层脊数[18(15~24)个 vs 13(10~18)个];与墨西哥孢囊线虫G.mexicana的区别是Granek 比值:平均3.7 vs 2.8。
根据寄主和形态特征,四川越西孢囊线虫群体容易与其他线虫进行区分,最相似的为马铃薯白线虫。与马铃薯白线虫的区别是雌虫和孢囊颜色(雌虫白色逐渐变黄,变成金黄或褐色的孢囊vs 雌虫白色,变成褐色的孢囊),J2 体长略短(405.0~443.5 μm vs 440~525 μm),J2 口针长略短[20.2(19.4~21.9)μm vs 23.6(21~26)μm],J2 尾长略短[46.8(40.0~51.0)μm vs 51.9(46~52)μm],J2 口针基部球形态(近圆形、略向后倾斜、前面较平vs 前表面向前突起),肛门和阴门膜孔之间角质层脊数[18(15~24)个vs 12.2(8~20)个],肛门至膜孔距离(43~76 μm vs 88~102 μm),Granek比值[3.7(2.7~4.7)vs 2.2(1.2~3.6)][3,25]。
该四川越西线虫群体与马铃薯金线虫形态学基本一致。特异PCR 方法、核糖体DNA 序列分析,尤其是其ITS基因序列与已经登录的马铃薯金线虫十分近似,相似度高达99.9%,且与马铃薯白线虫的相似度最高只有96.5%。因此,形态学和分子生物学方法均支持该线虫为马铃薯金线虫。
3 讨论与结论
马铃薯金线虫为害隐蔽,潜伏期长,侵染早期植株没有明显的症状,仅通过田间观察很难确认是否有该线虫为害。严重危害时,能导致寄主黄化、坏死、萎蔫、矮化甚至死亡,但上述症状与缺水缺肥等症状很难区分,常常需要采集土壤和根系样品,在实验室进行孢囊或幼虫的分离鉴定。镜检观察孢囊呈球形、无阴门锥、肛门区不形成膜孔,可判断该线虫属于球孢囊属;再根据二龄幼虫口针基部球近圆形,向后倾斜;口针平均长<23 μm;Granek比值≥3,可判断为马铃薯金线虫。
线虫体型微小,鉴定特征十分细微,形态学鉴定需要丰富的经验。因此,分子生物学方法是线虫鉴定的重要辅助手段。根据EPPO[25]的方法,本研究采用Bulman &Marshall[7]报道的马铃薯金线虫特异性引物ITS5 和PITSr3 对线虫孢囊或二龄幼虫进行PCR 扩增,电泳和测序结果表明,扩增产物为434 bp,与报道的马铃薯金线虫特征片段完全一致。同时,本研究对四川越西群体核糖体rDNA 18S、rDNA 28S 和ITS基因进行克隆、测序和分析发现,该群体18S 和28S 序列与马铃薯金线虫和马铃薯白线虫的序列相似度均较高,但难以区分具体种类,仅可以确定该线虫属于球孢囊属线虫。核糖体ITS基因序列分析表明,该种线虫和国外报道的马铃薯金线虫群体ITS基因序列相似度最高,系统发育树结果也表明该群体和其他国家和地区所报道的马铃薯金线虫群体聚类在了具高置信度(后验证概率=100)同一分支,证实四川越西群体确为马铃薯金线虫。因此,ITS基因作为分子靶标在球孢囊线虫的种类鉴定中较为有效,推荐用特异性PCR 方法或ITS基因对马铃薯金线虫进行分子鉴定。
随着经济全球化和国际贸易的日趋频繁,马铃薯金线虫已经随马铃薯种质资源等的私人携带、交换或其他根系材料的引种而传入我国。李建中等[26]用生态位模型GARP 和MaxEnt 对马铃薯金线虫和白线虫在我国的适生区进行了分析,结果表明,云南东北部、贵州、重庆、四川东部、湖南、湖北南部、山东南部、河南、安徽和江苏等省市为马铃薯金线虫中高风险区。由于该线虫在我国具有适生区域广、防控难度大、潜在危害损失高和社会影响巨大等特点,一旦传入和定殖扩散,根除十分困难。在没有寄主作物的情况下,其孢囊能在土壤中存活20 年以上[27]。因此建议在疫情发生区域采取严格的应急控制措施,力争消灭,同时在疫情周围及高风险区域设立监测点,严控疫情点的马铃薯和其他根茎类材料的跨区域调运,严防疫情扩散。鉴于马铃薯金线虫的为害经济重要性,需尽快完善马铃薯孢囊线虫疫情监测及防控技术体系,加强马铃薯种薯的检疫监督管理,开展马铃薯金线虫全国普查,增加马铃薯金线虫防控技术的研发投入,为我国马铃薯主粮化产业健康可持续发展保驾护航。
