卡介苗新菌种单细胞克隆株NIFDC 945 SⅢ免疫效应及安全性的初步评价
2022-06-23江秋虹张健程琛舒赵爱华陶立峰蒲江付丽丽王国治
江秋虹,张健,程琛舒,赵爱华,陶立峰,蒲江,付丽丽,王国治
1.安徽智飞龙科马生物制药有限公司,安徽 合肥 230088;2.中国食品药品检定研究院,北京 102629
WHO 发布的《2019年全球结核病报告》表明,结核病仍是全球十大人类死因之一,每年有数百万人罹患结核病[1]。新型结核病预防体系由初免(primer)策略、初免-加强免疫(primer-boost)策略及潜伏感染人群免疫预防性治疗策略构成。卡介苗(Bacillus Calmette-Guerin vaccine,BCG)是 WHO 推荐唯一可用于预防结核病的初免用疫苗[2]。目前,已有若干新候选结核病疫苗进入临床试验,但均未取得理想效果[3-4],因此,BCG 对结核的保护效果成为研究焦点[5-6]。2018年,WHO 立场文件报告建议进行优化BCG 接种的研究[2],其中以 BCG 加强免疫为研究重点[7-8]。
目前,国内已上市的BCG 制品规格为0.05 mg/人份单一剂量,仅适用于新生儿的初免,加强免疫需研发安全有效的成人BCG。影响BCG 保护力和安全性的最主要因素之一是菌种的选择,国际上应用较多的BCG 生产用菌种包括法国巴斯德株(Pasteur 1173 P2)、丹麦 1331 株(Danish 1331)、巴西株(Mearou RJ)、俄罗斯株(Moscow 368)、保加利亚株(Sofia SL222)和日本 172 株(Tokyo-172-1)等,不同 BCG 菌种遗传特性不同[9],我国现用BCG 生产用菌种为D2PB302株。20 世纪 70年代,DAM 等[10]研究表明,虽然各国制造BCG 菌株均来源于法国巴斯德研究所,但由于当初菌株采自混合菌落,菌种存在不均一性,各菌株间的免疫力和毒力均存在差异。在成人BCG 生产用菌种研究过程中,为克服上述差异,2009年,中国食品药品检定研究院将我国早期冻干的BCG 菌种进行复苏并扩增传代,获得NIFDC 944 株(国内外总计传代944 代),2014年以微孔滤膜方式从中获得目前唯一的1 株BCG 单细胞克隆菌种NIFDC 945 SⅢ株[11],该菌株一致性良好。
本研究以BCG 单克隆原始菌种NIFDC 944 株、国外已上市BCG 的生产株Danish 1331 和国内已上市BCG 的生产株D2PB302 为对照,通过脾激活和脾活菌数试验,检测NIFDC 945 SⅢ株菌种免疫效应和安全性,以评价其作为BCG 候选疫苗株的可行性,为BCG 加强免疫研究的开展提供临床前研究依据。
1 材料与方法
1.1 菌株 BCG 单克隆原始菌种NIFDC 944 株、BCG 单细胞克隆菌种NIFDC 945 SⅢ株、国外已上市BCG 的生产株Danish 1331 和国内已上市BCG的生产株D2PB302 均由中国食品药品检定研究院提供。
1.2 主要试剂 罗氏鸡蛋培养基及稳定剂由安徽智飞龙科马生物制药有限公司制备;0.9%氯化钠(500 mL / 瓶)购自四川科伦药业股份有限公司。
1.3 实验动物 SPF 级 BALB / c 小鼠,150 只,雌性,体重16 ~ 20 g,4 ~ 5 周龄,购自扬州大学比较医学中心,动物生产许可证号为:SCXK(苏)2012-0004。小鼠于安徽智飞龙科马生物制药有限公司动物实验室中饲养,每笼6 只,每周换窝3 次,自由取食和饮水。本实验对小鼠的所有处理均以科研为目的进行养殖和使用,且按照动物伦理相关规定进行(批准文号为:皖智龙生药[2016]9 号)。
1.4 BCG 菌液的制备 将BCG NIFDC 944 株、NIFDC 945 SⅢ株、Danish 1331 株、D2PB302 株按相同条件分别复苏至罗氏鸡蛋培养基上[12],于37 ~39 ℃条件下培养2 ~ 3 周,收集罗氏鸡蛋培养基培养物,加入无致敏源稳定剂,稀释为2 mg / mL 的菌悬液,即为BCG 菌液。
1.5 动物分组及给药 将150 只小鼠随机分为5 组:BCGNIFDC944、BCGNIFDC 945 SⅢ、BCG Danish 1331、BCG D2PB302 及对照组,每组30 只。前4 组免疫剂量均为 1 mg /(0.5 mL·只),对照组按 0.5 mL / 只免疫0.9%氯化钠溶液,均经尾静脉注射。
1.6 各组小鼠脾激活指数的检测 分别于免疫后24 h 及 1、3、6、9、12 周,每组各取 5 只小鼠,称量体重,断颈处死,无菌取出脾脏,称量脾重,按下式计算脾激活指数。

1.7 各组小鼠脾内BCG 存活率的检测 于免疫后24 h及 1、3、6、9、12 周,每组各取 5 只小鼠,无菌取脾脏,整块置研磨器中,加入3 mL 0.9%氯化钠溶液进行研磨,制备成脾细胞悬液,取0.5 mL,用0.9%氯化钠溶液进行10 倍系列稀释,制备成3 种不同浓度(100、10-1、10-2倍稀释)的脾菌悬液,接种至罗氏培养基,0.1 mL / 支,各组均设 3 支,于 37 ~ 39 ℃静置培养4 周后,进行菌落计数,并按下式计算小鼠脾内存活率。

1.8 统计学分析 应用GraphPad Prism 5 软件作图并进行统计学分析,实验结果均以均值 ± 标准差()表示,组间比较采用多重 t 检验,以 P < 0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠的脾激活指数 NIFDC 945 SⅢ、NIFDC 944、D2PB302、Danish 1331 组小鼠免疫后 12 周内的脾激活指数均 >2,变化趋势相似,1 ~ 3 周脾激活指数逐渐增加,3 周时均达最大值,3 ~ 12 周均有不同程度下降。
3 和 6 周时,NIFDC 945SⅢ组小鼠脾激活指数显著低于 NIFDC 944 组(t 分别为3.025 和 5.003,P 分别为 0.004 和 0.000);免疫后 1、3、6、9、12 周,NIFDC 945 SⅢ组小鼠脾激活指数显著低于Danish 1331 组(t 分别为 4.211、4.200、4.170、2.223、3.338,P 分别为 0.000、0.000、0.000、0.030、0.001),免疫后24 h 及 1、3、6、9、12 周,NIFDC 945 SⅢ组小鼠脾激活指数与D2PB302 组差异无统计学意义(t 分别为0.421 4、0.557 2、1.281 0、0.067 4、0.516 9、0.354 9,P 分别为 0.675、0.580、0.205、0.947、0.607、0.724)。免疫后24 h,NIFDC 945 SⅢ组小鼠脾激活指数与对照组比较,差异无统计学意义(t=1.648,P=0.105);免疫后 1、3、6、9、12 周,两组差异有统计学意义(t 分别为 8.316、26.29、12.30、10.29、8.377,P 均 <0.001)。见图1。
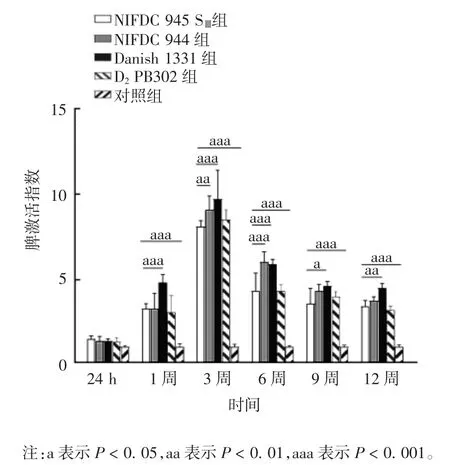
图1 免疫不同BCG 菌种小鼠的脾激活指数Fig.1 Spleen activation indexes of mice immunized with various BCG strains
2.2 各组小鼠脾内BCG 的存活率 免疫后12 周内,各组小鼠脾内BCG 存活数呈逐步下降趋势。NIFDC 945 SⅢ组小鼠脾内 BCG 存活数于免疫后 3、6、9、12 周明显低于 NIFDC 944 组(t 分别为 13.44、5.955、6.976、3.400,P 均 <0.01),免疫后 1~12 周明显低于 Danish 1331 组(t 分别为 3.821、5.232、4.049、14.57、3.046,P 均 <0.05),免疫后 1、3、9 周明显低于 D2PB302 组(t 分别为 3.466、3.555、4.327,P 均 <0.01),见表 1。
表1 免疫不同 BCG 菌株后小鼠脾内 BCG 的活菌数(lgCFU / mL,,n = 5)Tab 1.Viable counts in spleens of mice immunized with various BCG strains(lgCFU / mL,,n = 5)

表1 免疫不同 BCG 菌株后小鼠脾内 BCG 的活菌数(lgCFU / mL,,n = 5)Tab 1.Viable counts in spleens of mice immunized with various BCG strains(lgCFU / mL,,n = 5)
注:aa 表示与 NIFDC 944 SⅢ组比较,P < 0.01;b 表示与 Danish 1331 组比较,P < 0.05;cc 表示与 D2 PB302 组比较,P < 0.01。
组别 免疫时间24 h 1 周 3 周 6 周 9 周 12 周NIFDC 945 SⅢ组 6.00 ± 0.19 6.58 ± 0.34b,cc 5.79 ± 0.13aa,b,cc 4.67 ± 0.22aa,b 3.74 ± 0.15aa,b,cc 4.29 ± 0.24aa,b NIFDC 944 组 5.85 ± 0.15 6.47 ± 0.38 6.74 ± 0.10 5.19 ± 0.13 4.51 ± 0.23 4.73 ± 0.19 Danish 1331 组 6.77 ± 0.06 5.93 ± 0.17 6.86 ± 0.39 5.08 ± 0.14 4.85 ± 0.12 4.78 ± 0.28 D2 PB302 组 6.48 ± 0.04 5.98 ± 0.10 6.38 ± 0.14 4.40 ± 0.25 4.35 ± 0.34 4.18 ± 0.43对照组 0.00 ± 0.00 0.00 ± 0.00 0.00 ± 0.00 0.00 ± 0.00 0.00 ± 0.00 0.00 ± 0.00组别
免疫后12 周内,各组小鼠脾内BCG 存活率呈逐步下降趋势,9 ~ 12 周趋于稳定。免疫后1 周,NIFDC 945 SⅢ组小鼠脾内BCG 存活率与NIFDC 944组比较,差异无统计学意义(t=0.304 4,P=0.762);免疫后 3、6、9、12 周,NIFDC 945 SⅢ组小鼠脾内 BCG存活率显著低于 NIFDC 944 组(t 分别为 7.649、5.346、6.105、4.419,P 分别 <0.001、0.000、<0.001、0.000)。免疫后1 周,NIFDC 945 SⅢ组小鼠脾内BCG 存活率显著高于 Danish 1331 组和 D2PB302 组(t 分别为9.190 和 5.835,P 均 < 0.001);免疫后 3 和 9 周时,NIFDC 945 SⅢ组显著低于 Danish 1331 株(t 分别为2.338 和 3.904,P 分别为0.024 和 0.000);免疫后 6 和 12 周,NIFDC 945 SⅢ组显著高于 D2PB302 组(t 分别为 3.844 和 2.988,P 分别为 0.000 和 0.005)。见图2。
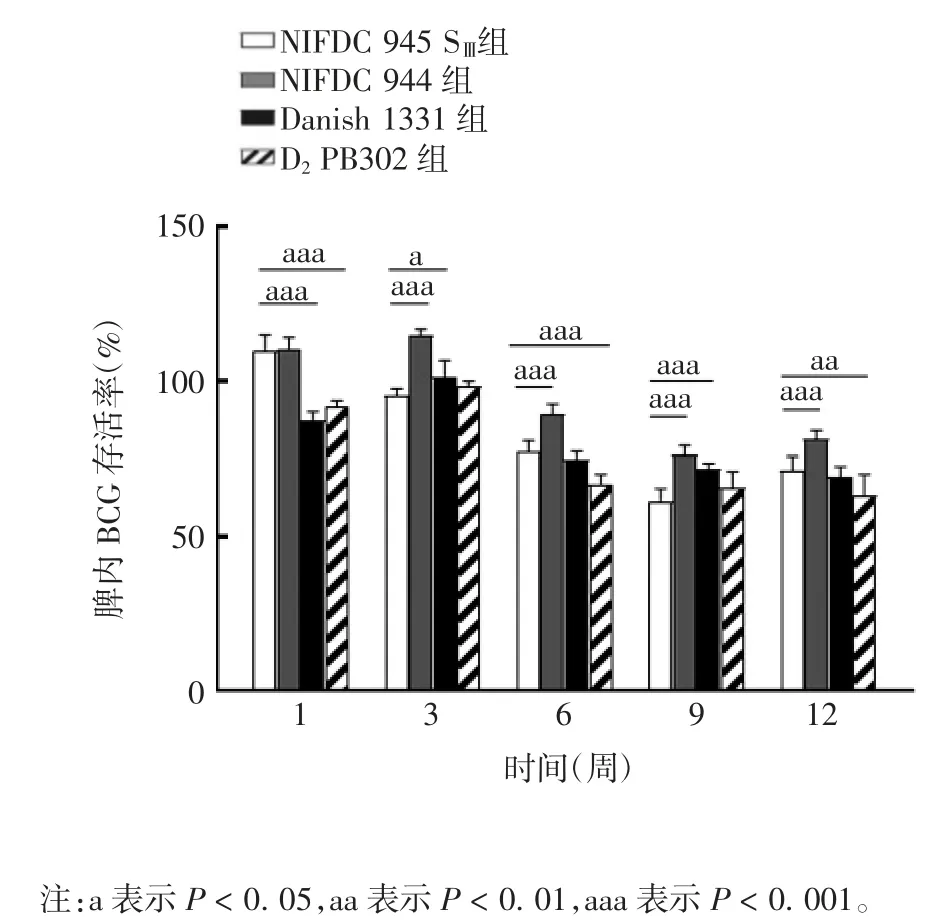
图2 小鼠免疫不同BCG 菌株后脾内BCG 的存活率Fig.2 Viable rates of BCG in spleens of mice immunized with various strains
3 讨 论
目前,国外BCG 加强免疫的临床研究已取得较大进展[7-8],国内对结核菌素阴性青少年及成人接种BCG 的保护效果相关研究较少。DARRAH 等[13]研究表明,采用静脉注射BCG,可显著增强动物血液、脾脏、支气管肺泡灌洗液和肺淋巴结中诱导的CD4+和CD8+T 细胞应答。因此,进行BCG 不同菌种的脾激活试验研究可对该菌种BCG 的免疫力评价起到一定预示作用。BCG 免疫小鼠后脾内存活率是BCG菌种的重要生物学特性之一,BCG 脾内存活率与相应菌种免疫原性(PPD 皮试阳转率)和剩余毒力(淋巴结不良反应等)密切相关。
本研究用不同BCG 菌株在相同条件下制备菌悬液,免疫小鼠 24 h 及 1、3、6、9、12 周后,比较单细胞克隆菌株BCG NIFDC 945 SⅢ与其原始菌株NIFDC 944、已上市BCG 的生产株Danish 1331 和D2PB302在小鼠脾激活指数和脾内存活率指标上存在的差异。结果显示,免疫后12 周,各组小鼠脾中BCG 存活率为64.40%~80.91%;免疫后1~3 周,4 株BCG感染小鼠的脾激活指数逐渐增加,均>2,免疫后3周达最高,随后虽有降低,但在免疫后12 周时仍保持较高,与相关免疫类菌苗脾激活试验脾指数水平要求相当,即BCG 在脾内定植,通过不同程度的生长繁殖引起脾激活指数增加,可持续刺激机体产生免疫应答[14]。BCG 单细胞克隆 NIFDC 945 SⅢ在脾内生长繁殖能力弱于其原始菌株NIFDC 944 株,该菌株免疫力与D2PB302 株相当,但低于Danish 1331 株,在脾内定植能力弱于Danish 1331 株,强于D2PB302 株。BCG 在宿主内的定植能力与毒力具有相关性[15-16],本研究表明,BCG NIFDC 945 SⅢ单细胞克隆株的毒力远低于NIFDC 944 株、介于已上市两种BCG 生产株之间,在产生显著细胞免疫效应的同时,可与适宜毒力达到平衡,且采用单细胞纯化方式建立,因此,可能为BCG 保护力达到一致提供一种创新性方法,可作为BCG 候选疫苗株。综上所述,采用单细胞纯化方式建立的BCG NIFDC 945 SⅢ单细胞克隆菌种,可能为BCG 保持保护力一致提供一种创新性方法,由该菌种生产的BCG 已获得药物临床试验批件,但该菌种生产BCG 的保护力及安全性仍需通过动物试验和临床研究进行进一步研究。
