珠江河口水体环境DNA提取方法的建立及优化
2022-06-22李红婷邹柯姝陈作志陈晓雷蒋佩文曹漪婷
李红婷,张 帅,邹柯姝,陈作志,陈晓雷,蒋佩文,曹漪婷,李 敏,3
1. 中国水产科学研究院南海水产研究所/农业农村部外海渔业可持续利用重点实验室/广东省渔业生态环境重点实验室,广东 广州 510300
2. 南方海洋科学与工程广东省实验室 (广州),广东 广州 511458
3. 广东珠江口生态系统野外科学观测研究站,广东 广州 510300
4. 上海海洋大学 海洋科学学院,上海 201306
5. 华南农业大学 海洋学院,广东 广州 510642
6. 大连海洋大学 水产与生命学院,辽宁 大连 116023
环境 DNA (Environmental DNA, eDNA) 是生物体释放 (皮肤、粪便、唾液等) 到水体、土壤、沉积物等环境中的DNA分子的总和[1]。环境DNA技术通过从环境样本中收集、提取和扩增DNA片段,利用测序技术对生物进行定性或定量分析[2]。与传统水生物种的调查方法相比,环境DNA技术仅需采集研究物种所在区域的水样进行分析,不需要捕捞、干扰或伤害生物,是一种环境友好型的研究方法。近年来,环境DNA技术已广泛用于水体环境中的物种检测[3-5]、生物量评估[6-8]、食性分析[9-11]以及生物多样性评估[12]等方面。
环境DNA技术依赖于环境样本中的DNA片段来检测物种的存在[13],从环境中获取高质量的DNA片段是成功检测的前提。eDNA的获取包括环境样本的采集、保存和提取等步骤。在实验过程中研究人员会根据成本、取样的便利性以及个人喜好选择实验方法[14-15]。不同的方法组合会对eDNA的产量和质量产生很大的影响,进而影响目标物种的检测率,尤其是针对稀有物种的检测[14-16]。目前,国内外已有关于不同区域水样获取的相关研究,陈治等[17]建立和优化了舟山近海高浊度水样的eDNA获取方法,结果表明对于高浊度水样的eDNA获取,乙醇沉淀法要优于滤膜法。黎慧等[18]利用大型水塘中的水样对比了滤膜法和沉淀法的富集效果,结果发现经滤膜法处理后的水样获得的eDNA 浓度更高。Deiner等[19]以湖泊和河流水为研究样本,结果显示两种处理方法的捕获效果相同。一般而言,沉淀法更适用于静水生态系统中小体积水样的富集,如养殖水体或其他人工水体。自然生态系统的物种密度相对较低,且水体环境和水质情况更加复杂,滤膜法更利于eDNA的富集[20]。由此看来,不同水域由于环境差异,通用的方法并不一定都适用。因此,在对特定区域进行eDNA研究时,有必要筛选出适合该区域的针对性的操作方案流程,最大程度提高eDNA回收率,增加目标物种的检测率,从而获得更为真实可靠的结果。
珠江河口是我国最富生产力的河口区域之一,是多种经济水生物种产卵、索饵和育肥的重要场所,也是多种珍稀濒危动物的栖息地[21-22]。该区域水文、水质及生态极为复杂,咸淡水体交换频繁[23],为eDNA相关研究的开展增加了难度。目前,尚无该区域关于eDNA获取方法优化方面的研究。因此,本研究以珠江河口咸淡水生态系统为研究对象,评估不同类型的滤膜、保存方法和提取试剂盒对eDNA产量和质量的影响。建立适用于珠江河口咸淡水海域eDNA获取的实验流程,为珠江河口及相似水域环境的eDNA研究提供参考。
1 材料与方法
1.1 水样的采集
水样于2021年3月采集于珠江河口西部的荷包岛南面海域 (113°09'E, 21°49'N),采样点水温23 ℃,盐度16。用采水器采集近表层水置于塑料桶中,根据下文中的实验方案进行过滤。过滤装置型 (NALGENE 300-4100, 500 mL)。抽滤泵型 (津腾GM-0.5 A),抽气速度为 30 L·min−1,电机功率为 160 W。
为了避免交叉污染,过滤装置依次经过次氯酸钠 (NaClO) 浸洗、蒸馏水冲洗和水样润洗,同时过滤蒸馏水作为阴性对照。
1.2 不同材质的滤膜和提取方法的比较
选取直径47 mm、孔径0.45 μm的玻璃纤维滤膜 (GF,Whatman,德国)、硝酸纤维滤膜 (CN,Whatman,德国)、聚碳酸酯滤膜 (PC,Millipore,爱尔兰)、醋酸纤维滤膜 (CA,金晶,上海) 4种类型的滤膜,比较同种保存条件下不同材质滤膜和提取试剂盒对eDNA获取的影响。采用真空抽滤装置过滤,每张滤膜过滤1 L水样,每种滤膜过滤6张,并记录过滤时间,同时过滤对应的阴性对照,过滤完毕后分别装入无菌冻存管中,放入液氮保存,直至进行DNA提取。使用海洋动物组织基因组DNA提取试剂盒 (天根,北京,以下简称T 试剂盒) 和 DNeasy Blood and Tissue kit试剂盒(Qiagen,德国,以下简称Q试剂盒) 2种试剂盒提取不同类型滤膜的DNA (图1)。每次过滤前用无菌水冲洗过滤装置,再用待滤水样冲洗以防止交叉污染。
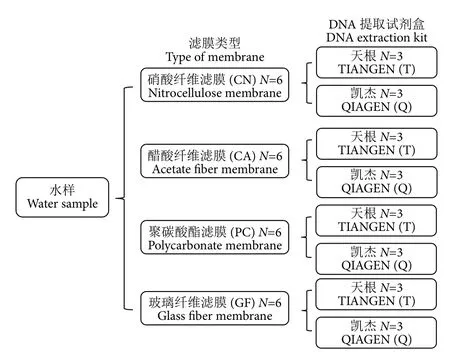
图1 4种滤膜与2种试剂盒的实验设计方案Fig. 1 Experimental design of four kinds of filtration membranes and two kinds of kits
1.3 不同保存方法的比较
选取直径47 mm、孔径0.45 μm的硝酸纤维滤膜和醋酸纤维滤膜过滤水样,比较不同保存方法对eDNA获取的影响。每张滤膜过滤1 L水样,每种滤膜过滤12张,同时过滤对应的阴性对照,过滤完毕后分别装入无菌冻存管中,依据图2所示保存直至进行DNA提取。另外为了评估不具备现场过滤条件下的DNA提取效果,取10 L水样常温放置3 d后带回实验室,使用以上两种滤膜进行过滤后,进行DNA提取。
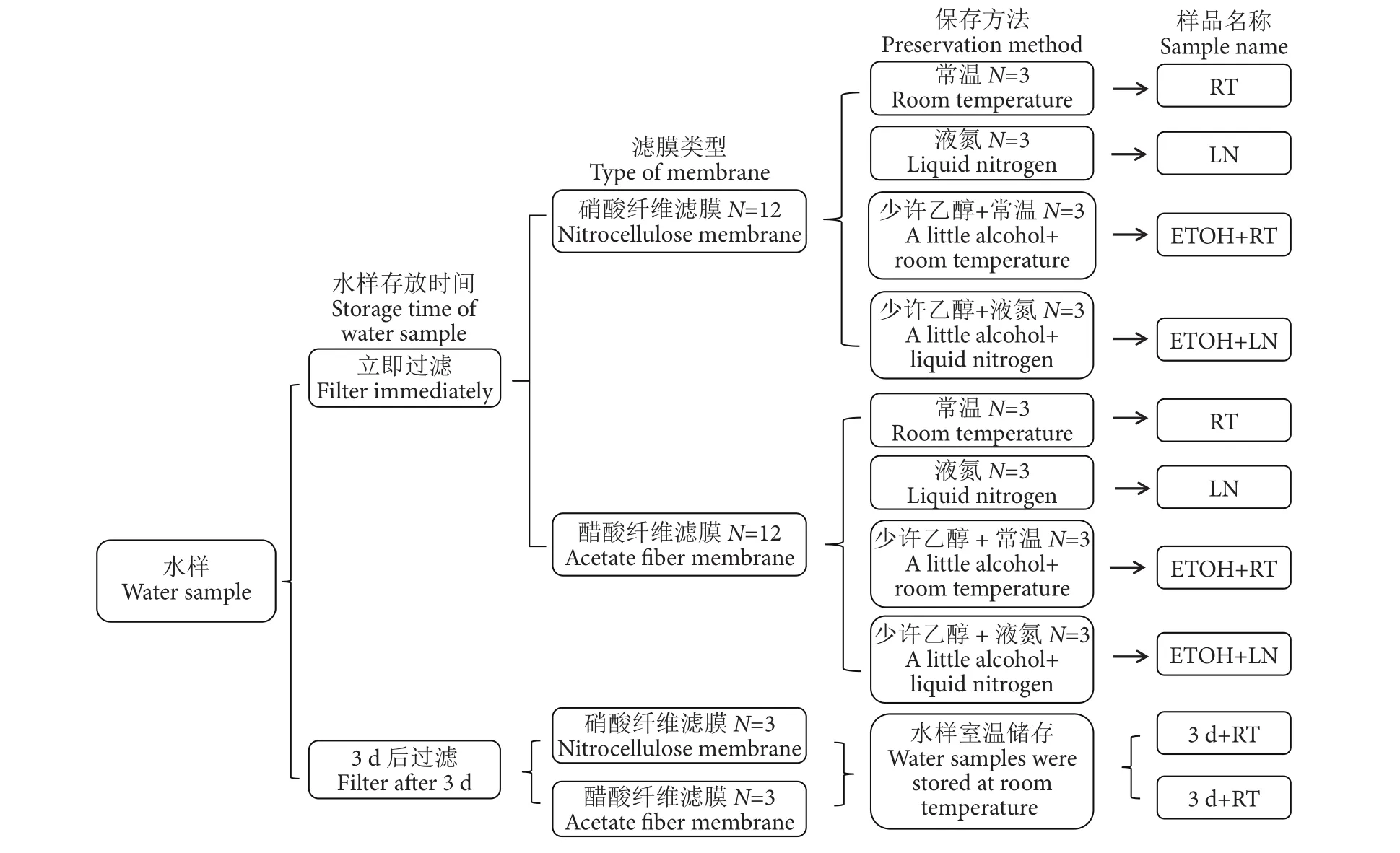
图2 滤膜与保存方法的不同组合Fig. 2 Different combinations of membrane and preservation methods
1.4 eDNA 提取方法的比较
使用两种试剂盒提取不同材质滤膜所富集的eDNA以及阴性对照组,由于试剂盒说明书中建议添加的试剂量体积较小,不能完全浸没滤膜,不适用于滤膜上eDNA的提取,考虑到会影响提取效果,因此对个别步骤稍作修改。
T试剂盒提取方法修改内容为:1) 加入800 μL GA 缓冲液和 80 μL 蛋白酶 K;2) 加入 500 μL GB缓冲液,后续步骤与说明书一致,最后使用100 μL TE 缓冲液进行洗脱。为提高 DNA 产率,将第一次离心得到的溶液再次加入吸附柱中进行二次洗脱。
Q试剂盒提取方法修改内容为:1) 加入800 μL ATL Buffer和 80 μL 蛋白酶 K,置于 56 ℃ 恒温水浴 2.5 h,每 30 min 旋涡振荡 15 s;2) 加入 400 μL AL Buffer,56 ℃ 恒温水浴 20 min,12 000 r·min−1离心 30 s,将上清液全部转移至新的离心管中;3) 加入400 μL无水乙醇,混匀后分批将混合物转移至吸附柱中,12 000 r·min−1离心 30 s,直至过滤完所有混合物;4) 加入 500 μL AW1 Buffer,12 000 r·min−1离心 30 s;5) 加入 500 μL AW2 Buffer,12 000 r·min−1离心 3 min;6) 将吸附柱转移至新的 1.5 mL 离心管中,加入 100 μL AE Buffer以洗脱 DNA,为提高 DNA 产率,将第一次离心得到的溶液再次加入吸附柱中进行二次洗脱。
提取过程中均设置阴性对照,以检测提取过程中是否存在污染情况。提取后的DNA用超微量分光光度计 (凯奥-K5600) 检测其浓度和A260/A280值,并通过1%的琼脂糖凝胶电泳检测降解情况,选择提取DNA浓度高的试剂盒提取1.3中的滤膜。
1.5 数据分析
运用SPSS 24.0软件对数据进行分析,分别计算每组样品3个重复的DNA浓度、A260/A280以及滤膜过滤时间的平均值和标准差。为评估不同样品eDNA获取量的差异,运用一般线性模型对eDNA浓度数据进行差异分析,差异显著系数为P<0.05。
2 结果
2.1 不同滤膜和试剂盒对 DNA 获取的影响
4种滤膜用2种试剂盒提取的总eDNA经1%的琼脂糖凝胶电泳检测,结果见图3。同种滤膜的3个重复组之间的提取效果基本相当。由于提取样本为环境样本,所有eDNA的条带都存在拖带、模糊现象,说明样本存在不同程度的降解。其中聚碳酸酯膜 (PC) 降解程度最为严重,降解片段长度主要集中在250 bp附近。阴性对照组经电泳检测均未出现条带,且用超微量分光光度计检测浓度为0。表明在水样过滤和DNA提取过程中不存在污染。
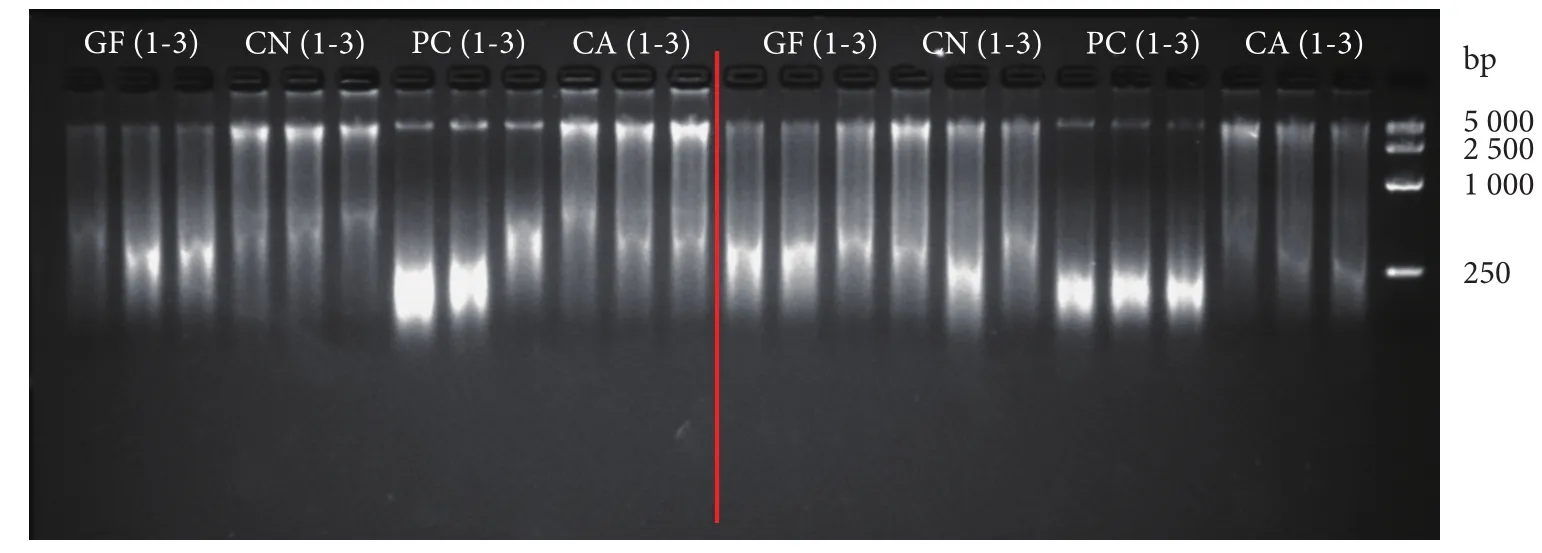
图3 滤膜与试剂盒组合提取的总eDNA电泳图Fig. 3 Electrophoresis diagram of total eDNA extracted by combination of membrane and kit
根据eDNA浓度方差分析结果 (图4),T试剂盒提取的不同材质滤膜的eDNA浓度无显著性差异(P>0.05);而Q试剂盒提取的eDNA浓度具有显著性差异 (P<0.05),说明不同材质的滤膜对eDNA的获取产生影响。T试剂盒提取的eDNA质量浓度整体高于Q试剂盒,平均值分别为 (233.13±70.71)ng·μL−1(T)和 (184.22±25.33) ng·μL−1(Q)。其中,两种试剂盒提取的醋酸膜 (CA) 的eDNA质量浓度均最高,分别为 (293.37±63.46) ng·μL−1(T) 和(236.98±44.19) ng·μL−1(Q)。
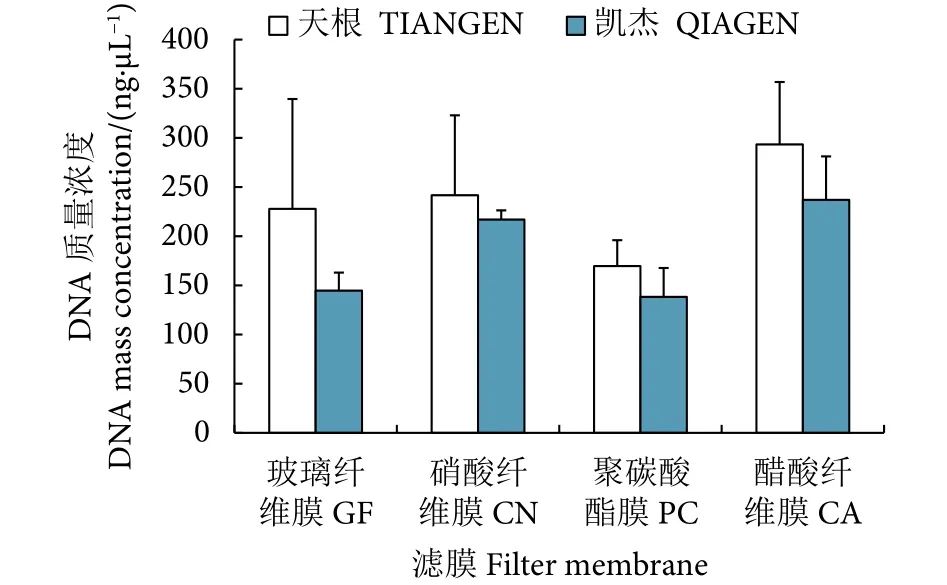
图4 滤膜与试剂盒组合获得的eDNA浓度比较Fig. 4 Comparison of eDNA concentration obtained by combination of membrane and extraction kit
eDNA纯度结果显示 (图5),两种试剂盒提取eDNA的A260/A280分别介于1.97~2.02 (T)和1.80~1.98 (Q)。一般认为,DNA 提取物的最佳质量范围是 A260/A280介于1.8~2.0,偏离该范围的程度越高说明 DNA 提取物的质量越低。总体上看,eDNA样品的A260/A280基本位于1.8~2.0,说明所获DNA质量较高,仅有Q试剂盒提取的硝酸膜 (CN) 的 A260/A280 超出 2.0。
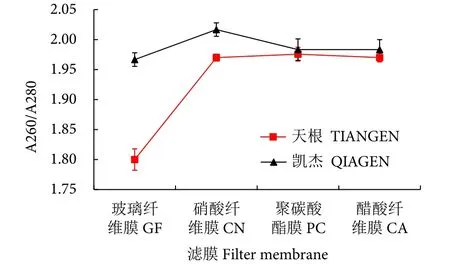
图5 滤膜与试剂盒组合获得的eDNA纯度比较Fig. 5 Purity comparison of eDNA obtained by combination of membrane and extraction kit
综上所述,T试剂盒提取的eDNA浓度更高,且提取物的质量均位于最佳质量范围内,因此选择T试剂盒提取1.3中的滤膜。
2.2 不同保存方法对 DNA 获取的影响
eDNA浓度方差分析结果显示 (图6),使用不同方法保存滤膜,提取的eDNA浓度具有显著差异(P<0.05),醋酸膜和硝酸膜的获取效果表现出高度一致性。用液氮 (LN) 保存的滤膜,提取物的质量浓度均为最高[醋酸膜:(293.37±63.47) ng·μL−1,硝酸膜:(241.69±81.25) ng·μL−1]。“乙醇+液氮”(ETOH+LN) 和“乙醇+常温”(ETOH+RT) 的提取物浓度相差不大,醋酸膜的质量浓度介于 (243.09±19.57)~(266.81±10.92) ng·μL−1(图6-a),硝酸膜的质量浓度介于 (226.45±17.71)~(232.13±3.52) ng·μL−1(图6-b)。常温 (RT) 保存滤膜后获取的 eDNA 浓度较低,与常温储存水样 (3 d+RT) 的提取效果相当。
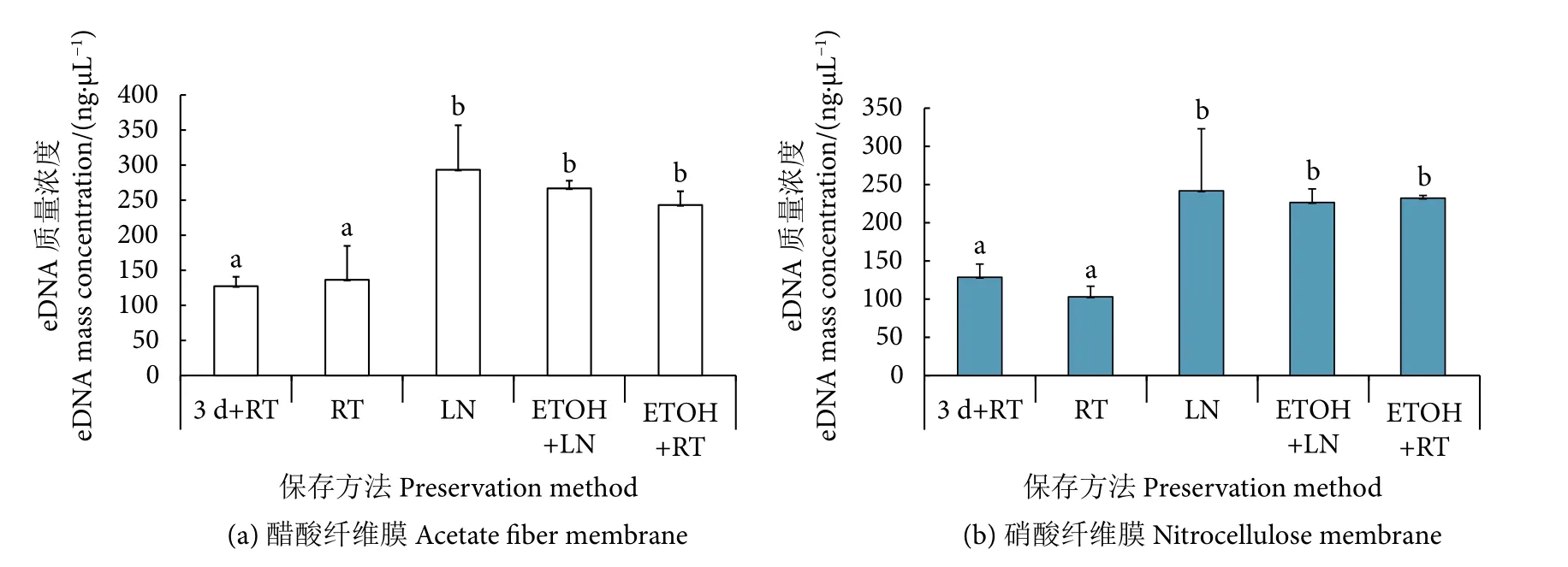
图6 不同保存方法下提取的eDNA浓度比较Fig. 6 Comparison of eDNA concentrations extracted by different preservation methods
根据eDNA纯度结果显示 (图7),不同实验组提取物的A260/A280介于1.78~2.05,且具有显著性差异 (P<0.05)。其中有3个DNA提取物的A260/A280超出最佳质量范围。从提取物的稳定性来看,液氮保存条件下平行样品间的A260/A280波动较大,与其他方法相比不够稳定。
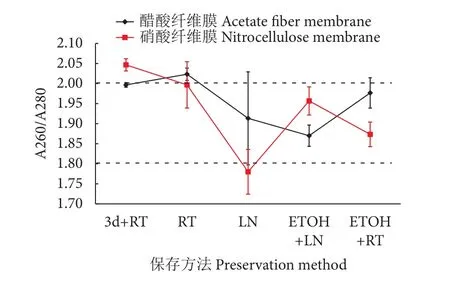
图7 不同保存方法下提取的eDNA纯度比较Fig. 7 Purity comparison of eDNA extracted by different preservation methods
2.3 不同滤膜的过滤时间比较
不同材质滤膜的过滤速度存在极显著差异(P<0.001) (图8)。过滤 1 L 水样时间最快的是玻璃纤维滤膜 [(1.46±0.08) min],其次是醋酸纤维滤膜[(5.8±0.16) min]和硝酸纤维滤膜 [(6.59±0.27)min],聚碳酸酯滤膜的过滤时间最长 [(23.84±3.71) min]。
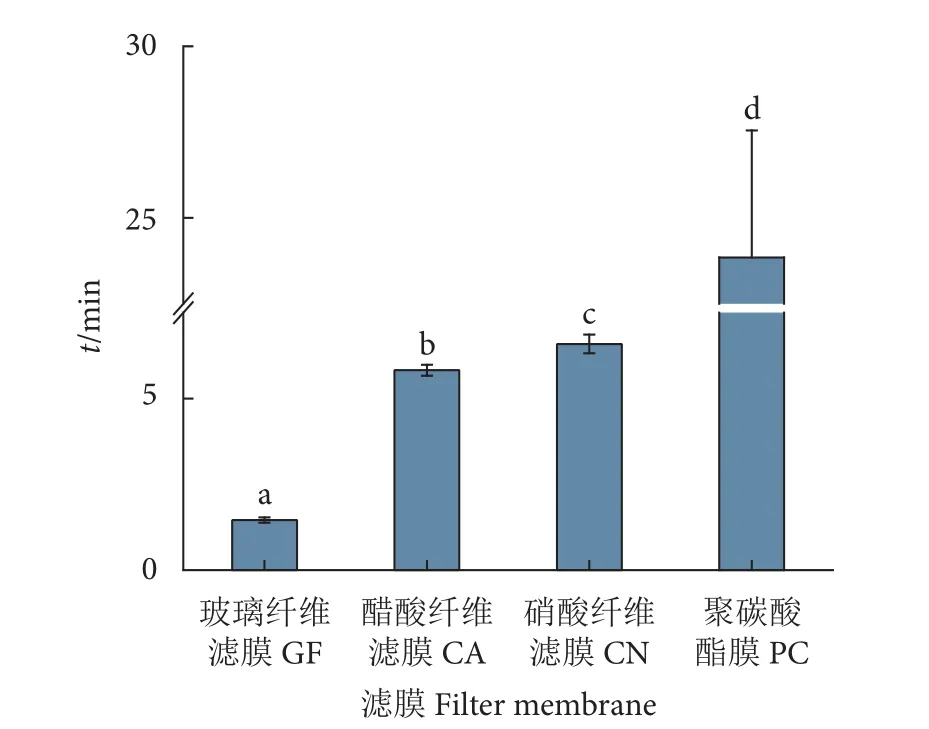
图8 不同滤膜过滤1 L水样所需时间比较Fig. 8 Comparison of time used for filtration of 1 L water sample by different membranes
3 讨论
eDNA技术作为一种非入侵的研究手段,越来越多地运用于海洋生态系统物种多样性的研究中。然而,河口生态系统复杂多变,受洋流、潮汐、盐度和紫外线等多种因素影响,eDNA的获取相对于淡水系统更具挑战。本研究以典型的河口生态系统(珠江河口) 为研究区域,评估了不同材质滤膜、保存方法和提取策略对eDNA获取的影响,确定了适用于珠江河口咸淡水海域的eDNA获取方案。结果表明,水样采集后立即使用醋酸纤维滤膜过滤,滤膜用液氮冷冻保存,后用海洋动物组织基因组DNA提取试剂盒提取的组合方案较适用于珠江河口的水样研究。
3.1 不同试剂盒对珠江河口 eDNA 提取效果的影响
在eDNA的提取中,目前国外使用频率最高的试剂盒主要有 DNeasy Blood and Tissue Kit与 Power Water DNA Isolation Kit。绝大多数学者认为利用DNeasy Blood and Tissue Kit提取 eDNA 的效果较好且性价比较高[20]。但另一项研究结果显示Power Soil试剂盒在6种试剂盒中的提取效率最高,且不存在PCR抑制[16]。由于同一试剂盒在不同目标种的研究中具有不同效果[19],因此需要针对特定研究对象筛选出适合的提取方法。本研究从经济实用的角度出发,选用一种进口试剂盒 (Qiagen DNeasy Blood and Tissue Kit),以及一种提取海洋动物组织常用的国产试剂盒 (天根海洋动物组织基因组DNA提取试剂盒) 进行评估。结果显示,在eDNA提取物质量相当的情况下,海洋动物组织基因组 DNA 提取试剂盒比 DNeasy Blood and Tissue Kit能获得更高的eDNA浓度,高浓度的提取物可能包含更多的物种信息,有利于后续开展有关生物多样性方面的研究。
此外,评价一种提取方法是否有效,除了能够获得较高的DNA产量外,最大化的去除PCR抑制剂也是考虑的重要因素[16]。从水生生态系统采集的eDNA水样中含有大量的腐殖质和其他物质,腐殖质和酚类化合物是常见的PCR抑制剂,会对PCR过程产生抑制,从而减少PCR产物并影响检测率[24]。但通常包含去除抑制剂步骤的试剂盒的产率相对较低。可通过改变反应混合物体系配比、使用DNA纯化试剂盒、稀释或添加PCR辅助剂等方式缓解PCR 抑制作用[16]。
3.2 滤膜材质对 eDNA 提取结果影响
研究表明滤膜法在富集自然生态系统中的eDNA时比离心法和过滤法更有效[16,19,25],且有利于样品保存,能够有效防止DNA的降解,获得更高浓度的 DNA[20]。故本研究仅选择了滤膜法进行步骤优化和对比。目前,用于富集eDNA的滤膜种类较多[26],影响选择的主要因素是滤膜的富集量和过滤效率[16]。Eichmiller等[16]采集养殖水箱中的水样研究不同滤膜对eDNA产量和浓度的影响,结果发现玻璃纤维膜的性能优于聚碳酸酯膜。Liang和 Keeley[27]利用地表水样测试了滤膜类型和孔径对DNA回收的影响,结果显示与聚醚砜膜(PES)、聚偏氟乙烯膜 (PVDF) 相比,聚碳酸酯膜的eDNA产量最低,混合纤维滤膜(MCE)的产量最高。本研究选取常用的4种滤膜进行效果评估,结果发现,醋酸纤维膜获取的eDNA浓度最高,聚碳酸酯膜的浓度最低。从过滤效率来看,玻璃纤维膜的过滤速度最快,聚碳酸酯膜最慢。过滤速度主要与滤膜材质、孔径以及水样的浑浊度有关。在某些环境中,流速快的滤膜可以显著减少过滤时间和相关的劳动力成本,此外,长时间的过滤还可能导致eDNA在过滤过程中发生降解,尤其是高浊度的水样 (如长江水样[28])。需要注意的是,滤膜的流速太快或太慢,最终获得的DNA总量都不理想。
3.3 不同滤膜保存方法对eDNA提取效果的影响
eDNA在水中很容易降解[29],水样采集后及时过滤并选择合适的保存方法对最大化的回收eDNA至关重要[30]。常用的保存方法一般分为乙醇保存和冷冻保存[2]。本研究选择4种保存方式进行评估(图2),结果显示不添加任何试剂,仅在室温条件下储存的滤膜获取的eDNA浓度较低。但添加乙醇固定后再置于室温条件下获得的DNA浓度明显升高。研究发现利用乙醇[31-33]或Longmire溶液[25,34]可以成功地将滤膜在室温下进行储存,在乙醇中储存6 d的滤膜所获取的eDNA拷贝数未显著减少[35]。因此,在野外没有冷藏条件时,可以选择添加乙醇室温保存滤膜。但需要注意的是,添加乙醇后会出现富集物渗漏的现象,后续去除乙醇的过程较繁琐,容易造成交叉污染,并且乙醇会对DNA提取过程产生影响[36]。
此外,本研究比较了水样采集后置于室温条件下3 d的提取效果,从提取浓度和质量来看均不理想,因此不推荐这种方法,在采样点立即过滤更有优势。由于eDNA会随时间呈指数级降解[37-38],为了获取更多、更长的DNA片段,要尽可能缩短水样采集与过滤之间的时间。无法现场过滤时,可选择将水样冷冻保存,但要避免反复冻融,否则会影响DNA的检测[39]。
3.4 不足与展望
本研究为珠江口咸淡水生态系统eDNA水样的过滤、保存和提取方法提供了参考。考虑到珠江河口具有明显的旱、雨季之分,水体盐度会根据径流量而变化,不同区域的盐度也会有所不同,后续研究应扩大采样范围,明确实验策略是否适用于盐度差异较大区域的水样研究。有研究表明滤膜孔径会影响eDNA的回收效率[19],本研究仅选择了文献中使用最多的滤膜孔径进行比较,后续实验将继续探究不同孔径滤膜的富集效果。由于DNA的提取不一定能够在水样过滤后立即开展,因此滤膜的长期保存方法对eDNA提取的影响也是一个值得进一步探讨的问题。尤其是在物种密度本身较低的情况下,保存方法不当将造成样品中eDNA降解而无法检测到目标物种。另外,本研究对于不同方法的结果评价标准较为单一,后期应与具体的研究目的相结合,以便更加全面地评估不同方法的实际效果。
