RT-qPCR分析拷贝数及mRNA转录水平对表达左聚糖蔗糖酶的影响
2022-06-22陈硕昌仝秋平郭晓磊蒙健宗
陈硕昌,仝秋平,郭晓磊,朱 萍,蒙健宗,杨 辉,3
(1.广西大学 生命科学与技术学院,广西 南宁 530004;2.亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004;3.广西微生物与酶工程技术研究中心,广西 南宁 530004)
左聚糖是一种果聚糖,主链主要由呋喃果糖残基以β-(2,6)糖苷键连接形成,支链由少量β-(2,1)糖苷键连接形成。左聚糖通常由微生物生产,分子质量多为105~107Da,植物生产的左聚糖含量低且分子质量一般较小[1]。在食品工业中,由于左聚糖有良好的水溶性、高分子质量和低黏度等特性,所以可用作乳化剂、稳定剂和增稠剂[2]。在制药工业中,左聚糖可用作血浆扩容剂、减肥剂和降胆固醇剂等[3]。此外,由于左聚糖具有保湿性质、低细胞毒性、促进哺乳动物细胞增殖和抗炎作用,还可用于化妆品中[4]。目前左聚糖的制备主要分为直接提取、化学合成、微生物发酵和酶法合成四种,其中酶法合成左聚糖操作简单,纯化方便,对工业生产中有着广阔的发展前景[5-6]。左聚糖蔗糖酶属于GH68糖苷水解酶家族,同时具有水解蔗糖和转果糖基的双重活性。
与大肠杆菌(Escherichia coli)相比,毕赤酵母(Pichia pastoris)的安全性更好,已被认定为一般公认为安全(generally recongnized as safe,GRAS)微生物[7]。毕赤酵母(Pichia pastoris)表达系统是当前最有效、最方便、最广泛的外源蛋白表达系统之一[8-9],其具有安全性好[10]、外源基因可稳定存在[11]、可实现分泌表达和适合工业化生产[12]等优点,毕赤酵母(Pichia pastoris)表达系统已在食品、医药和工业酶制剂[13]等领域广泛应用。外源基因可以通过同源重组整合到毕赤酵母(Pichia pastoris)的基因组上,并且可以在同一位点多次同源重组从而插入多个拷贝。有研究表明,多拷贝菌株通常比单拷贝菌株表达更多的外源蛋白[14],但是重组菌株外源蛋白表达量并不都是随着拷贝数增加而增加[15-16]。目前关于利用酵母表达重组左聚糖蔗糖酶的报道较少,并且缺乏拷贝数对重组毕赤酵母(Pichia pastoris)左聚糖蔗糖酶分泌表达水平影响的相关研究。
实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)是一种核酸定量技术[17],可用于研究基因组学,与Southern印迹和脱氧核糖核酸(deoxyribonucleic acid,DNA)测序来鉴定扩增子相比,RT-qPCR具有操作简单、特异性强、灵敏和高通量等优点[18],已成为检测信使核糖核酸(messenger ribonucleic acid,mRNA)的首选方法[19]。
本研究采用双标准曲线法RT-qPCR技术,以毕赤酵母(Pichia pastoris)的持家基因gap为内参,通过SYBR Green模式的RT-qPCR测定重组毕赤酵母中左聚糖蔗糖酶基因SacB[6]的基因拷贝数及转录水平,意在探究不同基因拷贝数及相应mRNA转录水平的变化对重组毕赤酵母分泌表达左聚糖蔗糖酶的影响,为筛选高效表达的重组菌株提供理论指导。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
大肠杆菌(Escherichia coli)trans10:北京全式金生物技术有限公司;毕赤酵母(Pichia pastoris)GS115:美国Invitrogen公司;含不同SacB基因拷贝数的毕赤酵母菌株:由本实验室前期将含SacB基因的质粒pPIC9K通过氯化锂转化法转化毕赤酵母GS115所得;pMD19-T Vector:宝日医生物技术(北京)有限公司。
1.1.2 主要试剂
酵母基因组DNA(genome DNA,gDNA)提取试剂盒、无氨基酵母氮源(yeast nitrogen base without amino acids,YNB)、生物素(vitamin H,VH)(纯度>99%)、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(5-bromo-4-chloro-3-indolyl-beta-Dgalactopyranoside,X-gal)(纯度>99%):北京索莱宝科技有限公司;SanPrep柱式质粒DNA小量抽提试剂盒、SanPrep柱式胶回收试剂盒:上海生工生物技术有限公司;酵母RNA提取试剂盒:美国OMEGA公司;逆转录试剂盒:北京全式金生物技术有限公司;Ultra SYBR Mixture:康为世纪生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):国药集团化学试剂有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)(纯度>98.0%):上海阿拉丁生化科技股份有限公司;酵母浸出粉、胰蛋白胨(均为生化试剂):英国Oxoid公司;其他试剂均为国产分析纯。
1.1.3 培养基
Luria-Bertani(LB)培养基:胰蛋白胨10.0 g/L,酵母浸出粉5.0 g/L,NaCl 10.0 g/L,121 ℃高压蒸汽灭菌20 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:胰蛋白胨20.0 g/L,酵母浸出粉10.0 g/L,121 ℃高压蒸汽灭菌20 min;葡萄糖20.0 g/L,115 ℃高压蒸汽灭菌15 min。
含有甘油的缓冲性完全(buffered minimal glycerol YP medium,BMGY)培养基:胰蛋白胨20.0 g/L,酵母浸出粉10.0 g/L,0.1 mol/L磷酸盐钾缓冲液(0.1 mol/L K2HPO4与0.1 mol/L KH2PO4混合调节pH=6.0)100 mL/L,10%(V/V)甘油100 mL/L,121 ℃高压蒸汽灭菌20 min;13.4%YNB 100 mL/L,0.2 mg/mL生物素2 mL/L,0.22 μm孔径无菌滤膜过滤除菌。
含有甲醇的缓冲性完全(buffered minimal methanol YP medium,BMMY)培养基:胰蛋白胨20.0 g/L,酵母浸出粉10.0 g/L,0.1 mol/L磷酸盐钾缓冲液(0.1 mol/L K2HPO4与0.1 mol/L KH2PO4混合调节pH=6.0)100 mL/L,121 ℃高压蒸汽灭菌20 min;13.4%YNB 100 mL/L,0.2 mg/mL生物素2 mL/L,5%(V/V)甲醇100 mL/L,0.22 μm孔径无菌滤膜过滤除菌。
蓝白斑筛选(blue-white screening,BWS)培养基[20]:胰蛋白胨10.0 g/L,酵母浸出粉5.0 g/L,NaCl 10.0 g/L,琼脂粉15g/L,121 ℃,高压蒸汽灭菌20 min;氨苄青霉素100 mg/mL,X-gal 24 μg/mL,IPTG 24 μg/mL。
1.2 仪器与设备
NanoDropTMOne微量核酸定量仪:赛默飞世尔科技(中国)公司;LightCycler480 II实时荧光定量PCR仪:瑞士ROCHE公司;PTC-2000 PCR仪:美国MJ Research公司;SKY-211B恒温摇床:上海苏坤实业有限公司;DK-8D数显恒温水浴锅:金坛市医疗仪器厂;PHS-25 pH计:上海金迈仪器仪表有限公司;LDZX-50FBS灭菌锅:上海申安医疗器械厂;UV-1601紫外分光光度计:上海市第三分析仪器厂;Avanti J-E、Microfuge 20低温离心机:美国贝克曼库尔特公司。
1.3 方法
1.3.1 引物设计
根据美国国家生物技术信息中心(national center of biotechnology information,NCBI)数据库公布的毕赤酵母gap基因序列(U62648)设计GAP引物gap-1和gap-2,根据重组毕赤酵母菌株的SacB基因序列设计SacB引物SacB-1和SacB-2见表1。

表1 本实验中使用的引物序列Table 1 The primer sequences used in the experiments
1.3.2 构建标准质粒
接种GS115、重组毕赤酵母,分别提取GS115和重组毕赤酵母的gDNA。以GS115的gDNA为模板,PCR扩增gap基因片段;以重组毕赤酵母的gDNA为模板,PCR扩增SacB基因片段。回收gap和SacB片段后分别连接到pMD19-TVector,转化大肠杆菌后涂布于蓝白斑筛选平板过夜培养。挑取白色单菌落进行菌落PCR鉴定,将阳性克隆送往北京六合华大基因科技有限公司测序,测序正确的质粒作为RT-qPCR的标准质粒,分别命名为T-gap和T-SacB。
1.3.3 待测样品的制备
接种重组毕赤酵母于YPD液体培养基中,30 ℃培养至OD600nm值=1.0,用酵母基因组DNA提取试剂盒抽提基因组DNA。
接种重组毕赤酵母于YPD液体培养基,30 ℃培养至OD600nm值=2.0~6.0,后,以1%(V/V)接种量接种至BMGY液体培养基中,30 ℃培养至OD600nm值=15~20,离心收集菌体后转移至BMMY液体培养基中,28 ℃、250 r/min诱导产酶,每24 h添加1%(V/V)甲醇。分别在诱导时间为24 h、48 h、72 h、96 h、120 h取样,提取总RNA反转录制备合成互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)样品。cDNA反应体系共20 μL,其中含Anchored Oligo(dT)18Primer(0.5 μg/μL)1 μL,模板RNA 50 ng~5 μg,2×TS Reaction Mix 10 μL,TranscripRT/RI Enzyme Mix 1 μL,gDNA Remover1μL,补足无酶无菌水(RNase-Free Water)至20 μL。将RNA模板、引物与RNase-free water混匀,65 ℃孵育5 min后冰浴2 min,再加入其他组分;42 ℃孵育15 min;85 ℃,5 s失活处理。
1.3.4 RT-qPCR扩增体系及程序
PCR扩增体系(20 μL):含引物各0.5 μL(10 μmol/L),模板0.5 μL,双蒸水(ddH2O)8.5 μL,2×Ultra SYBR Mixture 10 μL。PCR扩增程序:95 ℃预变性10 min;95 ℃变性15 s,60 ℃延伸1 min,共40个循环。熔解曲线分析程序:95 ℃、15 s,60 ℃、1 min,95 ℃、15 s,60 ℃、15 s。
1.3.5gap和SacB基因标准曲线的建立
用SanPrep柱式质粒DNA小量提取试剂盒分别从构建好含有标准质粒的菌株抽提T-gap和T-SacB,用微量核酸测定仪测定浓度,根据以下公式计算标准质粒的拷贝数:(6.02×1023)×(g/mL)/(DNA碱基长度×660)=拷贝数/mL。分别以1 μL不同稀释度质粒溶液(103、104、105、106、107个拷贝数/μL)作为模板,以RTgap-1/RTgap-2和RTSacB-1/RTSacB-2引物进行RT-qPCR,每个浓度检测3次。以Ct值(y)作为纵坐标,起始模板中质粒拷贝数的对数值(x)作为横坐标,建立GAP和SacB基因的标准曲线[21]。通过运用双标准曲线法可以分析目的基因的相对含量[22]。
1.3.6SacB基因拷贝数和转录水平的检测
检测SacB基因拷贝数和转录水平时,分别以重组毕赤酵母的gDNA样品及其不同发酵阶段的cDNA样品为模板,分别用引物RTgap-1/RTgap-2和RTSacB-1/RTSacB-2进行RT-qPCR检测,每个样品检测3次。gap基因在毕赤酵母的基因组中以单拷贝的形式存在[23],因此SacB基因在毕赤酵母基因组中的起始拷贝数为SacB与gap基因拷贝数的比值。检测重组毕赤酵母转录水平时,采用样品mRNA含量对内参进行相对定量检测分析mRNA表达变化。
1.3.7 左聚糖蔗糖酶酶液的制备及酶活测定
胞外酶液的制备:发酵液低温离心后的上清即为胞外粗酶液。
胞内酶的制备:①4 ℃、8 000 r/min离心10 min收集菌体,10 mL ddH2O清洗菌体1次,20 mL磷酸盐缓冲液(pH 8.0)清洗菌体2次;②用磷酸盐缓冲液(pH 8.0)重悬细胞至OD600nm值=50~100;③加入等体积的酸洗玻璃珠(0.5 mm),涡旋30 s,冰上孵育30 s,重复7次;④4 ℃、12 000 r/min离心10 min离心得上清即为胞内粗酶液。
采用DNS法测定左聚糖蔗糖酶水解活力[5]。一分子蔗糖可水解成一分子果糖和一分子葡萄糖,实验所需测的是葡萄糖生成量,因此所测还原糖含量需乘1/2即为葡萄糖的真实生成量。左聚糖蔗糖酶酶活定义为:在最适pH、温度条件下,1 min催化蔗糖转化成1 μmol葡萄糖所需左聚糖蔗糖酶的量为1个酶活单位(U/mL)[6]。
2 结果与分析
2.1 建立gap和SacB基因的标准曲线
gap和SacB基因扩增及熔解曲线见图1。由图1可知,gap和SacB基因的扩增曲线光滑平稳,有明显的指数增长期,扩增效率较高,符合定量检测要求;熔解曲线均只有一个单一峰,表明PCR产物中无非特异性产物,证明RTqPCR的两对引物具有较好的特异性。gap和SacB基因的标准曲线见图2。由图2可知,gap基因标准曲线回归方程为y=-3.432x+37.099(R2=0.999),SacB基因标准曲线回归方程为y=-3.408 7x+36.635 0(R2=0.999)。根据两条标准曲线斜率求出gap和SacB基因扩增效率分别为95.6%和96.5%。

图1 标准质粒的扩增曲线(a,b)及熔解曲线(c,d)Fig.1 Amplification curves (a,b) and melting curves (c,d) of standard plasmids

图2 gap(a)和SacB(b)基因的标准曲线Fig.2 Standard curves of gap (a) and SacB (b) gene
2.2 重组毕赤酵母中SacB基因拷贝数检测
6个菌株基因拷贝数检测结果见表2。由表2可知,只有1号菌株在基因组中存在多个拷贝,其余5个重组菌株中SacB基因拷贝数均<2,且RT-qPCR得到的Ct值的标准偏差均在0.27以下,检测结果重复性良好。待测基因组DNA样品的扩增曲线及熔解曲线见图3。由图3可知,扩增曲线呈光滑S型,熔解曲线呈单峰型,样品均不存在非特异性扩增。

图3 待测基因组DNA样品的扩增曲线(a,b)及熔解曲线(c,d)Fig.3 Amplification curves (a,b) and melting curves (c,d) of genomic DNA samples to be tested

表2 实时荧光定量PCR检测gap和SacB基因的拷贝数Table 2 Copy numbers of gap and SacB gene detected by real-time fluorescence quantitative PCR
2.3 重组毕赤酵母基因拷贝数与总酶活的关系
不同拷贝数的重组毕赤酵母菌株于BMMY培养基中诱导产酶,诱导96 h后测定总酶活,结果见图4。由图4可知,在重组毕赤酵母菌株中,基因拷贝数低的菌株具有较低酶活,基因拷贝数高的菌株则具有较高酶活。整体趋势上随着拷贝数的增加,酶活亦增加,二者呈正相关关系。然而并不都是基因拷贝数越高菌株的蛋白表达量越多,在某些情况下,较高的基因拷贝菌株会导致重组蛋白表达量减少。如ZHU T等[16]通过研究不同猪胰岛素前体(porcine insulin precursor,PIP)拷贝数的重组毕赤酵母时发现12个左右拷贝的重组菌分泌表达的蛋白最好,当PIP基因拷贝数多于12时,重组蛋白的表达量受到显著影响。高拷贝菌株表达量降低可能的原因是由于分泌表达通路受到阻碍,外源基因mRNA量过多加大了内质网中蛋白折叠和胞内囊泡运输的压力。因此,通过比较不同拷贝数重组菌株的外源蛋白表达量才能筛选出最佳拷贝数的菌株[24],从而获得更多的重组蛋白。

图4 基因拷贝数对重组毕赤酵母总酶活的影响Fig.4 Effects of gene copy numbers on total enzyme activities of recombinant Pichia pastoris
2.4 重组毕赤酵母转录水平分析
本研究应用两步法RT-qPCR来定量基因表达,两步法RT-qPCR的数据是可重现的,且其在灵敏度、灵活性和条件优化等方面较一步法好[25]。在使用DNA结合染料时,采用两步法操作方案可以通过控制解链温度更轻松地消除引物二聚体[26]。
检测重组毕赤酵母转录水平时选取5号菌株为单拷贝菌株,1号菌株为多拷贝菌株。通过RT-qPCR检测不同诱导时间单拷贝与多拷贝菌株的cDNA样品,结果见图5、图6。由图5(a)-(b)、图6(a)-(b)可知,样品的扩增曲线均呈光滑S型。由图5(c)-(d)、图6(c)-(d)可知,样品的熔解曲线中均为单峰可知扩增产物是特异性的。通过双标准曲线法计算样品的转录水平,结果见表3、表4。由表3、表4可知,单拷贝菌株的最高转录水平是0.42,远低于高拷贝菌株的2.13,单拷贝和多拷贝菌株的总酶活随诱导时间增加均呈上升趋势。通过折线图呈现表3、表4中的数据,结果见图7。结合t检验分析由图7(a)可知,多拷贝菌株的转录水平比单拷贝菌株显著提高(P<0.05)。在添加甲醇24 h后单拷贝菌株及多拷贝菌株的转录水平均为最大值,其后二者转录水平随诱导时间下降。由图7(b)可知,单拷贝菌株与多拷贝菌株的酶活在添加甲醇24 h后均随诱导时间不断上升,结合t检验分析知多拷贝菌株的酶活较单拷贝菌株显著提高(P<0.05)。究其缘由,在诱导过程中,碳源为补加的甲醇来提供,因此诱导过程中碳源的波动和频繁出现的匮乏会影响转录,降低外源蛋白的合成速率[27]。RNA转录水平随着诱导时间递减,由于分泌蛋白的累积效应,酶活会不断增加。
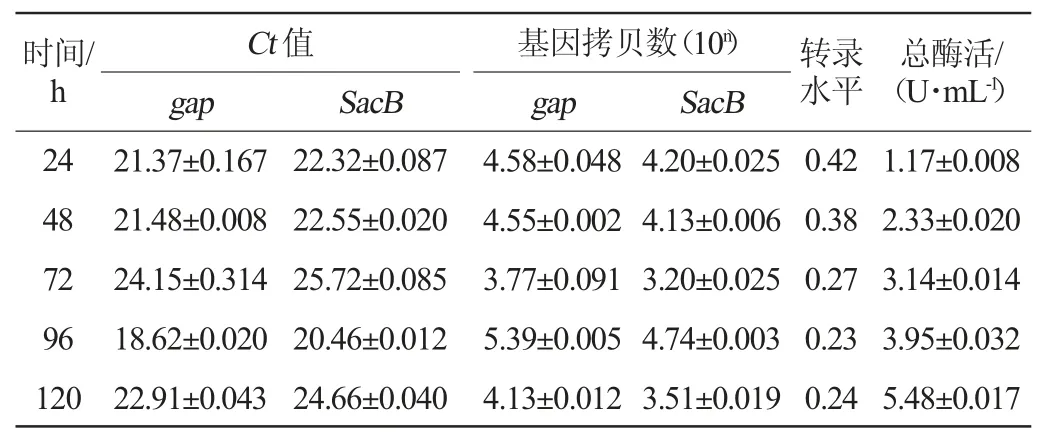
表3 甲醇补料发酵中单拷贝菌株转录水平与酶活的关系Table 3 Relationship between transcription level and enzyme activity of single-copy strain in methanol supplementary fermentation

表4 甲醇补料发酵中多拷贝菌株转录水平与酶活的关系Table 4 Relationship between transcription level and enzyme activity of multi-copy strain in methanol supplementary fermentation

图5 重组毕赤酵母单拷贝菌株扩增曲线(a,b)及熔解曲线(c,d)Fig.5 Amplification curves (a,b) and melting curves (c,d) of recombinant Pichia pastoris single-copy strains

图6 重组毕赤酵母多拷贝菌株扩增曲线(a,b)及熔解曲线(c,d)Fig.6 Amplification curves(a,b) and melting curves(c,d) of recombinant Pichia pastoris multi-copy strains

图7 不同拷贝数菌株的转录水平(a)与表达酶活(b)Fig.7 Transcriptional level (a) and expression enzyme activity (b) of strains with different copies
增加mRNA转录水平最常见的策略是引入多个外源基因的拷贝,多拷贝菌株通常表现为高表达重组蛋白[14,28]。钱晓芬等[15]用毕赤酵母表达牛乳铁蛋白功能片段时发现重组蛋白产量随着BlfFf基因拷贝数的增加而增加,但并非线性递增,拷贝数为3的菌株产量相比单拷贝的菌株提高了150%。此外,毕赤酵母分泌表达异源蛋白与其携带的信号肽有关,KANG H K等[29]构建的携带α信号肽的肠膜明串珠菌中左聚糖蔗糖酶基因的重组毕赤酵母成功的进入了毕赤酵母的分泌途径,而携带肠膜明串珠菌左聚糖蔗糖酶自身信号肽的重组菌株却未能成功分泌,其研究中左聚糖蔗糖酶最高产酶量为8.72 U/mL。此外有假设指出[30],不同基因可能会消除一些物种的特异性,使蛋白更倾向于跨物种间的表达。本研究构建的重组毕赤酵母分泌表达效果较好,达13.96 U/mL,后续可以通过密码子优化、糖基化修饰、引入分子伴侣等技术进一步优化菌种来提高表达量。
3 结论
通过检测重组毕赤酵母不同SacB基因拷贝数及相应mRNA转录水平的变化,成功筛选出高效分泌表达左聚糖蔗糖酶的重组菌株。重组毕赤酵母整合的左聚糖蔗糖酶基因在1~3个拷贝范围内,随着拷贝数增加,重组菌的酶活也随之增加,其中多拷贝菌株的mRNA转录水平(2.13)为单拷贝菌株(0.42)的5.1倍,多拷贝菌株的酶活(13.96 U/mL)比单拷贝菌株(5.48 U/mL)提高1.5倍。本研究说明毕赤酵母是表达SacB的良好宿主,继续提高拷贝数有进一步提高表达水平的潜力,同时表明可通过筛选出最佳基因拷贝数的重组毕赤酵母及重组菌的进一步优化来提高外源蛋白的表达量,为构建其他外源基因的高表达重组毕赤酵母菌株提供参考。
