血人参中分离的异甘草素对巨噬细胞的影响及其抗炎作用机制研究
2022-06-22王文萱张云封罗扬淦廖晗婧刘莉张仕林屠鹏飞朱枝祥李军
王文萱 张云封 罗扬淦 廖晗婧 刘莉 张仕林 屠鹏飞 朱枝祥 李军
血人参为豆科蝶形花亚科(Papilionoideae)木蓝属植物茸毛木蓝IndigoferastachyodesLindl.的干燥根[1],是贵州省少数民族特色苗药。在《贵阳民间药草》记载血人参具有“补血活血”的功效[2];在《全国中草药汇编》记载血人参具有“解表祛湿,止痛,止血”的功效,主治感冒咳嗽,头痛,小儿痰哮,胃痛,黄疸,心绞痛,腰痛,子宫出血,乳癌初起,风湿性关节炎,疔疮,毒蛇咬伤[3]。然而,目前对血人参的现代药理学研究资料十分缺乏,中医临床中对血人参的利用受到严重制约。
本研究前期实验从血人参中提取分离了大量黄酮类化合物,通过初步生物活性筛选,发现从血人参中分离出的化合物异甘草素对脂多糖(lipopolysaccharide, LPS)诱导巨噬细胞释放一氧化氮(nitric oxides, NO)具有很强的抑制作用,可能对巨噬细胞和中性粒细胞的活化及炎症反应具有抑制作用。因此,本研究将利用LPS诱导小鼠巨噬细胞和原代中性粒细胞活化模型[4-5],研究异甘草素的抗炎活性及其作用机制,以揭示血人参中发挥抗炎作用的有效成分及作用机制。
1 材料与方法
1.1 细胞株和动物
小鼠巨噬细胞系RAW264.7,购自中国医学科学院基础医学研究所细胞中心。8~10周龄雄性C57BL/6小鼠,动物合格证号:1100112011044776,购自北京维通利华实验动物技术有限公司。
1.2 实验试剂与仪器
血人参由贵州汉方药业有限公司提供,经北京中医药大学李军研究员鉴定为豆科蝶形花亚科木蓝属植物血人参真品;异甘草素由李军课题组经硅胶、Sephadex LH-20柱色谱和半制备高效液相色谱技术分离纯化,纯度大于95%。
胎牛血清(货号35-081-CV)、DMEM细胞培养基(货号10-013-CVR)、0.25 %胰蛋白酶(货号25-053-CI)、青霉素和链霉素混合液(货号30-002-CI)购自美国Corning公司;细胞增殖及细胞毒性检测试剂盒(货号 C009S)购自上海碧云天生物技术有限公司;Trizol试剂(货号A33254)购自美国Thermo Fisher Scientific公司;氯仿、异丙醇购自国药集团化学试剂有限公司;一氧化氮检测试剂盒(货号BR45002)购自北京佰瑞达生物科技有限公司;逆转录试剂盒(货号AT301-02)和实时荧光定量PCR试剂盒(货号AQ141-02)购自北京全式金生物技术有限公司;肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)、白细胞介素-1β(interleukin-1β, IL-1β)、巨噬细胞炎症蛋白-1α(macrophage inflammatory protein-1, MIP-1α)、单核细胞趋化因子-1(monocyte chemotactic protein-1, MCP-1)和干扰素-β(interferon-β, IFN-β)甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)等基因的实时荧光定量PCR引物购自上海生工生物工程有限公司;小鼠TNF-α(货号3511-1H-6)和IL-6(货号3361-1H-6)的酶联免疫吸附(enzyme linked immuno sorbed assay, ELISA)试剂盒购自瑞典Mabtech公司;小鼠MCP-1(货号555260)的ELISA试剂盒购自美国BD公司;干扰素-β(interferon-β, IFN-β)(货号DY8234-05)的ELISA试剂盒购自美国RD Systems公司。
超净工作台(型号SW-CJ-1FD)购自中国苏州安泰空气技术有限公司;二氧化碳细胞培养箱(型号MCO-18AIC)购自日本三洋公司;台式低温高速离心机(型号5424R)购自美国Eppendorf公司;实时荧光定量PCR仪(型号CFX96)购自美国Bio-Rad公司;多功能酶标仪(型号Enspire)购自美国PerkinElmer公司;化学发光成像仪(型号Amersham imager 680)购自美国通用电器公司。
1.3 异甘草素提取流程
血人参药材(20 kg)干燥、粉碎后,依次用95%、70%、50%乙醇回流提取(每次溶剂120 L,回流2小时),过滤,合并滤液,减压浓缩得到总浸膏(3.2 kg)。总浸膏用50%甲醇-水分散后,依次用正己烷、乙酸乙酯萃取,得到正己烷部位(20.2 g)、乙酸乙酯部位(945.4 g)和水部位(1628.0 g)。乙酸乙酯萃取部位(420 g)经硅胶(200~300目)柱色谱分离,二氯甲烷-甲醇(1∶0→0∶1)梯度洗脱,TLC检测,合并得到10个流分(Fr. A- Fr. J)。Fr. B(8.57 g)经硅胶柱色谱分离,正己烷-乙酸乙酯(1∶0→0∶1)梯度洗脱得到11个流分(Fr. B1~Fr. B11)。Fr. B9(0.73 g)经Sephadex LH-20柱色谱,二氯甲烷-甲醇(1∶1)洗脱得到9个流分(Fr. B9a~Fr. B9i)。Fr. B9i(65.6 mg)经半制备液相[乙腈-水(35∶65)]分离纯化得到化合物异甘草素(41.4 mg,tR= 24分钟)。
1.4 细胞培养
小鼠巨噬细胞系RAW264.7,利用含10 %的胎牛血清、100 U/mL氨苄青霉素和100 μg/mL链酶素的DMEM高糖培养基在5 %的CO2的37 ℃细胞培养箱中培养细胞。
1.5 MTT法检测血人参中异甘草素对巨噬细胞的细胞毒
取对数生长期RAW264.7细胞,调整细胞浓度到4×105/mL,接种细胞到96孔组织培养板中,100 μL/孔,细胞培养箱培养24小时;利用二甲基亚砜将异甘草素配制为20 mmol/L的储备液,然后利用培养基进行梯度稀释,将100 μL化合物溶液加入到给药孔中,细胞培养箱培养24小时;然后从各孔中吸弃100 μL的细胞培养上清,在剩余细胞培养基中,加入MTT检测液25 μL,至MTT终浓度0.5 mmol浓度,细胞培养箱培养4小时;再加入三联液125 μL,室温放置过夜,检测570 nm吸光度(A),计算化合物异甘草素对RAW264.7细胞的生长抑制率。
细胞生长抑制率 =(A对照组- A给药组)/A对照组× 100%
1.6 Griess法检测血人参中异甘草素对LPS诱导巨噬细胞分泌NO的影响
按照1.5所述的方法将细胞接种到96孔板里,细胞培养箱培养24小时;然后将异甘草素加入到给药孔中,50 μL/孔,至终浓度为5、10、20、40 μmol/L,细胞培养箱培养0.5小时,再在模型孔和给药孔中加入50 μL的LPS至终浓度1 μg/mL,细胞培养箱培养24小时。利用Griess法测定细胞培养上清中的NO代谢产物亚硝酸盐的浓度,以定量测定巨噬细胞释放的NO。具体方法如下,取出96孔板,每孔吸取50 μL上清到新的96孔板中,然后分别加入50 μL的R1试剂和R2试剂,室温反应5分钟后在540 nm处测得吸光度,根据标准曲线计算出样品中的NO浓度。
1.7 实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)检测血人参中异甘草素对LPS诱导巨噬细胞炎症因子mRNA转录的影响
取对数生长期的RAW264.7细胞,调整细胞浓度为5×105/mL,接种到6孔板中,2 mL/孔,细胞培养箱培养24小时至细胞完全贴壁后,将异甘草素加入到给药孔中,至终浓度为5、10、20、40 μmol。培养1小时后,将LPS加入到模型孔和给药孔至终浓度1 μg/mL,继续培养6小时后,将上清弃去,底层的细胞加1 mL 磷酸缓冲盐溶液(phosphate buffered saline, PBS)制成细胞悬液,转移到离心管中,离心得到沉淀,利用Trizol试剂裂解细胞,然后利用氯仿、异丙醇和乙醇提取细胞总RNA。
cDNA的制备:以提取的细胞总RNA为模板,按逆转录试剂盒说明操作进行反转录反应,制备cDNA。反应条件:42℃,30分钟,85℃,10秒,-20℃保存备用。
qRT-PCR检测:具体操作参照全式金实时荧光定量PCR试剂盒说明书进行操作。PCR反应条件为:95℃预变性1分钟,然后进行95℃,5秒,60℃,40秒的循环反应,扩增40个循环,并通过熔解曲线确证扩增反应的特异性。最后利用各基因循环数和参照基因GAPDH的循环数计算相对表达量。引物序列见表1。

表1 qRT-PCR所用引物序列
1.8 ELISA法检测血人参中异甘草素对LPS诱导巨噬细胞分泌炎症因子的影响
按照1.6细胞培养的方法给药刺激后,继续培养12小时后,收集细胞上清用于ELISA测定。
按ELISA试剂盒说明书,利用PBS将包被抗体稀释后,加入到高吸附可拆卸96孔板中,100 μL/孔,4℃包被20小时,弃去包被液,利用PBS清洗3次;再加入封闭液室温封闭4小时,利用PBS清洗3次。然后根据预实验将收集到的细胞上清稀释一定倍数后,加入到包被各种因子抗体的96孔板中,另外在标准品孔加入系列浓度的标准品,均为100 μL/孔,室温孵育2小时后,利用含0.1 % 吐温20的磷酸盐缓冲液洗板3次。再加入检测抗体溶液,100 μL/孔,室温孵育1小时后按上述方法洗板。然后加入辣根过氧化物酶标记的链酶亲和素溶液,100 μL/孔,室温孵育0.5小时后按上述方法洗板。然后加入TMB单组份显色液,100 μL/孔,室温反应10分钟,最后加入10%的磷酸水溶液终止显色反应。在450 nm波长测定吸光度值,根据标准曲线计算各组细胞上清中各种炎症因子的浓度。
1.9 流式细胞术分析血人参中异甘草素对LPS诱导中性粒细胞活化的影响
通过颈椎脱臼将自由饮食适应性饲养1周的C57BL/6小鼠处死,无菌取股骨骨髓细胞,裂解红细胞后,利用含2 % FBS的IMDM培养基清洗并重悬骨髓细胞,加入DHR123至终浓度1 μmol,并调整细胞浓度至2.5×106/mL,将细胞接种到48孔板中,5×105/孔。在给药孔中加入100 μL系列浓度异甘草素,37℃培养箱孵育15分钟,然后加入100 μL的LPS至以下浓度,37℃培养箱孵育3小时;收集细胞,离心去上清,利用200 μL含0.2 %牛血清白蛋白的PBS重悬细胞,再加入50 μL的APC标记大鼠抗小鼠Ly6G抗体和PE标记大鼠抗小鼠CD11b抗体混合液,冰浴30分钟,然后利用含0.2 %牛血清白蛋白的PBS清洗并重悬细胞,最后完成流式细胞测定,利用FlowJo分析Ly6G+中性粒细胞DHR123和CD11b的平均荧光强度。
1.10 Western Blot法分析血人参中异甘草素对LPS诱导巨噬细胞信号通路活化的调节作用
按照1.9所述方法铺板给药,分别在刺激30分钟和3小时后收集细胞。利用RIPA细胞裂解液冰浴裂解细胞,4℃、12 000 g离心10分钟,取上清液制备蛋白电泳样本。然后经过聚丙烯酰胺蛋白电泳分离蛋白,再利用电转将蛋白转移到PVDF膜上;利用磷酸盐缓冲溶液(tris buffered saline, TBS)缓冲液配制的5 %脱脂牛奶室温封闭PVDF膜1小时,然后加入5 %脱脂牛奶配制的一抗4℃孵育过夜,利用含0.1 % 吐温20的TBS洗膜3次;然后加入含0.1 % 吐温20的TBS配制的二抗室温孵育2小时,再利用含0.1 % 吐温20的TBS洗膜3次;最后利用化学发光检测仪器进行曝光分析。利用Quantity One 软件定量分析蛋白条带。
1.11 统计学分析
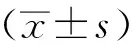
2 结果
2.1 血人参中异甘草素对巨噬细胞的细胞毒性
首先,本研究利用MTT测定方法分析了异甘草素对巨噬细胞的细胞毒性。结果显示,与对照组相比,异甘草素在80 μmol/L浓度对巨噬细胞存活有轻度的抑制作用,在40 μmol/L及其以下浓度无抑制作用,这表明该化合物在40 μmol/L以下浓度对巨噬细胞无显著细胞毒。见表2。
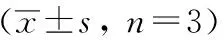
表 2 异甘草素对巨噬细胞的细胞毒性
2.2 血人参中异甘草素对LPS诱导巨噬细胞释放NO的影响
在完成异甘草素对巨噬细胞的细胞毒测定后,本研究进一步测定了其在无细胞毒剂量下对LPS诱导巨噬细胞释放NO的调节作用。结果显示,与对照组相比,LPS模型组能够显著刺激巨噬细胞释放NO; 与模型组相比,异甘草素各剂量组均能显著抑制LPS诱导巨噬细胞释放NO。见表3。

表3 异甘草素对LPS诱导巨噬细胞释放NO的影响
2.3 血人参中异甘草素对LPS诱导巨噬细胞炎症因子mRNA转录的影响
巨噬细胞表达和分泌的炎症因子在促进炎症反应发生中发挥重要作用,本研究利用qRT-PCR分析了异甘草素对LPS诱导巨噬细胞炎症因子mRNA转录的影响。结果显示LPS刺激能够显著增加巨噬细胞中TNF-α、IL-6、IL-1β、MIP-1α、MCP-1和IFN-β的mRNA转录,异甘草素能够剂量依赖性地抑制LPS诱导的炎症因子转录,特别是对IL-6、MCP-1和IFN-β的转录具有很强的抑制作用。见表4、表5。

表4 异甘草素对LPS诱导巨噬细胞炎症因子mRNA转录的影响

表5 异甘草素对LPS诱导巨噬细胞炎症因子mRNA转录的影响
2.4 血人参中异甘草素对LPS诱导巨噬细胞分泌炎症因子的影响
在通过实时荧光定量PCR测定发现异甘草素对巨噬细胞炎症因子转录的抑制作用之后,本研究继续利用ELISA测定研究异甘草素对巨噬细胞分泌的部分炎症因子的影响。结果显示LPS刺激能够显著增加巨噬细胞分泌TNF-α、IL-6、MCP-1和IFN-β,异甘草素能够呈剂量依赖性抑制MCP-1和IFN-β的分泌。综合qRT-PCR和ELISA的结果,异甘草素能够呈剂量依赖性抑制炎症因子的表达和分泌,特别是对MCP-1和IFN-β的表达和分泌具有很强的抑制作用。见表6。

表6 异甘草素对LPS诱导巨噬细胞分泌炎症因子的影响
2.5 人参中异甘草素对LPS诱导中性粒细胞活化的影响
在发现异甘草素对巨噬细胞炎症因子转录和分泌的抑制作用之后,本研究继续利用流式细胞测定研究异甘草素对中性粒细胞活化的影响。结果显示LPS刺激能够显著增加中性粒细胞释放活性氧,同时能促进中性粒细胞表面粘附分子CD11b的上调。异甘草素能够呈剂量依赖性抑制中性粒细胞释放活性氧,但是不能抑制CD11b的上调。见表7。

表7 异甘草素对LPS诱导中性粒细胞活化的影响
2.6 血人参中异甘草素对LPS诱导小鼠巨噬细胞信号通路活化的调节作用
LPS刺激巨噬细胞0.5小时后,NF-κB通路中P65蛋白发生显著的磷酸化修饰,MAPKs通路中P38、ERK1/2和JNK1/2也发生了显著的磷酸化修饰。LPS刺激巨噬细胞3小时后,IRFs通路中IRF3以及STATs通路中的STAT1和STAT3也发生了显著的磷酸化修饰。异甘草素能够显著抑制ERK1/2、JNK1/2和STAT1的磷酸化修饰,特别是对JNK1/2的磷酸化修饰具有很强的抑制作用。见图1、图2,表8、表9。

图1 异甘草素对巨噬细胞信号通路活化的调节作用(0.5小时)

图2 异甘草素对巨噬细胞信号通路活化的调节作用(3小时)
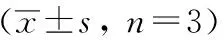
表8 异甘草素对LPS诱导巨噬细胞信号通路活化的调节作用

表9 异甘草素对巨噬细胞信号通路活化的调节作用
3 讨论
巨噬细胞和中性粒细胞是两种重要的天然免疫细胞,具有很强的病原识别、吞噬和清除功能。在炎症性疾病的发病过程中,巨噬细胞活化后,NF-κB和STAT1信号通路会被激活,进而导致NO合酶的增加,NO释放量增加。NO不仅能够杀伤侵入机体的微生物,同样也会加重体内的炎症反应。同时,巨噬细胞分泌的炎症因子TNF-α、IL-6和IL-1β直接激活巨噬细胞和中性粒细胞,趋化因子MIP-1α和MCP-1趋化中性粒细胞至炎症部位,加重体内的炎症反应[6]。并且巨噬细胞分泌的IFN-β也能够激活STAT1信号通路增强T细胞介导的细胞免疫反应,加重自身免疫性疾病的发展[7]。
中性粒细胞在炎症性疾病发病过程中同样发挥着重要作用[8]。在各种内外源致炎因子刺激下,中性粒细胞表面使细胞停驻在免疫器官的粘附分子CD62L会被内吞,同时使细胞进入炎症部位的粘附分子CD11b会上调,从而促使中性粒细胞由免疫器官进入炎症部位。炎症部位的中性粒细胞内NADPH氧化酶会被激活,合成大量超氧化物。超氧化物不仅会杀伤病原体,同时在炎症性疾病中也会导致严重的组织损伤[9]。在病理条件下,体内的活性氧产生和清除失衡,造成活性氧对机体的损伤。
血人参是贵州少数民族的特色苗药,具有清热解表、化痰、利湿、活血止痛之功效,在当地具有广泛的使用价值。然而,现代药理学对血人参的研究多集中在血人参提取物对肝损伤的体内研究[10-11],对于其在抗炎方面研究较少[12],其发挥抗炎药效的重要药效物质并不十分清楚。本研究在前期活性筛选时发现从血人参中提取分离的异甘草素具有显著的抗炎活性[13-14],这可能是其发挥药效的关键物质。因此本实验采用LPS诱导巨噬细胞和中性粒细胞活化模型,对异甘草素的抗炎作用进行分析。研究发现异甘草素能够抑制巨噬细胞释放NO和炎症因子的分泌,并且能够抑制中性粒细胞释放活性氧,这可能与异甘草素抑制JNK1/2、ERK1/2和STAT1的磷酸化有关。相对已有的研究,本研究通过体外实验更明确地阐明了异甘草素的抗炎作用及机制,这可能是血人参发挥药效的重要药效物质,但是对异甘草素发挥抗炎作用的药物靶点仍不清楚,在后续的研究中还需在此方面做出进一步探索。
