基于有效基准特征图谱质量表征的中药荷叶质量评价研究
2022-06-22王梦林巴寅颖武秋红李文霞路东波高园园孔静范圆圆黄玉娟孙仁弟黄广伟姜艳艳石任兵
王梦林 巴寅颖 武秋红 李文霞 路东波 高园园 孔静 范圆圆 黄玉娟 孙仁弟 黄广伟 姜艳艳 石任兵
荷叶为睡莲科植物莲NelumbonuciferaGaertn.的干燥叶,具有清暑化湿、升发清阳、凉血止血的作用[1]。荷叶作为药食同源中药品种,在保健品领域有着广泛的应用。荷叶的药效作用研究主要集中在减肥、调节脂代谢、抗氧化、降血糖等方面[2-7]。荷叶化学成份类型主要涉及黄酮类、生物碱类,以及有机酸类、甾类、挥发油类、蛋白质类等[8-9]。其中黄酮类成分主要为金丝桃苷、异槲皮苷、槲皮素、紫云英苷等[10~11],生物碱类成分主要为荷叶碱、O-去甲荷叶碱、2-羟基-1-甲氧基阿朴啡、莲碱、去甲乌药碱等[12-14]。2020版中国药典以荷叶碱的含量作为荷叶饮片的质量标准[1]。另有文献报道:采用高效液相色谱(high performance liquid chromatography,HPLC)法对荷叶中6种黄酮类成分(槲皮素、芦丁、金丝桃苷、山奈素、紫云英苷和异鼠李素)[15]、2种黄酮类成分(芦丁、槲皮素)和1种生物碱类成分(荷叶碱)[16]进行含量测定;采用一测多评法测定荷叶中的4种生物碱(荷叶碱、N-去甲基荷叶碱、O-去甲基荷叶碱和莲碱)含量[17];采用HPLC法建立不同产地荷叶饮片的指纹图谱,指认出2个黄酮类成分(芦丁、金丝桃苷)和1个生物碱类成分(荷叶碱),以芦丁为参照,对11个共有指纹峰进行了相对保留时间、相对峰面积表征,对12批荷叶饮片进行相似度评价[18];另有指认出1个黄酮类成分(槲皮素),并以槲皮素为参照,对10个共有指纹峰进行了相对保留时间、相对峰面积表征,对10批荷叶饮片进行相似度评价[19]。
本研究在本课题组前期建立的基于药物体系的中药饮片质量评价模式基础上[20-25],进一步开展基于有效基准特征图谱质量表征的中药荷叶质量评价,即以确定具有降血糖作用的荷叶饮片作为饮片基准,以其有效特征指标性成分荷叶碱作为质量表征基准点,建立荷叶有效基准特征图谱;继而以荷叶碱对照品模拟基准点,得到11个特征峰的相对保留时间、相对峰面积;5个特征代表性成分,其中3种黄酮类成分(金丝桃苷、紫云英苷、异槲皮苷)和2种生物碱类成分(荷叶碱、O-去甲荷叶碱)的相对含量、含量换算系数;即涵盖了荷叶的主要化学类型。并以基于此模拟基准点的荷叶饮片有效基准特征图谱质量表征信息作为其质量评价标尺,应用于14批荷叶样品质量优次的精准评价,同时也为有关药物的质量有效评价和控制提供了参考。
1 材料
1.1 主要仪器
沃特世2695型高效液相色谱仪,沃特世 2998 PDA检测器,Empower软件系统,自动进样器,Sartorius BT 25S型1/100 000电子分析天平(北京赛多利斯仪器有限公司),Sartorius BT 124S 型1/10 000电子分析天平(北京赛多利斯仪器有限公司),KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司),SHB-Ⅲ型循环水式多用真空泵(上海振捷实验设备有限公司)。
1.2 主要试药与试剂
金丝桃苷对照品(批号B20631)、荷叶碱对照品(批号B20500)、O-去甲荷叶碱对照品(批号B51051)、异槲皮苷对照品(批号B21529)、紫云英苷对照品(批号B21704),对照品均购自上海源叶生物科技有限公司,且纯度均≥98%;乙腈(色谱级)购自 Fisher Scientific 公司;娃哈哈纯净水购自杭州娃哈哈集团有限公司;甲醇(分析纯),购自北京化工厂。15批荷叶饮片购自云南、北京、河北各药店,北京中医药大学的刘春生教授鉴定其均为睡莲科植物莲NelumbonuciferaGaertn.的干燥叶。15批饮片样品现均存放于北京中医药大学中药学院中药化学系,15批荷叶饮片编号、购买地及批号、产地见表1。
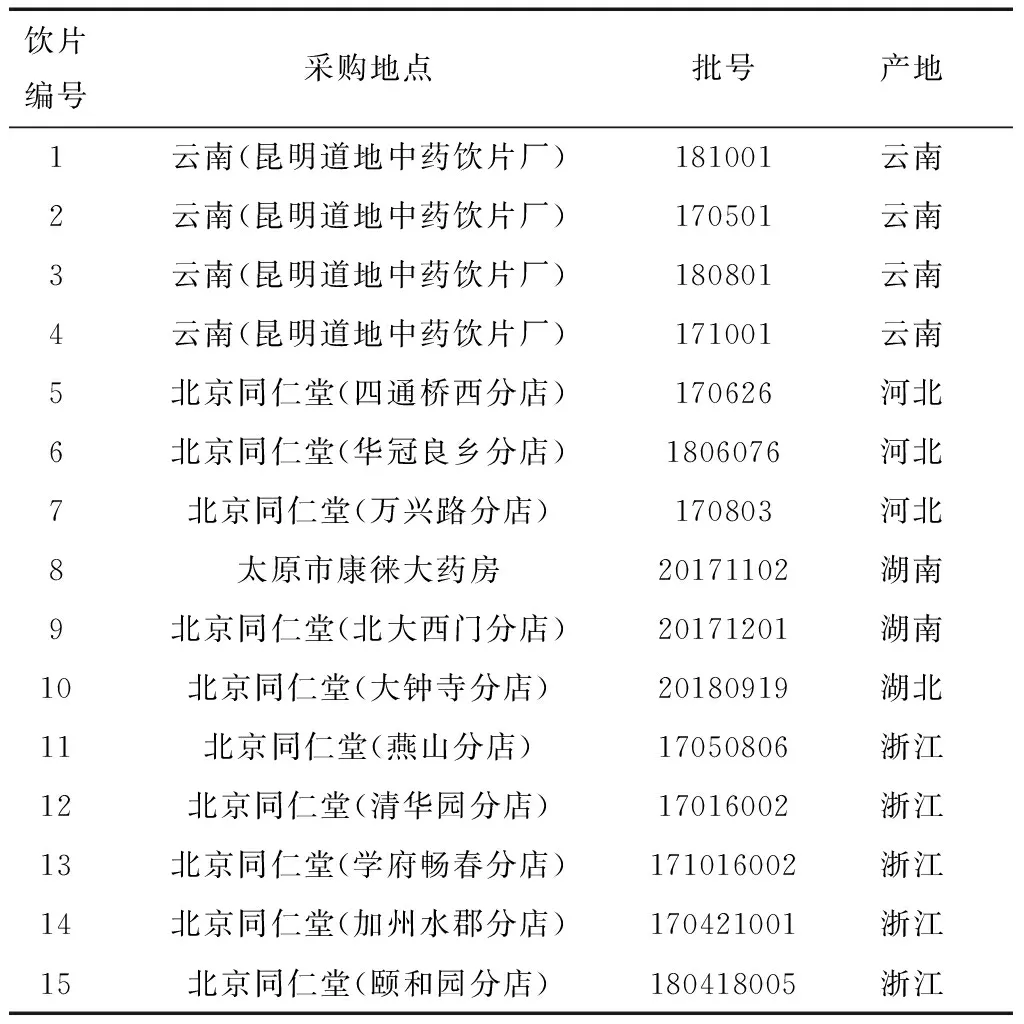
表1 荷叶饮片编号、购买地、批号及产地信息
2 方法与结果
2.1 荷叶有效基准特征图谱质量表征方法的建立
2.1.1 混合对照品溶液的制备 精密称取金丝桃苷、异槲皮苷、O-去甲荷叶碱、紫云英苷、荷叶碱对照品6.85 mg、8.81 mg、2.35 mg、4.07 mg、6.48 mg,分别置于5 mL的容量瓶中,加入溶剂(70%甲醇溶液),超声并使其溶解后用溶剂定容至刻度线,分别摇匀,即得浓度为1.370 mg/mL、1.762 mg/mL、0.470 mg/mL、0.814 mg/mL、1.296 mg/mL的金丝桃苷、异槲皮苷、O-去甲荷叶碱、紫云英苷、荷叶碱对照品母液,精密吸取以上各母液适量于容量瓶中,加入70%甲醇稀释,制备浓度为0.685 mg/mL、0.352 mg/mL、0.094 mg/mL、0.163 mg/mL、0.259 mg/mL的混合对照品溶液,备用。
2.1.2 供试品溶液的制备 称取0.5 g荷叶饮片(基准)粗粉,精密称定后将其转移至50 mL锥形瓶中,精密加入30 mL 溶剂(70%甲醇),加盖瓶塞后称定其质量,加热回流提取2小时,待锥形瓶冷却至室温后,称定其质量,用溶剂补足失重并摇匀,用微孔滤膜(直径0.45 μm)滤过,取续滤液,即得供试品溶液。
2.1.3 色谱检测条件 Waters XBridge C18 色谱柱(4.6 mm ×250 mm,5 μm),流动相为乙腈(A)-缓冲液(B)梯度洗脱(缓冲液组成为水∶磷酸∶三乙胺= 600∶1.2∶2.4)(梯度洗脱条件见表2),柱温为30 ℃,流速为0.8 mL/min,检测波长为270 nm,进样量为15 μL。混合对照品及荷叶供试品(基准)溶液的HPLC图谱见图1。通过11个特征峰的紫外吸收图谱指认其所属化学类型(如图1),色谱图中所关注的11个共有特征峰分离度良好,其中,图谱中1、2、7、10、11号特征峰属于生物碱类化学成分,3~6、8、9号特征峰属于黄酮类化学成分,该图谱体现了荷叶主要化学成分类型(生物碱类和黄酮类)。11个特征峰中,5号、6号、8号特征峰分别是金丝桃苷、异槲皮苷、紫云英苷,属于黄酮类;7号、11号特征峰分别是O-去甲荷叶碱、荷叶碱,属于生物碱类。

注:A 荷叶样品(270nm); B 混合对照品(270nm);1~2、10生物碱类;3~4、9黄酮类;5金丝桃苷;6异槲皮苷;7 O-去甲荷叶碱;8紫云英苷;11荷叶碱。

表2 HPLC梯度洗脱条件
2.1.4 有效基准特征图谱方法学考察 (1)精密度考察:分别精密吸取“2.1.2”中荷叶饮片(基准)供试品溶液15 μL,连续进样6次,选定荷叶碱为参照峰,计算各色谱峰与参照峰的相对峰面积、相对保留时间。计算结果显示:各色谱峰的相对峰面积、相对保留时间的相对标准偏差(relative standard deviation,RSD)均分别小于1.87%、1.85%,表明仪器精密度良好,并且符合特征图谱要求(RSD≤3%)[26]。(2)稳定性考察:分别精密吸取同一个“2.1.2”中荷叶饮片(基准)供试品溶液15 μL,并于第0、2、4、8、12、24 小时分别对其进样分析,选定荷叶碱为参照峰,计算各色谱峰与参照峰的相对峰面积、相对保留时间。计算结果显示:各色谱峰的相对峰面积、相对保留时间的RSD均分别小于2.87%、2.75%,表明荷叶样品溶液在24小时内稳定(RSD≤3%)[26]。(3)重复性考察:取同一批基准荷叶饮片,按照“2.1.2”项下方法制备供试品溶液,平行制备6份,对其分别进样分析,选定荷叶碱为参照峰,计算各色谱峰与参照峰的相对峰面积和相对保留时间。计算结果显示:各色谱峰的相对峰面积、相对保留时间的RSD均分别小于1.99%、1.96%,说明该方法重复性良好(RSD≤3%)[26]。
2.1.5 特征代表性成分含量测定方法学考察 (1)线性关系考察:精密吸取“2.1.1”项下的混合对照品溶液,用70%甲醇溶液稀释,制备一系列浓度不同的混合对照品溶液,按照“2.1.3”项下的色谱检测条件进样检测,测定各色谱峰面积。以对照品进样量(μg)为横坐标,峰面积为纵坐标绘制各对照品标准曲线,并计算回归方程和相关系数。计算结果显示,线性方程相关系数均大于0.99,符合测定要求(r≥0.99)[26]。结果见表3。(2)精密度考察:按照“2.1.3”项下的色谱检测条件,分别精密吸取同一个“2.1.2”项下荷叶饮片(基准、S1)的供试品溶液 15 μL,连续进样6次,测定金丝桃苷、异槲皮苷、O-去甲荷叶碱、紫云英苷、荷叶碱峰面积,以上各对照品峰面积RSD分别为0.83%、1.85%、1.62%、1.95%、1.26%,精密度良好(RSD均小于3%),符合含量测定要求(RSD≤3%)[26]。(3)稳定性考察:按照“2.1.2”项下方法制备荷叶饮片(基准、S1)的供试品溶液,于室温下放置,并于制备后第0、2、4、8、12、24 小时,按照“2.1.3”项下色谱检测条件进样检测,测定金丝桃苷、异槲皮苷、O-去甲荷叶碱、紫云英苷、荷叶碱峰面积,以上各对照品峰面积RSD分别为1.07%、1.80%、2.27%、2.63%、1.23%(RSD均小于3%),表明荷叶供试品溶液在24小时内稳定(RSD≤3%)[26]。(4)重复性考察:按照“2.1.2”项下方法制备同一个荷叶饮片(基准、S1)的供试品溶液,平行制备6份,进样,按照“2.1.3”项下检测条件,测定金丝桃苷、异槲皮苷、O-去甲荷叶碱、紫云英苷、荷叶碱峰面积,计算得各对照品平均含量分别为0.5497%、0.2876%、0.0911%、0.1604%、0.5005%,RSD分别为1.21%、1.57%、1.93%、1.89%、0.87%,表明此方法重复性良好(RSD≤5%)[26]。(5)加样回收率考察:精密称取已知含量的荷叶饮片(基准、S1)粗粉,平行称取6份,每份约0.5 g,置6个锥形瓶中,分别精密加入对照品溶液适量,然后按照“2.1.2”和“2.1.3”项下方法、色谱检测条件分别制备供试品溶液并进样检测,测定峰面积后计算,金丝桃苷、异槲皮苷、O-去甲荷叶碱、紫云英苷、荷叶碱平均加样回收率分别为98.72%、101.22%、100.82%、101.64%、100.59%,RSD分别为1.19%、0.54%、0.90%、1.06%、0.20%,该方法加样回收率合格,且符合定量要求(回收率95%~105%;RSD≤3%)[26]。结果见表4。

表3 荷叶5个特征代表性成分线性关系及线性范围(n=5)

表4 荷叶饮片5个特征性代表成分加样回收率考察结果(n=6)
2.1.6 模拟基准点质量表征考察 选定有效特征指标性成分荷叶碱作为质量表征基准点。精密称取4.20 mg荷叶碱对照品于5 mL容量瓶中,加70%甲醇溶液,超声使其溶解后定容至刻度并摇匀,即得浓度为0.840 mg/mL的荷叶碱对照品母液,精密量取该对照品母液1 mL于10 mL容量瓶中,加70%甲醇稀释,即得浓度为0.084 mg/mL的对照品溶液作为模拟基准点,该对照品溶液与“2.1.2”项下制备的荷叶饮片(S1)供试品溶液中所检测的荷叶碱含量相同,按照“2.1.3”项下条件进样检测,得模拟基准点的HPLC色谱图见图2和表5。

注:11 荷叶碱

表5 荷叶质量表征基准点质量表征结果
由表5可知,荷叶碱对照品(模拟基准点)与饮片(基准)供试品中荷叶碱(实测基准点)的保留时间(min)、峰面积相对偏差绝对值均小于3%,二者基本吻合,表明本检测方法及其测定结果、模拟荷叶质量表征基准点的准确性,即荷叶碱对照品溶液(0.084 mg/mL)可作为模拟质量表征基准点。
2.2 荷叶质量表征信息研究
有效基准特征图谱中11个特征峰的保留时间(min)、峰面积(以100 mg荷叶饮片计)、含量,基于模拟基准点得到的相对保留时间、相对峰面积及相对含量、换算系数(特征代表性成分的相对含量与相对峰面积的比值)结果见表6。
由表6可知,基于模拟基准点得到的11个特征峰及其相对峰面积、相对保留时间,5个特征代表性成分的相对含量,即为荷叶有效质量基准标尺。

表6 荷叶饮片(基准、S1、以100 mg计)有效基准特征图谱质量表征信息
2.3 荷叶质量评价及验证
取14批待评价的荷叶饮片样品粗粉,按照“2.1.2”项下的方法分别制备供试品溶液(每个样品平行制备3份),按照“2.1.3”项下条件进样检测,得到各批饮片质量表征信息,同时实测基准荷叶饮片(S1)有效基准特征图谱,以及14批待评价荷叶饮片特征性代表性成分(金丝桃苷、异槲皮苷、紫云英苷、荷叶碱、O-去甲荷叶碱)含量,以验证基于质量标尺对荷叶饮片进行质量评价具有准确性。结果如图3、4、5、6以及表7所示:

注:1~2、10生物碱类;3~4、9黄酮类;5金丝桃苷;6异槲皮苷;7 O-去甲荷叶碱;8紫云英苷;11荷叶碱
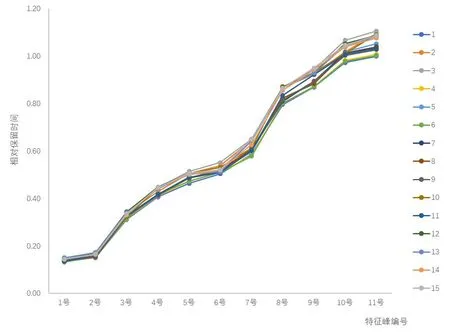
图4 14批荷叶饮片与基准(S1)相对保留时间

图5 14批荷叶饮片与基准(S1)的相对峰面积

图6 14批荷叶饮片与基准(S1)的相对含量
如图3、4所示,14批荷叶饮片特征图谱均含有11个相同的特征峰,且11个特征峰相对保留时间与实测值相吻合,与基准标尺基本一致。结果表明:14批样品均为荷叶饮片,并且验证了本文应用基准标尺辨别荷叶饮片真伪具有准确性。
通过图5、6可知所关注的14批荷叶饮片的质量表征信息,综合考量其特征峰的相对峰面积和相对含量、及其高于基准标尺对应点的数目、高出的幅度及其所涵盖的主要化学类型及所含荷叶碱同类成分,评估得出S14、S4、S9、S13、S8、S11、S7、S6质量较优。
由表7可得,换算含量值与实测含量值基本一致(均为P>0.05),此结果验证了特征代表性成分换算含量结果及其相对含量结果具有准确性。
综上所述,得出结论:可选定荷叶碱对照品作为模拟基准点,并以此模拟基准点为基准表征有效饮片基准,所表征的有效饮片基准质量表征信息可作为标尺,表征并评价待测饮片的质量。
3 讨论
笔者对供试品溶液的制备方法进行考察,考察后得出:70%甲醇溶液60倍量回流提取1次,提取2小时,效果最佳,可将荷叶饮片中生物碱类和黄酮类成分提取完全,故选用此法制备供试品溶液。
在采用HPLC-PDA法建立荷叶有效基准特征图谱质量表征方法时分别对流动相和检测波长进行了考察,考察后得到最优色谱条件:流动相为乙腈-磷酸(0.2%)-三乙胺水(0.4%) ,检测波长为 270 nm。
在对各特征峰峰面积进行质量表征时,峰面积均以100 mg荷叶饮片计,即,将峰面积换算为每100 mg样品下各特征峰的峰面积,以消除由于称样量不同而带来的误差。
本研究以自然药学观药物体系为导向[27-30],以降糖有效的荷叶为饮片基准,选择其特征指标性成分荷叶碱为质量表征基准点,以主要化学类型且具有降糖活性的特征代表性成分(金丝桃苷、异槲皮苷、紫云英苷、荷叶碱、O-去甲荷叶碱)[31-33]为质量考察指标,因而所构建的基准特征图谱质量表征方法充分体现荷叶质量的整体性、特征性、有效性;且以荷叶碱对照品模拟基准点,实现一测多评,可使得本评价方法具有准确性、便捷性、经济性和可行性。研究应用于对14批荷叶饮片质量优良度评价: S14、S4、S9、S13、S8、S11、S7、S6样品质量较优。本研究以一种新的模式去评价荷叶饮片的质量,可为荷叶及其制备物质量有效精准评价与控制提供方法、模式借鉴。
