中焦点穴对功能性消化不良大鼠十二指肠动力的干预作用及部分效应机制研究
2022-06-22杨丹妮陈幼楠葛东宇曲萌贺萌林小娟
杨丹妮 陈幼楠 葛东宇 曲萌 贺萌 林小娟
功能性消化不良(functional dyspepsia,FD)是一种涉及胃和十二指肠区域复杂症状的疾病,包括上腹痛或灼烧、餐后饱腹或早期饱腹[1]。因FD多为复合症状,难以针对性治疗,从而影响患者的生活质量。大约80%的消化不良患者没有结构性的病变,其生理病理机制尚不完全清楚,其中十二指肠运动障碍是主要的症状之一[2]。有研究发现[3],十二指肠的轻度炎症能引起局部感觉、运动障碍,从而导致腹胀、腹痛。腹部推拿可以调节中焦气机升降,促进胃肠道的蠕动。阑门穴是脏腑图点穴法第一式的起始穴,具有调理小肠分清泌浊的功效[4]。建里属任脉穴位,善于调理脾胃,具有消积化滞的功效,是治疗胃肠相关疾病中中焦气机不畅的常用穴[5]。阑门和建里都属于中焦穴位,用推拿点穴的方法可以调节中焦气机升降,对十二指肠动力产生良性调节作用[6-7]。胃肠动力的起搏和慢波的传导根植于Cajal间质细胞(interstitial cells of cajal,ICC),SCF/C-kit通路与ICC的增殖、发育、分化、表型维持等作用密切相关[8]。本文通过观察小肠推进率、十二指肠形态结构,检测肿瘤坏死因子α(tumor necrosis factor,TNF-α)、干细胞因子(stem cell factor,SCF)、C-Kit原癌基因(C-Kit proto-oncogeneprotein,C-Kit)、磷脂酰肌醇-3激酶(phosphatidylinositol-3-kinase,PI3K)的表达,探究中焦点穴治疗FD十二指肠动力障碍的可能机制。
1 材料与方法
1.1 实验动物
36只雄性健康SPF级SD大鼠,购自北京维通利华实验动物技术有限公司,6周龄,体质量约180~200 g。动物生产许可证号:SYXK(京)2016-0006。所有实验大鼠均于北京中医药大学良乡实验动物房中饲养,相对湿度40%~50%,温度(22±2) ℃,光照为12小时交替明暗,保持动物房环境通风整洁,及时更新食物及饮用水,适应性喂养7天后开始实验。该实验经北京中医药大学动物伦理委员会批准,审查批号:BUCM-4-2021032602-1058。
1.2 实验药物与试剂
枸橼酸莫沙必利(MREDA公司,02008221),ACK2阻断剂(BIOLEGEND公司,135131),SCF抗体(proteintech 公司,26582-1-AP),C-kit抗体(Abcam ,ab256345),GAPDH抗体(proteintech 公司,60004-1-lg),IgG兔二抗(proteintech 公司,SA00001-2),IgG鼠二抗(proteintech 公司 ,SA00001-1),TNF-α、SCF、C-Kit ELISA试剂盒(RGB&CHN,RGB-60080R、RGB-60501R、RRGB-60500R)。
1.3 实验仪器
赛默飞多功能酶标仪、赛默飞低温高速离心机、赛默飞超低温冰箱(美国Thermo Scientific公司),艾本德微量移液器(德国艾本德国际贸易有限公司),CP124S电子天平(德国SARTORIUS AG公司),DYY-6C型电泳仪(BIO-RAD Mini-TRANS-BLOT CELL),TS-8摇床(海门市其林贝尔仪器制造有限公司),化学发光、荧光成像系统(BIO-RAD GelDoc XR+)。
1.4 动物分组、造模及给药
36只大鼠编号后采用随机数字表法分为空白组、模型组、模型阻断组、西药组、点穴组、点穴阻断组,每组6只。采用轻度夹尾刺激法+不规则饮食法[7]对模型组、模型阻断组、西药组、点穴组、点穴阻断组造模,建立FD模型。夹尾刺激时,将造模大鼠随机分为5组,每6只一批放在同一桶内,用长海绵钳夹大鼠尾巴远端,激怒大鼠,使其前肢离地,寻衅与其他大鼠撕打以激怒全笼的大鼠,刺激30分钟/次,2次/天,两次间隔大于6小时。夹尾刺激后按原序号放回所属组内。单日禁食,双日投喂充足食物,饮水正常,造模共21天。模型阻断组、点穴阻断组从造模第5天起,以0.2 mg/kg的标准注射ACK2阻断剂,隔日一次,持续到干预结束。
造模结束后,各组大鼠正常喂养1天,第2天点穴组与点穴阻断组点拨阑门、建里穴(参照《实验针灸学》《脏腑图点穴法》)进行干预,以大鼠的头部为上,在阑门、建里穴施以左右方向的点拨,点穴层次以触及腹主动脉明显搏动为标准。每穴点拨6分钟,共12分钟。西药组给予莫沙必利药液(以大鼠与人临床用药剂量、体型系数公式计算并稀释成剂量为0.137 g/L水溶液)按照10 mL/kg灌胃,灌胃后抓取12分钟。上述组干预大鼠的同时也对空白组、模型组大鼠进行抓取12分钟、同体积生理盐水灌胃。6组大鼠在最后1次灌胃后禁食,24小时后进行标本采集。
1.5 标本采集
测定当天制备营养性半固体糊,称体重后按照10 mL/kg灌服。30分钟后麻醉断头处死大鼠,开腹,结扎幽门并剪开,迅速取出整段小肠,在测完小肠推进率后,取距大鼠幽门2~4 cm的十二指肠组织,迅速放于冻存管中-80℃保存。取距大鼠幽门4~6 cm的十二指肠组织放于固定液中,48小时后将固定的标本进行包埋处理。
1.6 小肠推进率计算
取出整段小肠后剥离肠系膜,将小肠铺于白纸上,用软尺测量幽门至回盲肠部全长及幽门至半固体糊前沿的距离。计算公式:小肠推进率=幽门至营养半固体糊前沿的距离/幽门至回盲部全长×100%。
1.7 十二指肠组织形态学观察
使用石蜡切片机切片(4 μm),室温,切片盒保存; 使用二甲苯及各浓度乙醇进行脱蜡,苏木素染色,分化,伊红染色,脱水,透明,封片。于生物显微镜下观察组织形态结构变化,经图像采集系统收集图片。
1.8 蛋白印记法(Weston blot,WB)检测SCF、C-Kit、PI3K蛋白的表达
取冻存的组织约0.02 g,置于组织匀浆器中,离心后取得上清液,用BCA法测定蛋白浓度,将样品加入loading buffer与PBS混匀,95℃加热5分钟使蛋白变性,上样。电泳设置80V 15分钟,100V 80分钟,电转400V 27分钟,室温封闭,加入稀释后的一抗,孵育4℃过夜。12小时后加入稀释后的二抗孵育1小时,成像。采用Image J软件分析各条带灰度值。
1.9 酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测十二指肠TNF-α、SCF、C-Kit的含量
取冻存的组织0.05 g,称重后置于组织匀浆器中,离心后取得上清液,按照ELISA试剂盒操作步骤进行检测,与标准品比较计算TNF-α、SCF、C-Kit的含量。
1.10 统计分析
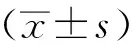
2 结果
2.1 一般情况的观察
造模期间,空白组的精神状况良好,食量及饮水正常,毛色鲜亮有光泽,排便成型。造模各组精神萎靡,出现眯眼、活动次数减少的现象。毛色枯黄无光泽,造模各组体型明显消瘦,食量减少。造模各组夹尾时易怒,常有与同伴厮打和跳出造模桶的现象,排便不成型,呈稀水样便。
2.2 中焦点穴对小肠推进率的影响
与空白组相比,模型组、模型阻断组、西药组小肠推进率明显降低(P<0.05);与模型组相比,点穴组、点穴阻断组小肠推进率明显上升(P<0.05);模型阻断组与点穴阻断组小肠推进率有显著差异(P<0.05)。如表1。
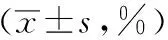
表1 各组FD大鼠小肠推进率的比较
2.3 中焦点穴对十二指肠形态结构的影响
各组十二指肠无明显器质性改变,模型组十二指肠黏膜层可见炎性细胞浸润,肌层变薄;干预后点穴组炎性细胞浸润有明显减少,肌层有恢复的趋势。如图1。
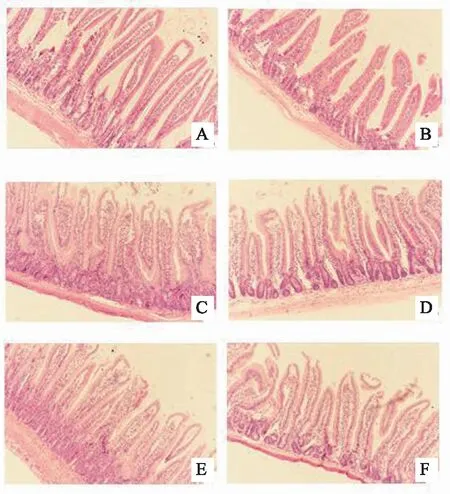
注: A 空白组;B 模型组;C 模型阻断组;D 西药组;E 点穴组;
2.4 ELISA法检测十二指肠组织中TNF-α、SCF、C-Kit表达的水平
与空白组相比,模型组、模型阻断组、点穴阻断组SCF、C-Kit表达显著降低、TNF-α表达显著升高(P<0.05);与模型组相比,西药组、点穴组SCF、C-Kit表达显著升高、TNF-α表达显著降低(P<0.05);与点穴组相比,点穴阻断组SCF、C-Kit表达显著降低、TNF-α表达显著升高(P<0.05)。如表2。
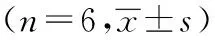
表2 各组FD大鼠十二指肠组织TNF-α、SCF、C-Kit含量的比较
2.5 Weston blot法检测十二指肠组织中SCF、C-kit、PI3K蛋白表达的水平
与空白组相比,模型组、模型阻断组、点穴阻断组蛋白的表达均显著降低(P<0.05),西药组的C-Kit、PI3K的表达显著降低(P<0.05);与模型组相比,西药组、点穴组蛋白的表达均显著升高(P<0.05);与点穴组相比,点穴阻断组SCF、PI3K的表达显著降低(P<0.05),C-Kit的表达有下降的趋势但无显著差异(P>0.05);西药组与点穴组相比PI3K的表达有显著差异(P<0.05)。如图2、表3。
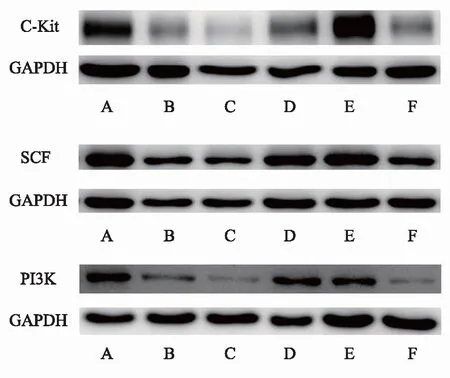
注: A 空白组;B 模型组;C 模型阻断组;D 西药组;E 点穴组;F 点穴阻断组
表3 各组FD大鼠十二指肠组织SCF、C-kit、PI3K蛋白表达的比较
4 讨论
现代研究中对功能性消化不良病理生理学的最新认识是将十二指肠作为致病中心,认为上腹痛或灼烧、餐后饱腹或早期饱腹多与十二指肠密切相关[9-11]。Miwa H等[11]人认为,FD的相关病理因素如胃酸分泌、幽门螺旋杆菌感染、微生物群、胃肠激素等都是通过刺激十二指肠而产生的。当十二指肠黏膜通透性增加时,会促使肠腔中的脂肪酸、胆汁酸、微生物等多种刺激物透过黏膜层,形成十二指肠低度炎症。Samsom等人[12]发现,给FD患者和健康人对照组的十二指肠注入酸时,与对照组相比,FD患者会产生十二指肠运动障碍。还有研究显示[13],FD常伴随十二指肠无力性收缩导致十二指肠运动障碍的产生。本实验结果与以上研究结论相一致,HE结果显示模型组、模型阻断组十二指肠黏膜层可出现炎性细胞浸润、肌层变薄的现象,提示本实验中FD模型可能存在十二指肠低度炎症。干预后点穴组炎性细胞浸润有明显减少,肌层有恢复的趋势。模型组小肠推进率与空白组相比显著降低,而在使用C-Kit阻断剂ACK2之后,模型阻断组的小肠推进率进一步降低,经过中焦点穴治疗后,小肠推进率明显上升,与空白组无明显差异,进一步提示本实验中FD伴随着十二指肠低度炎症和十二指肠动力障碍,中焦点穴可以缓解十二指肠低度炎症,并通过SCF/C-Kit通路恢复十二指肠动力。
实验结果中点穴阻断组的小肠推进率与空白组、点穴组无显著性差异可能是因为中焦点穴可能通过机械刺激改变腹部压力,从而加速食物通过胃肠道[14];中焦点穴通过调节交感神经与副交感神经促进十二指肠的运动。副交感神经起于第四脑室底部的迷走神经背核处,是迷走神经的主要成分,与交感神经在腹部共同负责内脏的运动[15]。Ting SJ等[16]发现,在十二指肠肌间神经丛中存在大量的交感神经与迷走神经轴突。研究显示,FD患者存在副交感神经张力的降低[17-18],在腹部进行推拿可以调节交感神经与副交感神经的活动,从而促进胃肠的蠕动[19]。
十二指肠的运动由肠壁内层的环行肌和外层纵行肌的舒缩运动共同完成,其运动形式分为三种:紧张性收缩、分节运动及蠕动。蠕动将分节运动后的肠内容物向前推进一步,到新的肠段再开始新的分节运动。慢波对于蠕动和分节运动的产生非常重要[20]。ICC是肠运动基本单位中重要的协调者[21]在十二指肠中主要存在两种ICC亚型,肌间ICC位于十二指肠环形肌与纵形肌之间,是慢波的起搏细胞;深肌神经丛位于十二指肠环形肌深部肠肌神经丛中,它们仅在小肠中发现,有介导肠道神经递质的作用[22]。酪氨酸激酶受体(C-Kit)是ICCs的特异性标志物,C-Kit的丢失会引起十二指肠动力障碍,SCF是C-Kit的天然配体,二者特异性结合后SCF/c-Kit通路可以调控ICCs的增殖、发育、分化与表型维持[23-25]。
胃肠道炎症因子TNF-α的表达上调被认为在FD的发病机制中起到了关键性的作用[26]。促炎性M1巨噬细胞分泌的TNF-α可以激活核因子κB通路抑制SCF的表达,通过降低ICCs细胞活力、增加细胞凋亡来诱导ICC的炎症性损伤[27]。 在 ICC 中,TNF-α还会降低 C-Kit表达并抑制 ICC 中的起搏电流、破坏ICC的表型并使ICC数量减少,从而使肠道蠕动异常[28]。本实验结果显示,模型组、模型阻断组、点穴阻断组SCF、C-Kit表达与空白组相比显著降低、TNF-α表达显著升高;与模型组相比,西药组、点穴组干预后SCF、C-Kit表达显著升高、TNF-α表达显著降低;与点穴组相比,点穴阻断组SCF、C-Kit表达显著降低、TNF-α表达显著升高,TNF-α与SCF、C-Kit的含量呈负相关,提示中焦点穴可以抑制FD大鼠十二指肠TNF-α的生成,进而恢复SCF、C-Kit的表达,从而影响ICC的增殖、发育、分化与表型维持。
PI3K是一种由p85、p110两种亚基组成的二聚体蛋白质[29]。PI3K的调节亚基p85 可经由SCF诱发,与C-Kit 的Tyr721、Tyr730相关位点结合,激活PI3K/Akt通路,磷酸化后的蛋白激酶B(protein kinase B,Akt)可使凋亡因子Bad蛋白构象发生改变从而使其失活,还可使凋亡因子Bax形成同源二聚体促进细胞凋亡[30],从而使PI3K/Akt通路发挥抗凋亡作用,维持ICC细胞增殖的状态[31]。有研究表明[32],PI3K的抑制剂LY 294002可在2~4天内抑制慢波的发展并阻止节律,出现慢波的振幅和频率随时间的减少,慢波消失的同时出现了肠内肌间ICC细胞消失。由此可知PI3K是肌间ICC增殖的关键下游信号,PI3K表达的减少会引起慢波消失与活动减弱,这与本实验结果相符。实验结果显示,模型组、模型阻断组、点穴阻断组SCF、C-Kit、PI3K蛋白的表达与空白组相比显著降低,西药组、点穴组蛋白的表达与模型组相比显著升高;与点穴组相比,点穴阻断组SCF、PI3K的表达显著降低,C-Kit的表达有下降的趋势但无显著差异。提示中焦点穴可能通过上调SCF/C-Kit通路,加强了ICC增殖信号PI3K的表达。
综上所述,中焦点穴可以抑制FD大鼠十二指肠TNF-α的生成,缓解十二指肠炎症,进而调节SCF/C-kit通路激活Cajal间质细胞增殖的相关信号,从而恢复十二指肠动力。
