新生儿败血症的代谢组学改变:一项探索性临床研究
2022-06-22童平黄芙蓉徐俊伍紫琦胡杏凌鸣王蝶吴不非杨独娇张爱民
童平 黄芙蓉 徐俊 伍紫琦 胡杏 凌鸣 王蝶 吴不非 杨独娇 张爱民
(1.湖南省人民医院急危重症代谢组学湖南省重点实验室,湖南长沙 410000;2.湖南省人民医院/湖南师范大学附属第一医院新生儿科,湖南长沙 410000)
新生儿败血症是指血液或者脑脊液等无菌标本中能培养出致病菌(包括细菌和真菌)引起的全身炎症反应综合征[1],全球5岁以下死亡儿童中约有40%发生在新生儿期,每年约290万新生儿死亡[2]。新生儿败血症在中国的发病率为4.5‰~9.7‰[3];在中国新生儿败血症的病死率为5%~10%[4],全球新生儿败血症总体病死率为1‰~5‰[5]。已有研究表明,适当的抗生素治疗每延迟1 h,病死率就会增加7%[6]。总的来说,新生儿败血症存在患病率高、病死率高的特点,同时新生儿作为特殊人群,其免疫、皮肤、黏膜屏障等发育不完善,一旦发生感染,易形成败血症,甚至快速发展为感染中毒性休克、多器官功能障碍等,纠其原因还是临床医生对新生儿败血症发生发展的机制不够清楚,不能及时地遏制病情的加重和恶化。而在过去的几十年里,已经进行了多项研究去探索其发病的代谢机制,在这一领域中,代谢组学技术似乎很有前景[7],其分析速度快,且可同时检测多种代谢产物的作用,已成为在临床检验应用中重要的新技术,使得其在新生儿败血症领域的研究不断增多,但是就目前的文献报道来看,暂未发现有关不同阶段的新生儿败血症代谢通路方面的研究报道。因此,本研究主要采用超高效液相色谱-四级杆飞行时间串联质谱(ultrahigh performance liquid chromatography/quadrupole time-of-flight mass spectrometer,UHPLC/Q-TOF-MS)技术对不同时间的新生儿败血症患儿间的血清样本进行检测,对比其血清代谢物之间的差异,以探索不同时间的新生儿败血症患儿间显著性差异代谢物主要涉及的代谢通路,将有助于临床医生早期诊断新生儿败血症,同时了解该病在不同阶段的代谢机制。
1 资料与方法
1.1 研究对象
前瞻性选取2019年1月1日至2020年1月1日在湖南省人民医院新生儿科住院的新生儿败血症患儿为败血症组,另选取同期门诊体检的健康新生儿为健康对照组。败血症组纳入标准:符合中华医学会儿科学分会新生儿学组2019年确定的新生儿败血症诊断标准[1]。排除标准:(1)存在其他重大非感染性疾病引起的全身应激反应;(2)存在先天性代谢异常疾病;(3)家属拒绝参与本研究。本研究获得了湖南省人民医院伦理委员会批准(儿科研伦审第521号)。
1.2 败血症诊断标准
(1)临床诊断为有临床异常表现,如发热、体温不稳定、反应差、呼吸困难、腹胀、低血压等,同时满足下列条件中任何1项:①血液非特异性检查≥2项阳性;②脑脊液检查为化脓性脑膜炎改变;③血中检出致病菌DNA。(2)确诊诊断为有临床表现,且血培养或脑脊液或其他无菌腔液培养阳性[1]。
1.3 血清UHPLC/Q-TOF-MS检测
收集败血症组入院第1天、第4天、第7天及健康对照组的血清各0.5 mL,置于-80℃冰箱保存,采用移液器吸取上清液约100μL加入EP管中,加入10μL内标(L-2-氯苯丙氨酸,0.3 mg/mL,甲醇配置),涡旋震荡10 s;加入300μL的蛋白沉淀剂甲醇-乙腈(2∶1,v/v),涡旋震荡1 min;冰水浴中超声提取10 min;20℃下静置30 min;离心15 min(13 000 r/min,4℃),取0.5 mL注射器取上清液经过滤膜过滤后,留取约200μL至小样瓶中。质控样本为所有样本各取50μL,涡旋混匀制备而成。将各组样本放置于UHPLC/Q-TOF-MS平台进行代谢产物分离检测。检测的色谱条件为:AcclainmTMRSLC120-C18色 谱 柱 (100 mm×2.1 mm),柱温保持在40℃,进样量3μL;流动相A为0.1%(体积分数)甲酸/水(含2 mmoL/L甲酸铵),流动相B为0.1%(体积分数)乙腈/水。质谱条件为:电喷雾离子源(electrospray ion source,ESI+),采用正离子模式检测,使用高纯氮气辅助喷雾电离与脱溶剂,干燥气温200℃流速为1.2 L/min,扫描范围20~1 000 m/z。
1.4 代谢组学数据分析
将检测出的样品质谱图,导入Metaboscape 3.0软件进行峰提取、除噪、标准化等数据预处理,数据经预处理后得到代谢物的质荷比、保留时间、代谢物信息等数据。首先删除离群值,并基于内标进行归一化处理;再将归一化后三维数据矩阵导入SIMCA-P+14.1软件对数据进行正交偏最小二乘法判别分析(orthogonal-partial least square discriminant analysis,OPLS-DA)以建立模型,同时对该模型进行响应置换检验200次,评估模型有无过度拟合问题,结合变量投影重要性(variable importance projection,VIP)值初步筛选差异代谢物;通过OPLS-DA模型的VIP值(VIP>1.8)和P<0.05来筛选潜在的显著性差异代谢物;最后采用MetaboAnalyst 4.0数据库对显著性差异代谢物进行代谢通路分析。
1.5 统计学分析
采用SPSS 24.0统计软件对数据进行统计学分析。非正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用秩和检验;计数资料采用例数表示,两组间比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般结果
研究期间我院共收治新生儿1 538例,其中诊断新生儿败血症32例,因家属拒绝参与、放弃治疗及患儿存在代谢异常等原因排除12例,最终败血症组纳入20例,其中临床诊断新生儿败血症13例,确诊诊断新生儿败血症7例;健康对照组纳入10例。两组性别、胎龄、出生体重、就诊日龄比较,差异均无统计学意义(P>0.05),见表1。
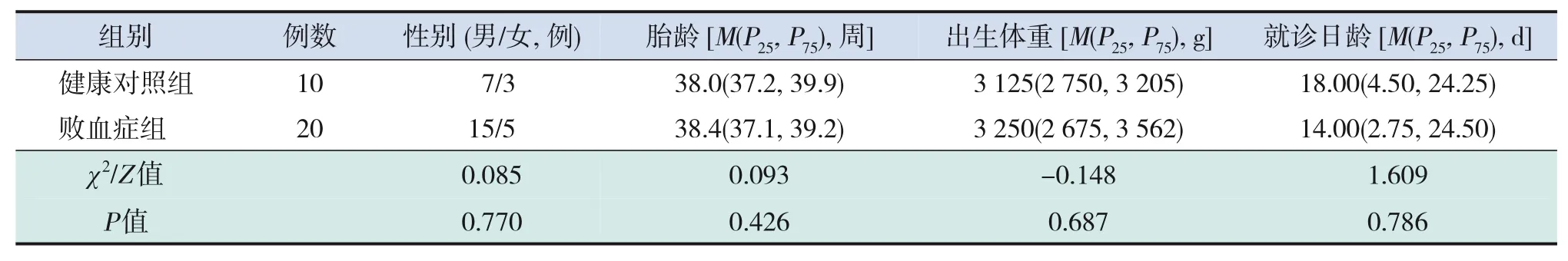
表1 败血症组与对照组患儿的一般资料比较
2.2 OPLS-DA结果
败血症组入院第1天与健康对照组之间、不同时间的败血症组之间的代谢物均存在显著差异,代谢产物相距甚远(图1)。同时对所构建的OPLSDA模型经过200次置换检测,发现该模型不存在“过拟合”现象,该模型区分程度好,预测率高。
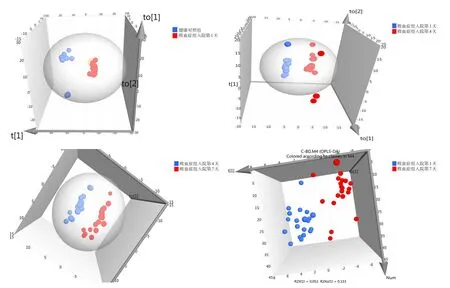
图1 OPLS-DA得分图
2.3 显著性差异代谢物筛选
根据OPLS-DA模型的VIP值结合P值结果(VIP>1.8且P<0.05)初步筛选显著性差异代谢物,再将筛选出的显著性差异代谢物与人类代谢组数据库和有机小分子生物活性数据库资源中的数据进行比较,进一步鉴定显著性差异代谢物,筛选出的结果为:与健康对照组相比,败血症组入院第1天时有12种升高的血清差异代谢物,分别为苯丙氨酸、法尼基焦磷酸、6-磷酸葡萄糖、乳糖、4-羟基甲苯丁酰胺、伊洛前列素、顺式8,11,14,17-二十碳四烯酸、皮质酮、雌三醇3-硫酸盐16-葡糖醛酸、苯乙酰胺、血氧烷B2、二氯二甲基二乙胺;与败血症组入院第1天时相比,入院第4天时有5种血清差异代谢物,升高的为丙酮酸,下降的分别为3-羟基-9-十六碳酰肉碱、血管紧张素Ⅲ、吡啶啉、三羟基椰子酸;与败血症组入院第4天时相比,入院第7天时有7种血清差异代谢物,升高的为18-羟基皮质酮、硝基呋喃酮、吡啶啉、S-腺苷同型半胱氨酸、十四烷基硫酸钠、二十烷醇,下降的为反式-2-十二碳酰肉碱;与败血症组入院第1天时相比,入院第7天时有14种血清差异代谢物,升高的为脑啡肽,下降的为花生四烯酸乙醇胺、血管紧张素Ⅲ、药用酸3-O-b-D-葡糖醛酸、N,N-二甲基甲酰胺、牛磺脱氧胆酸、尼氟酸、棕榈酰葡糖醛酸、焦磷酸盐、血清素、牛磺酸、反式-3-羟基烟碱葡萄糖醛酸、尿素、D-葡萄糖醛酸。
2.4 代谢通路分析
最后利用MetaboAnalyst 4.0数据库对败血症组入院第1天与健康对照组、不同时间的败血症组之间的显著性差异代谢物进行代谢通路的富集分析与拓扑分析,发现败血症组入院第1天与健康对照组相比、败血症组入院第4天与入院第1天相比、败血症组入院第7天与入院第4天相比、败血症组入院第7天与入院第1天相比显著性差异代谢物主要涉及的代谢通路分别为萜类骨架的生物合成、丙酮酸代谢、半胱氨酸和蛋氨酸代谢、抗坏血酸代谢。见表2。
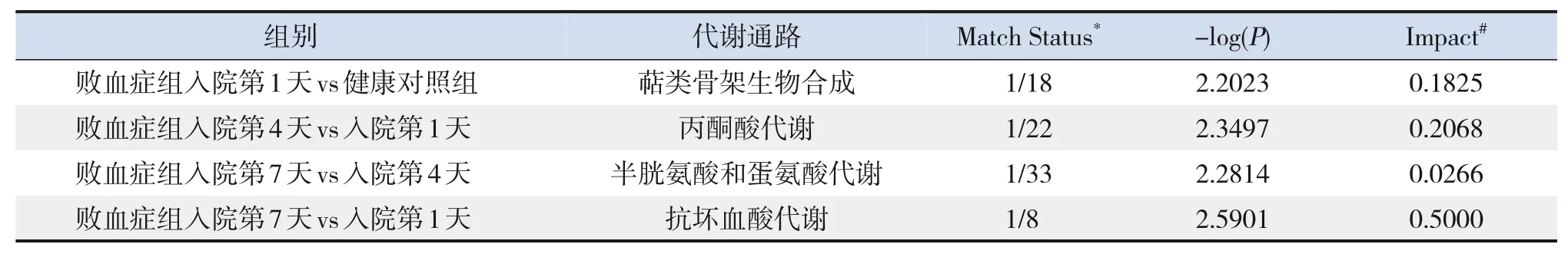
表2 各组显著性差异代谢物的代谢通路富集及拓扑分析表
3 讨论
新生儿因其免疫力低下,一旦受到外界感染,易快速形成败血症,往往病情进展迅速,可造成严重的后遗症甚至死亡。若能鉴定并监测与新生儿败血症发生发展过程中的代谢产物及引起的代谢通路变化情况,将有助于临床医生了解该病不同阶段动态变化的代谢机制,从而指导临床治疗,提高抢救成功率。近些年发展起来的新型代谢组学技术,其中UHPLC/Q-TOF-MS技术具有定量、定性、高度特异性及高灵敏度的特点,尤其适用于新生儿败血症血清代谢特点的研究。因此,本研究利用UHPLC/Q-TOF-MS技术平台检测不同时间的败血症患儿及健康新生儿的血清代谢物,发现其显著性差异代谢物主要涉及的代谢通路分别为萜类骨架生物合成、丙酮酸代谢、半胱氨酸和蛋氨酸代谢、抗坏血酸代谢。
萜类物质存在广泛的药理作用,包括抗肿瘤、抗炎、抗动脉粥样硬化和抗疟疾活性[8-11],其中著名的青蒿素及其半合成衍生物也已被证明可通过发挥抗氧化应激的作用,减轻中枢神经系统炎症反应[12-14]。本研究发现在发生败血症时萜类骨架生物合成增加,考虑为机体在早期发生败血症时启动的自我防御机制,此研究的发现也为临床上开发新药物治疗新生儿败血症奠定了基础。
丙酮酸具有清除活性氧的能力,而活性氧与休克或缺血/再灌注损伤引起的器官损伤发病机制有关[15]。治疗性给予丙酮酸可以保护啮齿类动物免受H2O2引起的肾损伤[16]。在机体发生脓毒症抗氧化过程中,细胞会将丙酮酸释放到血浆和血清中,以保护细胞免受氧化应激[17]。丙酮酸的简单衍生物,丙酮酸乙酯可以改善器官功能,且具有高效的抗氧化和抗炎作用,丙酮酸乙酯可显著提高生存率并减少肠道组织学改变,抑制血浆中IL-1、IL-6和干扰素-α的水平,并增加IL-10的水平,同时增强肝脏组织总体抗氧化能力[18]。总之,丙酮酸可清除活性氧,丙酮酸乙酯可改善系统性炎症和多器官功能障碍,抑制多种早期炎症细胞因子和晚期炎症细胞因子[19]。本研究发现在新生儿败血症入院第4天与入院第1天相比,机体产生了更多的丙酮酸,以保护细胞免受氧化应激,并且通过丙酮酸代谢通路为机体快速提供能量。
有研究发现,在脓毒症患者中血浆S-腺苷甲硫氨酸和S-腺苷同型半胱氨酸水平升高[20],严重脓毒症患者的血清半胱氨酸水平显著高于健康对照组[21]。败血症患者半胱氨酸水平与存活状态有关[22]。在新生儿的一项研究中,发现窒息或败血症新生儿尿液中出现了大量游离半胱氨酸,经过研究证明半胱氨酸水平与新生儿败血症性休克的严重程度相关[23]。在发生脓毒症时,大鼠肝脏半胱氨酸增加约79%[24],表明这是机体的一种保护机制,使得机体能够抵抗感染。对重症监护室中的64例严重脓毒症或感染性休克患者的尿样进行核磁共振光谱技术检测发现,预后不良的患者乙醇、葡萄糖、马尿酸水平较高,蛋氨酸、谷氨酰胺、精氨酸、苯丙氨酸水平较低[25]。以上结果均表明与此研究中半胱氨酸-蛋氨酸代谢途径产物在败血症恢复期显著下降相符,证实了在疾病恢复期机体通过显著减少半胱氨酸与蛋氨酸的代谢,来维持机体稳态的机制。
有研究显示,危重患者的抗坏血酸水平下降,动物和临床试验均证明补充抗坏血酸可改善重症患者的病情[26-28],其发挥的作用主要是通过减轻脂质过氧化,降低血管通透性,改善血流动力学稳定性,使得器官损伤和功能障碍减少。Marik等[29]发现补充抗坏血酸可以降低危重患者的病死率,一项荟萃分析也表明静脉使用适量的抗坏血酸减少了血管加压药和机械通气的持续时间,降低了总体病死率[30]。另有研究通过给予大剂量抗坏血酸进行抗氧化剂治疗,可减少烧伤后脂质过氧化,降低血管通透性,减少烧伤和未烧伤组织的水肿,同时减少了复苏液[31-33]的用量,与本研究中发现参与该代谢途径的D-葡萄糖醛酸到了入院第7天相对入院第1天而言有下降,提示在新生儿败血症恢复期,机体消耗了大量的D-葡萄糖醛酸,参与了抗坏血酸代谢途径,以此来改善病情。
总之,本研究首次利用UHPLC/Q-TOF-MS技术,对不同时间的新生儿败血症及健康新生儿的血清进行检测,该方法检测的血清需求量少,并可一次性检测多种代谢物,符合临床的需求,而且同时此研究还采用了科学的统计方法,结果真实可靠,发现了不同时间的新生儿败血症显著性差异代谢物主要涉及萜类骨架生物合成、丙酮酸代谢、半胱氨酸和蛋氨酸代谢、抗坏血酸代谢途径。
利益冲突声明:所有作者均声明不存在利益冲突。
