甲状腺球蛋白抗体和甲状腺过氧化物酶抗体在儿童免疫性血小板减少症中的表达及临床意义
2022-06-22王学梅海力其古丽努日丁刘玉古丽巴哈买买提严媚
王学梅 海力其古丽·努日丁 刘玉 古丽巴哈·买买提 严媚
(新疆医科大学第一附属医院儿内一科,新疆乌鲁木齐 830054)
免疫性血小板减少症(immune thrombocytopenia,ITP)是以血小板(platelet,PLT)数量减少、自发性出血为特征的儿童常见出血性疾病,目前临床治疗以防止严重出血为主要目的,一般预后良好。但部分ITP患儿病情可发生迁延,进展为慢性ITP,引起重度皮肤黏膜、脏器出血,增加患儿死亡风险[1]。吕明恩等[2]研究中慢性ITP患儿3个月疾病缓解率仅为22.80%,提示慢性ITP患儿预后较差。因此寻找客观指标评估儿童ITP,并分析ITP临床分型,对制定合理的治疗方案、改善患儿预后具有重要临床意义。甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)是在甲状腺病理损伤后释放至血液中,已被证实在自身免疫性疾病中呈异常表达[3]。甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)是自身免疫性甲状腺疾病诊断、评估预后的重要指标,是机体免疫系统受到刺激后产生,Gallo等[4]已证实TPOAb与机体免疫功能密切相关。且研究指出,ITP的发生、进展与机体免疫机制密切相关[5]。结合TGAb、TPOAb的作用与ITP的发病机制,初步推测二者可能与儿童ITP发病及临床分型有关。鉴于此,本研究探讨TGAb、TPOAb在儿童ITP中的表达及临床意义。
1 资料与方法
1.1 研究对象
前瞻性选择2019年10月至2021年10月我院收治的120例ITP患儿作为ITP组,另选择60例非ITP患儿作为非ITP组。纳入标准:(1)ITP组:①ITP符合《儿童原发性免疫性血小板减少症诊疗规范(2019年版)》[6]中相关诊断,血常规检查至少2次提示PLT计数<100×109/L,表现为皮肤黏膜出血、脏器出血等。②参照上述诊疗规范[6]判定ITP患儿临床分型,包括新诊断ITP:病程<3个月;持续性ITP:3个月≤病程≤12个月;慢性ITP:病程>12个月。(2)非ITP组:非ITP组患儿为非ITP,如感染、药物等引起的PLT减少,血栓性PLT减少等。排除标准:(1)合并原发性、继发性免疫缺陷病;(2)合并过敏性紫癜、风湿性疾病;(3)合并弥散性血管内凝血、血友病等其他出血性疾病;(4)合并溶血性贫血、急性白血病等其他血液系统疾病;(5)近期接受过免疫制剂治疗或激素药物治疗。
本研究经我院医学伦理委员会批准(211129-01),患儿家属签署知情同意书。
1.2 样本量计算
根据样本量计算公式:n=计算样本量,其中n为ITP组例数,设双侧α=0.01,β=0.05,把握度1-β为95%;k为ITP组与非ITP组的比例,本研究中为2;σ1、σ2分别为ITP组与非ITP组的标准差(分别将TGAb、TPOAb的标准差带入计算),δ为ITP组与非ITP组平均值的差值(分别将TGAb、TPOAb的平均值差值带入计算)。利用PASS 15软件计算得到ITP组样本量为81,非ITP组样本量为41。考虑失访及拒访的情况以30%计算,最终至少需要的ITP组样本量≥116例,非ITP组样本量≥59例,最终纳入120例ITP患儿及60例非ITP患儿作为研究对象。
1.3 基线资料收集
设计患儿临床资料调查表,由患儿家属代为填写,内容包括患儿年龄、性别、体重指数(body mass index,BMI)、感染情况(艾滋病病毒、丙型肝炎病毒及幽门螺旋杆菌等)、其他诱发因素(遗传因素、疫苗注射等)、发病季节(春季、夏季、秋季、冬季)、黏膜出血(有、无)、皮肤出血(有、无)等情况。
1.4 实验室指标检测
入院当日或次日清晨采集患儿空腹静脉血15 mL,分装于3支试管中:(1)取5 mL血液样本,抗凝处理后放入流式检测管中,使用DxFLEX型流式细胞仪(贝克曼库尔特生物科技)测定T淋巴细胞亚群,包括CD3+、CD4+、CD8+。(2)另取5 mL血液样本,离心15 min(半径10 cm,转速3 500 r/min),使用ST800型凝血分析仪(阿里生物技术)测定血浆凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝 血 酶 时 间(thrombin time,TT)、纤 维蛋白原(fibrinogen,FIB)。(3)剩余5 mL血液样本,离心10 min(半径10 cm,转速3 000 r/min),使用DS-500C型血细胞分析仪(深圳理邦实验生物电子)测定PLT水平;使用ADVIA Centaur型化学发光免疫分析仪测定血清TGAb、TPOAb水平,仪器与试剂盒够自德国西门子公司。
1.5 统计学分析
用SPSS 25.0统计学软件处理数据。符合正态分布计量资料以均数±标准差(±s)表示,两组间比较采用两样本t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;计数资料以例数和率(%)表示,率的比较采用χ2检验,若最小理论频数<5,采用Fisher确切概率法。采用有序logistic回归分析检验各因素对ITP临床分型的影响。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算ROC曲线下面积(area under curve,AUC),分析TGAb、TPOAb对ITP临床分型的评估价值,AUC<0.5为无价值,0.5≤AUC<0.7为价值较低,0.7<AUC≤0.9为价值中等,>0.9为价值高。P<0.05表示差异有统计学意义。用R 4.1.0统计学软件与rmda软件包,以高风险阈值为横坐标、净收益率为纵坐标,绘制决策曲线,分析TGAb、TPOAb评估ITP临床分型的净收益率。
2 结果
2.1 ITP组与非ITP组临床资料与实验室指标比较
ITP组患儿CD3+、CD4+比例及PLT计数低于非ITP组,CD8+比例及TGAb、TPOAb水平高于非ITP 组(P<0.05)。2组患儿年龄、性别、BMI、凝血功能比较,差异无统计学意义(P>0.05)。见表1。
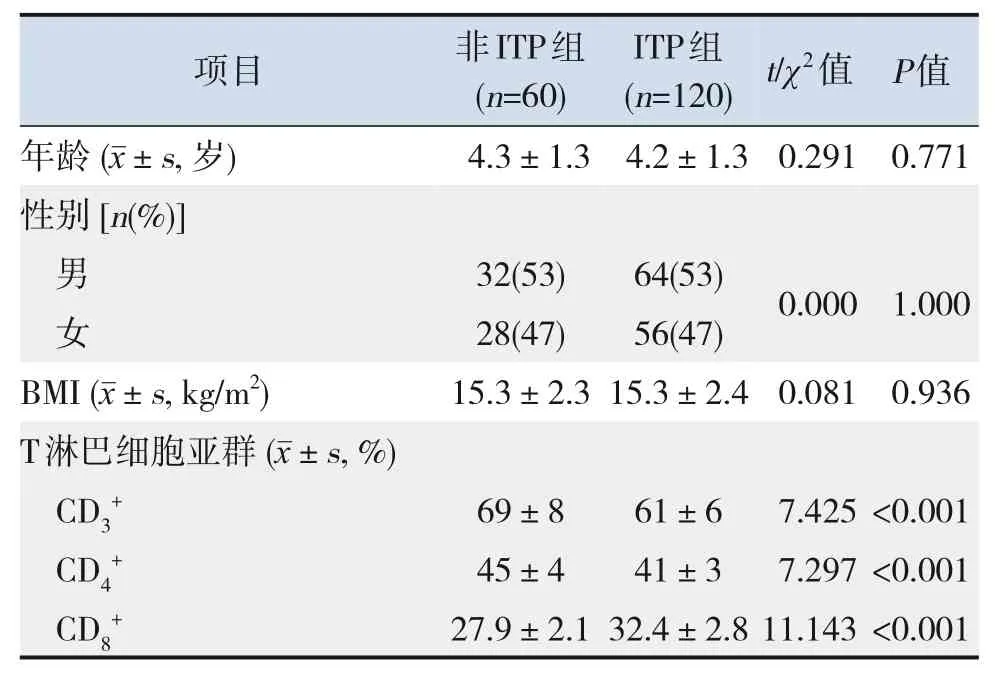
表1 ITP组与非ITP组临床资料与实验室指标比较
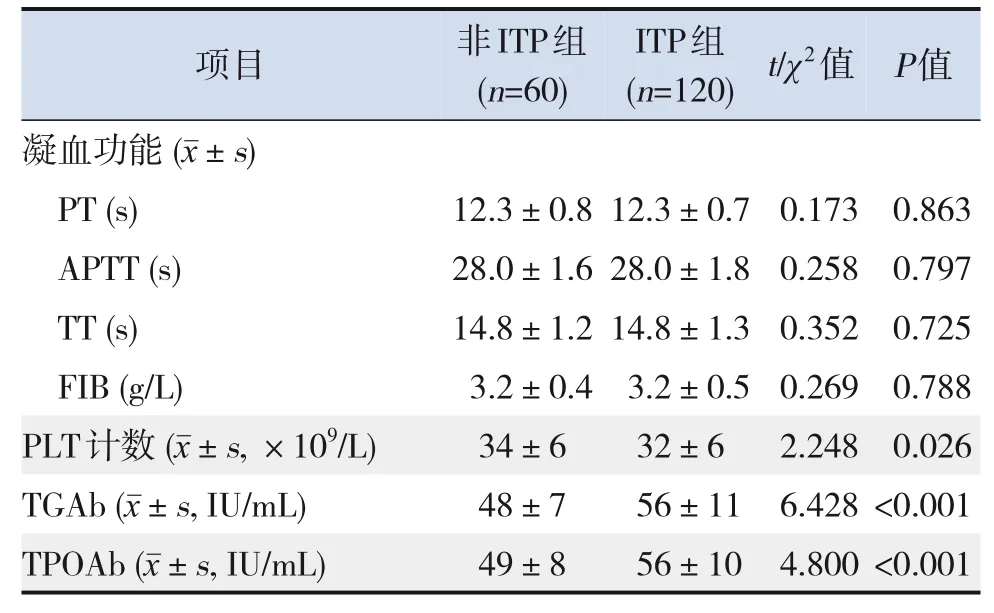
表1(续)
2.2 不同ITP临床分型患儿临床资料比较
120例ITP患儿中新诊断ITP 53例(44.2%),持续性ITP 42例(35.0%),慢性ITP 25例(20.8%)。3组患儿年龄、性别、BMI、诱发因素、发病季节及黏膜出血、皮肤出血情况比较差异无统计学意义(P>0.05)。见表2。
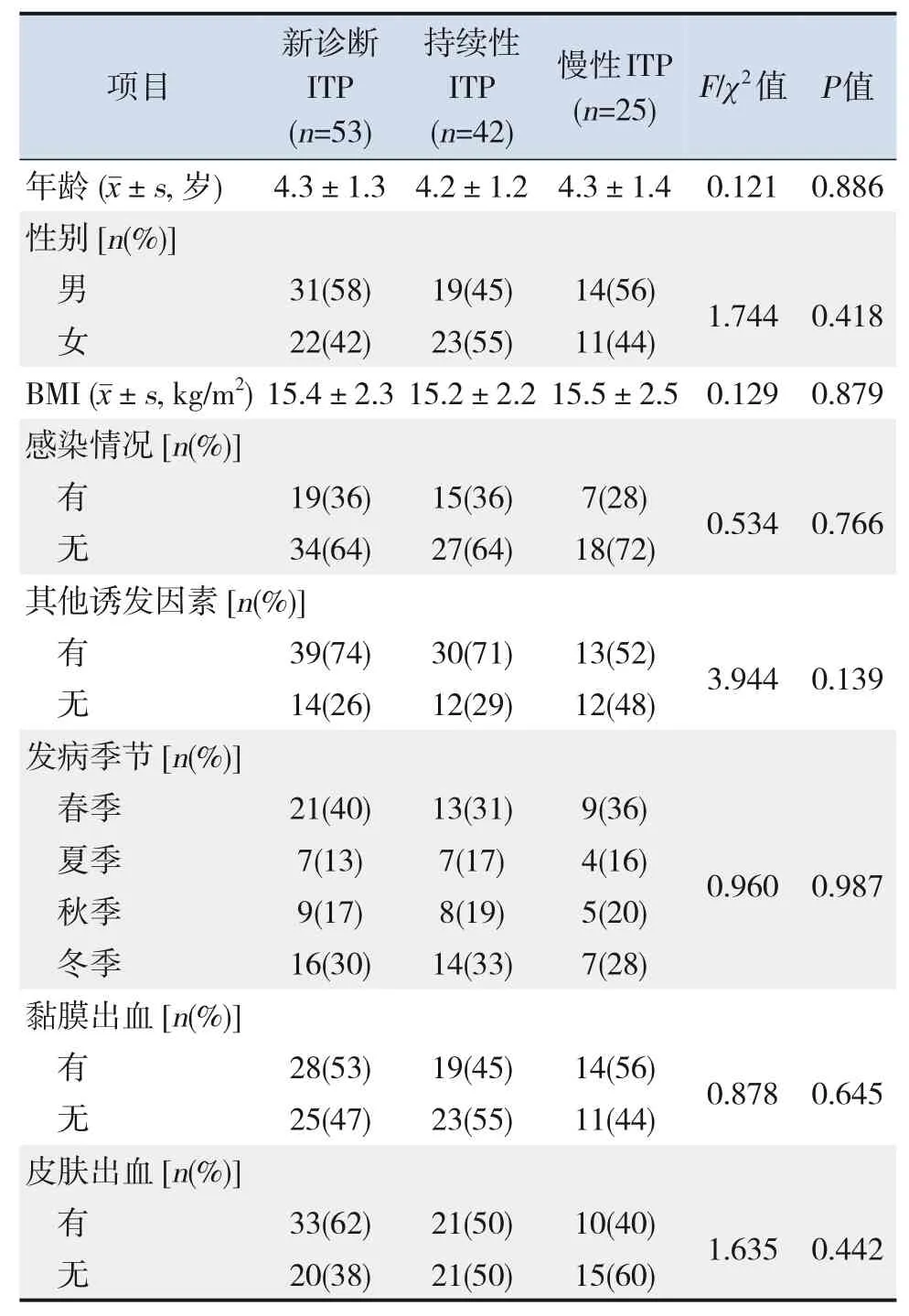
表2 不同ITP临床分型患儿临床资料比较
2.3 不同ITP临床分型患儿实验室指标比较
慢性ITP患儿CD3+、CD4+比例及PLT计数低于新诊断ITP、持续性ITP患儿,CD8+比例及TGAb、TPOAb水平高于新诊断ITP、持续性ITP患儿(P<0.05);新诊断ITP与持续性ITP患儿实验室指标比较差异无统计学意义(P>0.05)。见表3。
表3 不同ITP临床分型患儿实验室指标比较 (±s)
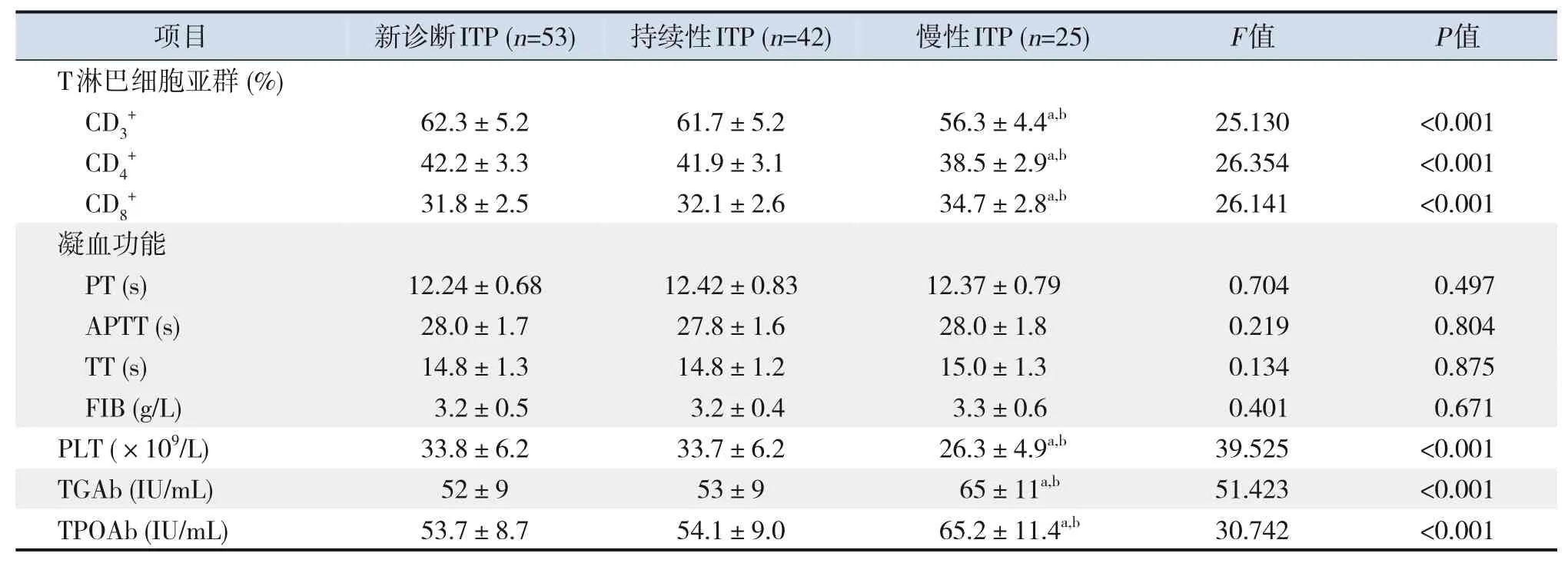
表3 不同ITP临床分型患儿实验室指标比较 (±s)
注:a示与新诊断ITP比较,P<0.05;b示与持续性ITP比较,P<0.05。[ITP]免疫性血小板减少症;[PT]凝血酶原时间;[APTT]活化部分凝血活酶时间;[TT]凝血酶时间;[FIB]纤维蛋白原;[PLT]血小板;[TGAb]甲状腺球蛋白抗体;[TPOAb]甲状腺过氧化物酶抗体。
项目T淋巴细胞亚群(%)CD3+CD4+CD8+凝血功能PT(s)APTT(s)TT(s)FIB(g/L)PLT(×109/L)TGAb(IU/mL)TPOAb(IU/mL)新诊断ITP(n=53)62.3±5.2 42.2±3.3 31.8±2.5 12.24±0.68 28.0±1.7 14.8±1.3 3.2±0.5 33.8±6.2 52±9 53.7±8.7持续性ITP(n=42)61.7±5.2 41.9±3.1 32.1±2.6 12.42±0.83 27.8±1.6 14.8±1.2 3.2±0.4 33.7±6.2 53±9 54.1±9.0慢性ITP(n=25)56.3±4.4a,b 38.5±2.9a,b 34.7±2.8a,b 12.37±0.79 28.0±1.8 15.0±1.3 3.3±0.6 26.3±4.9a,b 65±11a,b 65.2±11.4a,b F值25.130 26.354 26.141 0.704 0.219 0.134 0.401 39.525 51.423 30.742 P值<0.001<0.001<0.001 0.497 0.804 0.875 0.671<0.001<0.001<0.001
2.4 ITP临床分型影响因素的logistic有序回归分析
将ITP临床分型作为因变量(0=非ITP,1=新诊断ITP,2=持续性ITP,3=慢性ITP),将CD3+、CD4+、CD8+、PLT、TGAb、TPOAb纳入作为自变量(均为连续变量),行有序logistic回归分析结果显示,CD8+比例及TGAb、TPOAb水平高表达与儿童慢性ITP的发生密切相关(OR>1,P<0.05),CD3+、CD4+比例低表达与儿童慢性ITP的发生密切相关(OR<1,P<0.05)。见表4。
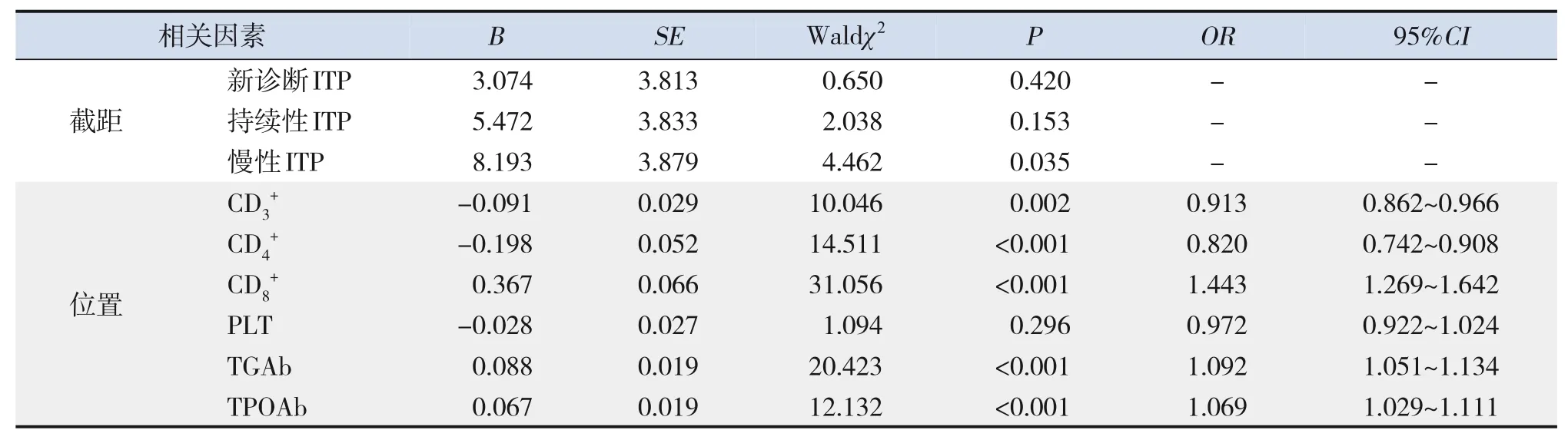
表4 ITP临床分型影响因素的logistic有序回归分析
2.5 TGAb、TPOAb对儿童慢性ITP的预测价值
将血清TGAb、TPOAb作为检验变量,将ITP临床分型作为状态变量(1=慢性ITP,0=新诊断ITP、持续性ITP),绘制ROC曲线(图1),结果显示,TGAb、TPOAb及TGAb+TPOAb评估儿童慢性ITP的AUC>0.80,具有一定的预测价值(P<0.001),见表5。
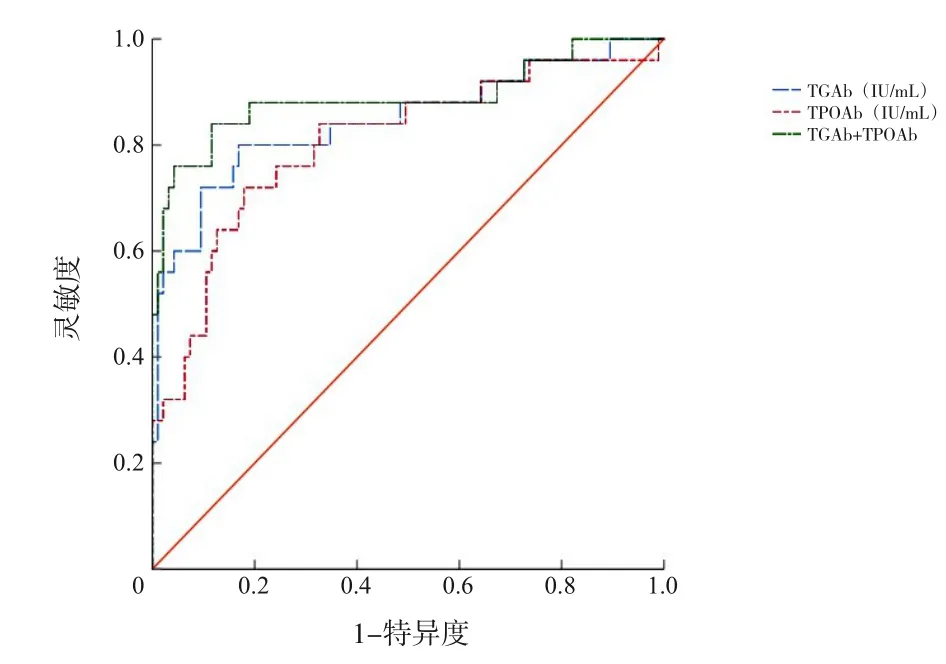
图1 TGAb、TPOAb评估儿童慢性ITP的ROC曲线
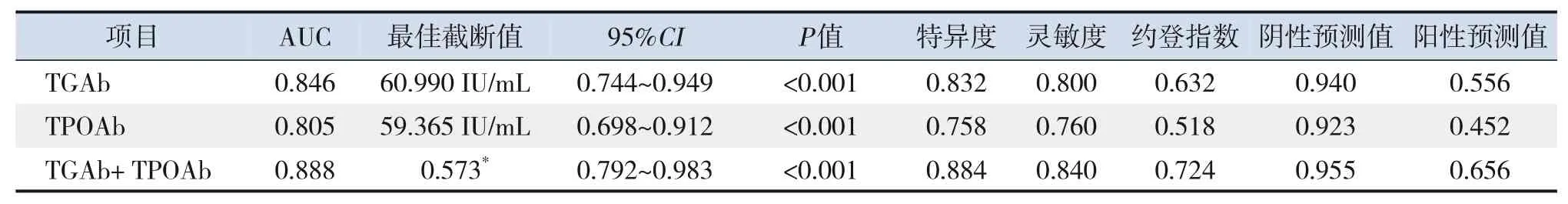
表5 TGAb、TPOAb对儿童慢性ITP的预测价值
2.6 TGAb、TPOAb评估儿童慢性ITP的决策曲线
以净收益率为纵坐标,高风险阈值为横坐标,绘制TGAb、TPOAb评估儿童慢性ITP的决策曲线(图2),结果显示,当高风险阈值分别为0.0~0.5、0.56~1.0时,血清TGAb+TPOAb表达评估儿童ITP临床分型的净收益率优于二者单独的净收益率,且在高风险阈值0.0~1.0范围内的净收益率始终>0,有临床意义,净收益率最大值为0.208。

图2 TGAb、TPOAb评估儿童慢性ITP的决策曲线
3 讨论
目前临床治疗儿童ITP需根据不同临床分型、出血分级制定针对性的治疗方案,如新诊断ITP、持续性ITP患儿出血情况较轻,仅需采用一线治疗,而严重出血的持续性ITP及慢性ITP则需在一线治疗基础上根据患儿具体情况制定治疗方案[7]。目前对ITP临床分型的评估主要根据患儿病程进行判定,但部分患儿起病隐匿,早期的症状缺乏典型性,详细病程并不明确,以致仅根据病程对患儿临床分型进行评估存在一定局限[8]。因此寻找客观指标结合ITP病程评估患儿的临床分型、制定合理的治疗方案尤为重要。
T淋巴细胞亚群可反映机体的细胞免疫,其中CD3+、CD4+、CD8+的动态平衡维持机体免疫功能的稳定,可通过释放多种细胞因子,并通过细胞与细胞的接触,抑制机体免疫系统对致病因素的免疫应答,维持机体的免疫平衡[9]。当CD3+、CD4+、CD8+异常表达后,可引起儿童免疫功能紊乱,进而间接引起ITP的发生[10]。因此T淋巴细胞亚群可作为评估ITP的重要指标。但T淋巴细胞亚群异常表达也可见于恶性肿瘤、艾滋病、自身免疫性疾病等多种与免疫功能相关的其他疾病中,在评估ITP的应用中受到一定限制。
TGAb为甲状腺滤泡柱状细胞内的糖蛋白,在正常情况下仅在甲状腺细胞内循环,当机体甲状腺损伤后,可释放至血液中,引起自身免疫性疾病的发生[11]。TPOAb是分布在甲状腺内质网和顶缘的膜结合糖蛋白分子,具有催化活性,是合成甲状腺激素的关键酶,可在T细胞介导的自身免疫性疾病中呈异常表达[12]。本研究中,ITP患儿与非ITP患儿TGAb、TPOAb表达水平存在显著差异。Wang等[13]通过对比活动期ITP患者与健康患者外周血、骨髓中T淋巴细胞亚群水平,发现ITP患者外周血与骨髓中CD4+T淋巴细胞亚群失衡,进一步提示免疫功能紊乱在ITP的病理生理过程中发挥重要作用。本研究结果与上述研究[13]结果一致。本研究发现,TGAb、TPOAb在儿童ITP中呈异常表达,且与ITP临床分型有关。分析原因在于,TGAb表达升高后,可结合甲状腺球蛋白,作用于免疫球蛋白Fc部分c末端受体,激活自然杀伤细胞,进而对靶细胞造成损伤,破坏甲状腺细胞[14]。甲状腺细胞损伤后,导致B淋巴细胞数量减少,影响白细胞介素-10、转化生长因子-β等多种细胞因子的分泌,进而影响机体的免疫功能,降低ITP患儿自然缓解率,促使疾病向慢性化发展,影响患儿预后[15]。此外,TGAb表达升高引起的B淋巴细胞减少,可直接影响其与效应性T细胞、辅助性T细胞、巨噬细胞等多种免疫细胞之间的相互作用,引起ITP患儿的免疫抑制,进而促进疾病进展、迁延,增加疾病慢性化风险[16]。Eick等[17]研究发现,TPOAb表达升高后为了结合甲状腺抗原,参与抗体依赖细胞介导的细胞毒性作用,进而引起T细胞介导的甲状腺细胞损伤,说明TPOAb异常表达可损伤甲状腺细胞功能,进而影响ITP患儿免疫反应,导致疾病向慢性化发展。同时TPOAb可与甲状腺内丰富的补体结合,激活膜攻击复合物,损伤甲状腺细胞,进而通过减少B淋巴细胞分泌,影响免疫功能,增加患儿ITP慢性化的风险,影响预后[18]。
ROC曲线结果显示,TGAb、TPOAb及TGAb+TPOAb评估儿童慢性ITP的AUC>0.80,具有一定预测价值。决策曲线结果显示,当高风险阈值分别为0.0~0.5、0.56~1.0时,血清TGAb+TPOAb表达评估儿童ITP临床分型的净收益率优于二者单独的净收益率,且在高风险阈值0.0~1.0内的净收益率始终>0,有临床意义。提示TGAb、TPOAb对儿童慢性ITP具有较高的预测价值。因此,临床可早期检测ITP患儿血清TGAb、TPOAb水平,并根据二者表达情况,结合患儿病程,评估患儿病情与临床分型,针对不同临床分型制定相应的治疗方案,进而提高临床治疗效果,降低患儿死亡风险。
综上所述,TGAb、TPOAb在ITP患儿中呈异常表达,且与ITP临床分型有关,可早期检测患儿TGAb、TPOAb表达,可为评估ITP及其临床分型提供客观依据。但本研究也存在局限性,如未纳入重型与难治性ITP患儿,分析上述分型ITP患儿基线资料与血清TGAb、TPOAb表达水平,研究结果可能存在偏倚,且未观察TGAb、TPOAb表达与ITP治疗效果、预后的关系,未来需要进一步扩大研究范围,延长观察时间,进行深入分析。
