产前应激致抑郁样子代大鼠海马磷酸化蛋白质和代谢产物变化的初步研究
2022-06-21孙宏利黄惠梅李清红
何 威,孙宏利,黄惠梅,李清红
(1.西安市儿童医院 陕西省儿科疾病研究所 陕西省儿童疾病精准医学重点实验室,陕西 西安 710003;2.西安市儿童医院肾脏内科,陕西 西安710003;3.西北妇女儿童医院新生儿科,陕西 西安 710061)
抑郁症是一种常见的慢性精神类疾病,影响思维、情绪和身体健康,主要表现为情绪低落、缺乏活力、悲伤、睡眠障碍及生活质量差[1]。迄今为止抑郁症缺乏满意的治疗方案。研究表明,胎儿对应激异常敏感,怀孕期间暴露于不良事件、自然灾害及母亲的抑郁症状会增加子代出现情绪、行为和/或认知问题的风险[2],这种影响可能延续至整个成年期[3]。目前关于产前应激(prenatal stress,PS)如何增加子代抑郁样行为易感性的机制研究较少。
海马是抑郁症患者大脑中备受关注的区域之一。海马通过抑制下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴活动,广泛地参与大脑认知和情感处理过程,从而在应激反应中发挥重要作用。Meta分析显示,成年抑郁症患者海马的体积减少约5%[4]。PS与子代海马的功能和微观结构改变有关,胎儿期的海马发育较易受到PS的影响[5]。海马的结构及分子改变可能在抑郁症的病理学机制中扮演重要的角色。本研究结合磷酸化蛋白质组学和代谢组学研究PS诱导抑郁样子代大鼠大脑海马的蛋白质磷酸化和代谢的改变及生物相关性,为精神系统疾病与环境因素、遗传因素之间建立了新的机制联系,为临床抑郁症的治疗或辅助治疗提供新的见解。
1 资料与方法
1.1 产前慢性束缚应激动物模型的建立及实验分组
本实验采用Sprague-Dawley大鼠,体重约为230~300g,置于22℃及12h的暗/光循环环境中,自由摄食饮水。所有实验均获得西安交通大学实验动物管理委员会批准。
将雌性和雄性大鼠于晚上20:00~22:00以3∶1比例交配。次日早晨7:00~8:00对雌性大鼠进行阴道涂片检查,若精子呈阳性被记为妊娠第0d并单笼饲养。怀孕母鼠被随机分为对照组(n=8)和PS组(n=8)。慢性束缚应激模型建立参考课题组已发表文献[6]。分娩后,从每窝随机选择1~2只雄性子鼠用于后续实验。
1.2 行为学实验
1.2.1糖水偏好实验(sucrose preference test,SPT)
随机选取45只1月龄雄性子鼠进行SPT,用于对子代大鼠PS易感性的评估。实验前,在大鼠笼中放置1%蔗糖水进行24h的适应性练习。禁水禁食24h后,于次日早晨8:00~9:00进行SPT。向大鼠随机提供1瓶饮用水和1瓶1%蔗糖水溶液(容量相当)。1h后,分别测量糖水和饮用水摄入量,计算公式为蔗糖偏好百分比=糖水消耗量/(糖水消耗量+饮用水消耗量)×100%。与对照组相比蔗糖偏好百分比下降30%以上的雄性大鼠判定为PS-S(PS-Susceptibility)子代大鼠。
1.2.2 其他行为学实验
SPT完成后,随机选取PS-S组和CON组(对照组)各8只进行旷场实验(open field test,OFT)、强迫游泳实验(forced swim test,FST)、悬尾实验(tail suspension test,TST)并记录实验结果。上述行为学实验完成后,将大鼠麻醉。冰上取出全脑,快速从大脑中分离出海马组织,-80℃备用。
1.3 蛋白质组质谱采集
使用组织裂解液提取海马组织总蛋白,二喹啉甲酸蛋白检测法测定蛋白质浓度。取适量蛋白质用胰蛋白酶消化后使用C18 Cartridge对酶解肽段进行脱盐、去除高尿素,真空离心干燥后在40μL溶解缓冲液中复溶。根据串联质谱标签(tandem mass tags,TMT)标记试剂盒说明,每个样品各取100μg肽段用于TMT标记。将标记后的混合肽段溶液真空冻干,然后用磷酸化肽段富集试剂盒富集,浓缩的磷酸肽溶液冻干并复溶在20μL 0.1%甲酸溶液中,用于液相串联质谱(liquid chromatography coupled to tandem mass spectrometry,LC-MS/MS)分析。
样品用液相系统进行鸟枪蛋白质组学分析。流动相A为0.1%甲酸水溶液,流动相B为84%乙腈-0.1%甲酸水溶液。色谱柱以95% A预平衡30min,将磷酸肽转移到nanoViper C18色谱柱上,流速为300nL/min。经过C18-A2分析柱分离后,用Q-Exactive型质谱仪对肽样进行检测。使用MaxQuant软件提取并分析原始数据。根据倍数变化大于1.2或小于0.83和P<0.05的筛选标准,确定差异表达磷酸化肽段。
1.4 非靶向代谢组质谱采集
每个样品取5mg海马匀浆悬浮在800μL预冷的甲醇:乙腈溶液(1∶1,v/v)中。涡旋后,超声30min,重复两次。-20℃ 放置60min,14 000r/min 4℃离心15min。
将上清液注入Agilent 1290 Infinity LC超高效液相色谱系统。流动相组成A:水+25mmol/L乙酸铵+25mmol/L氨水,B:乙腈。梯度洗脱程序:0~1min,95% B;1~14min,线性降至65% B;14~16min,线性降至40% B;16~18min,维持在40% B;18~18.1min,线性升至95% B;18.1~23min,维持在95% B。将分离的代谢产物使用AB Triple TOF 5600质谱仪进行质谱分析,分别以电喷雾离子源正离子和负离子模式检测。
使用ProteoWizardConver软件将原始数据转换为mzML格式,然后使用XCMS程序校准保留时间、提取峰面积、标准化数据。通过精确质量数(m/z tolerance±30ppm,RT tolerance±60s)、二级质谱数据与实验室自建数据库数据双重匹配的方式鉴定代谢产物种类。
1.5 统计学方法

2 结果
2.1 PS-S大鼠的行为学评估
采用SPT将PS易感性子代大鼠设定为PS-S组(38.78%)。与对照组相比,PS-S子代大鼠在OFT的穿越总格数、中心格数、直立次数和在中央格内的停留时间显著减少(t值分别为14.70、6.396、9.058、14.27,P<0.05),在FST和TST中的不动时间显著延长(t值分别为17.70、8.751,P<0.05)。这些结果证实了PS模型和SPT筛选条件的有效性。
2.2 PS对PS-S大鼠大脑海马磷酸化蛋白质组学和代谢组学的影响
研究使用TMT技术标记肽段、固相金属亲和色谱技术分离富集磷酸化多肽,随后采用高分辨液相色谱-串联质谱收集PS-S大鼠的磷酸化蛋白质组学数据,分别检测并量化了2 978个磷酸化蛋白质,6 790个磷酸化肽段,9 817个磷酸化位点。与对照组相比,筛选出197个(6%)差异表达的磷酸化肽段(其中140个丰度升高,57个丰度下降),见表1。同时研究采用超高效液相色谱系统分离代谢产物,并使用Triple-TOF质谱仪检测上述样本获得非靶向代谢组学数据,在ESI正离子和负离子模式下分别检测到8 622和11 119个离子峰。分析正负离子峰共有80个差异代谢产物出现相对丰度的显著变化(其中55个升高,25个下降),见表1。

表1 差异磷酸化肽段/代谢产物结果统计表Table 1 Statistics of deferential phosphor-peptides/metabolites
2.3 KEGG代谢通路注释比较及富集分析
本研究对差异表达磷酸化肽段与代谢产物所属的KEGG通路进行统计,发现差异分子共同参与44条代谢通路,以韦恩图形式展示,见图1A。将KEGG通路中同时被注释到差异分子数量最多的前10个KEGG通路界定为主要的共有通路,条目名称和被注释到的差异分子数量以柱状图形式展示,见图1B。结果显示两个组学的差异分子共同富集的KEGG通路主要包括胆碱能突触、长时程增强、昼夜夹带、甘油磷脂代谢、内源性大麻素信号、促性腺激素释放激素信号通路、催产素信号通路和醛固酮的合成及分泌信号通路,这些主要共有通路可能参与了PS导致子代抑郁样行为的生物学机制。
2.4 组学数据相关性分析
本研究构建了基于Pearson相关系数的矩阵热图,根据其表达特征可以将差异磷酸化肽段分成两组,组内彼此呈正相关关系,组间彼此呈负相关关系,见图2。
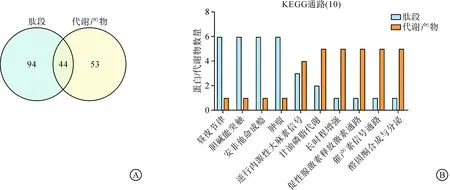
注:A差异磷酸化肽段(蓝色)和差异代谢产物(黄色)参与通路的韦恩图;B包含差异磷酸化肽段(蓝色)和代谢产物(橘色)数量最多的前10个KEGG通路柱状图。图1 多组学数据KEGG通路可视化分析图Fig.1 KEGG pathway visualization analysis of multi-omics data

注:横坐标和左侧纵坐标均代表显著差异修饰肽段及代谢产物。右侧纵坐标是Pearson相关系数r,r>0表示正相关(红色),r<0表示负相关(蓝色);颜色越深表示相关性越强。图2 显著差异磷酸化肽段与显著差异代谢产物的Pearson相关系数矩阵热图Fig.2 Heat map of pearson correlation matrix of all significantly differential phosphor-peptides and metabolites
随后本研究对满足相关系数值r≥0.50和P<0.05的差异磷酸化肽段和代谢产物,构建网络互作关系,用以筛选影响整体代谢或信号转导途径的、最关键的磷酸化蛋白质或代谢产物节点,分析发现胆碱、磷酸乙醇胺、磷酸二羟基丙酮、腺嘌呤、苹果酸、谷胱甘肽二硫化物等代谢产物与多个磷酸化肽段密切相关;CamkⅡa、Mbp、Ttll7、Arpp19、Gsto1、Dgkz、Adcy9等多个蛋白的磷酸化肽段与多个代谢产物密切相关(P<0.05)。
3 讨论
3.1 多组学研究及应用进展
组学作为现代常用的高通量检测手段具备强大的生物信息学解析能力,已成为揭示疾病严重程度、预后转归、筛查预测疾病生物标志物的有力工具,可为疾病病理机制和治疗方案提供新视角[7]。多组学分析在免疫炎症[8]、肿瘤[9]、中枢神经系统发育[10]等疾病研究中均有应用报道。
3.2 胆碱能突触信号通路失调
有研究表明抑郁症对大脑胆碱(choline,Cho)水平有显著影响[11],其差异程度与抑郁症的严重程度正相关[12],且子代表现较少的社会退缩行为与母亲产前Cho水平正相关[11]。Cho作为调节记忆储存的关键神经递质——乙酰胆碱(acetylcholine,Ach)的前体,通过反馈机制在Ach释放调节中起重要作用。胆碱诱导突触前α7-nAChR激活导致ACh释放下调。这一级联反应有赖于钙/钙调蛋白依赖性蛋白激酶II(Ca2+/calmodulin-dependent protein kinase II,CamkII)的活性[13]。
CamkⅡ,一种普遍存在的丝氨酸/苏氨酸蛋白激酶,是突触后致密物的主要组成部分。在突触可塑性、学习和记忆中起关键作用,通过调节树突棘上的离子型谷氨酸受体和突触后致密物影响突触功能[14]。CamkⅡ各亚型突变会导致小鼠严重的可塑性及学习障碍,各亚型具有独特的生理功能且高度同源[15-16]。CamkⅡ的三个亚型CamkⅡa、CamkⅡb、CamkⅡg在PS-S大鼠海马中均出现了显著的磷酸化水平改变。CamkⅡ与抑郁症的相关研究较少,推测CamkⅡ的磷酸化水平改变可能导致突触功能受损,从而在PS致子代抑郁样行为的过程中发挥重要作用,或可成为深入研究该诱导机制的新思路。
本研究发现CamkⅡ的三个亚型磷酸化水平改变的同时,共同参与胆碱能突触途径的代谢产物胆碱含量在PS-S大鼠海马中也发生了变化。上述4个分子是差异磷酸化肽段和代谢产物构建的网络互作关系中的关键节点,很可能作为海马区域影响整体代谢或信号转导途径的关键磷酸化蛋白质或代谢产物发挥作用。
3.3 长时程增强信号通路失调
N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)在中枢兴奋性突触的可塑性中起重要作用[17],目前认为编码NMDAR亚单位的Grin2a是癫痫的致病基因,该基因突变与神经发育障碍密切相关[18],且在女性抑郁症患者中水平较高[19],母婴分离应激会增加子代成年大鼠海马中Grin2a的转录水平[20]。本研究发现Grin2a磷酸化水平在PS-S大鼠大脑海马中显著增高,推测子代胚胎期发育过程受PS影响,调节Grin2a的内源性磷酸化水平升高,最终导致NMDAR的转运减少及突触可塑性受损,该蛋白的磷酸化水平改变可能在PS诱导中起关键作用。
整合富集分析显示差异磷酸化肽段和差异代谢产物显著富集在长时程增强(long-term potentiation,LTP)等谷氨酸代谢途径,包含4个磷酸化肽段Grin2a、Cacna1c、Adcy9、Shank3和1个代谢产物L-谷氨酸。本研究为长时程增强等谷氨酸系统失调参与抑郁症的发病机制提供佐证。
NMDAR活化及Ca2+内流可以触发谷氨酸能传递的LTP[21]。仅当谷氨酸从突触前末端释放时,才能活化NMDAR,使Ca2+通过NMDAR进入突触并触发后续多个级联效应。在LTP中,CamkⅡ被Ca2+激活并自身磷酸化[21],随后转移到突触与NMDAR结合,LTP过程需要CamkⅡ的激活,CamkⅡ作为NMDAR依赖性LTP的关键酶发挥核心作用[22]。有研究发现NMDAR抑制剂和CamkⅡ抑制剂均可以降低CamkⅡ磷酸化水平[23]。大量证据表明CamkⅡ与NMDAR的相互作用在维持突触强度方面起重要作用。
本研究中,突触相关蛋白Grin2a、CamkⅡa、CamkⅡb、CamkⅡg的磷酸化修饰水平异常及L-谷氨酸的代谢异常,提示胆碱能突触及相关的LTP信号通路,在PS诱导抑郁样子代大鼠海马的分子变化中发挥着主要作用,很可能是该区域差异分子产生的核心调控机制。
