circ-0008583结合EIF4A3蛋白促进肝癌细胞增殖并抑制其凋亡
2022-06-21吴田方戴东王常元
吴田方 戴东 王常元
1黔南州人民医院肝胆外科(贵州黔南 558000);2天津医科大学肿瘤医院分子影像及核医学诊疗科(天津 300000);3贵州省人民医院肝胆外科(贵阳 550000)
肝细胞癌(HCC)是一种严重威胁人类健康的恶性肿瘤,是全球肿瘤相关死亡第四大常见原因[1],是中国肿瘤相关死亡的第二大常见原因[2]。随着索拉非尼和免疫检查点抑制剂等新药的发展,HCC 患者生存期显著延长,但是HCC 患者的5年生存率依然很低[3-4]。因此,迫切需要探索HCC的分子机制,以确定新的诊断生物标志物和治疗靶点。
环状RNA(circRNA)在多种肿瘤的发生发展中发挥重要作用。如:circ-RPPH1 调节miR-146b-3p/E2F2 通路促进乳腺癌细胞的生长和转移[5];在非小细胞肺癌中circ-MYBL2 海绵吸附miR-28 进而抑制癌细胞增殖并促进细胞凋亡[6];在肝细胞癌中circRNA-5692 通过海绵吸附miR-328-5p 上调DAB2IP 表达抑制肝细胞癌的恶性进展[7];circ-FN1通过海绵吸附miR-1205 和调节E2F1 的表达介导肝癌细胞对索拉非尼的耐药[8]。这些研究表明circRNA 在肿瘤的发生发展及耐药中发挥重要作用。本研究发现circ-0008583 在肝细胞癌中高表达,通过干扰circ-0008583 表达,探索其对HCC 细胞增殖和凋亡的影响,为肝细胞癌的临床治疗提供新的思路和理论依据。
1 材料与方法
1.1 实验材料 人肝永生化细胞(THLE-2)购自上海弘顺生物科技有限公司;人高转移性肝癌细胞(MHCC97-H)购自通派(上海)生物科技有限公司;人肝癌转移细胞株(HCCLM3)购自南京赛泓瑞生物科技有限公司;人肝癌细胞株(Huh-7)购自中科院(上海)细胞库;HCC-2 购自舜冉(上海)生物科技有限公司;BEGM 培养基购自赛因百奥生物技术(北京)有限公司;RPMI-1640 培养基、DMEM培养基、胎牛血清(FBS)购自Thermo Fisher Scientific(中国);protein A/G 免疫沉淀磁珠购自bimake生物科技有限公司(美国);RNase R 购自广州吉赛生物科技股份有限公司;放线菌素D 购自南京罗迈美生物科技有限公司;EIF4A3 兔单克隆抗体、GAPDH 兔多克隆抗体、IgG 兔多克隆抗体、U2AF65兔多克隆抗体以及辣根过氧化物酶(HRP)标记的羊抗兔免疫球蛋白IgG 二抗均购自Abcam(美国)。人肝癌及癌旁组织由黔南州人民医院提供,本研究由黔南州人民医院伦理委员会批准,已告知患者知情并签署知情同意书。
1.2 方法
1.2.1 细胞培养 THLE-2 用含10%FBS 和1%青/链霉素的BEGM 培养基,MHCC97-H 用含10%FBS和1%青/链霉素的RPMI-1640 培养基,HCCLM3、Huh-7 以及HCC-2 用含10%FBS 和1%青/链霉素的DMEM 培养基进行培养。将细胞放在37 ℃、5%CO2的培养箱中培养,每2 ~3 天更换一次培养基,待细胞处于对数生长期时进行后续实验。
1.2.2 细胞转染 从将处于对数生长期的细胞接种在细胞培养板中,待细胞融合度达到80%的时候,按照脂质体LipofectamineTM2000 试剂盒说明书将circ-0008583 siRNA 及其阴性对照转染到对应细胞分组中,并通过qRT-PCR 检测转染效率。
1.2.3 实时荧光定量PCR(qRT-PCR) 按照Trizol(Invitrogen)试剂说明书的方法从各处理组的细胞中提取总RNA,Q3000 超微量核酸蛋白检测仪(Quawell Technology)检测RNA 的纯度和浓度。反转录系统试剂盒合成cDNA,并按照制造商说明书提供的方法使用SYBR Green 进行qRT-PCR 实验。circ-0008583 以18 s 为内参,EIF4A3、U2AF65、DLG1 以GAPDH 为内参进行归一化处理,并通过2-ΔΔCt值来计算各组细胞中目的基因的相对表达水平。实验所用引物见表1。
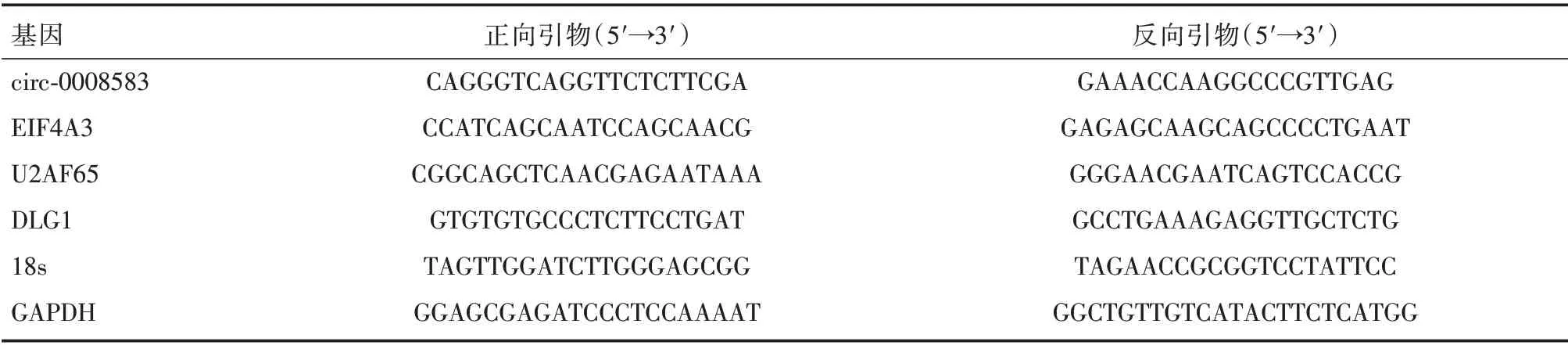
表1 实验室所用引物序列Tab.1 Sequence of primers used in the laboratory
1.2.4 环状RNA 稳定性检测 按照RNase R 试剂使用说明书,配置RNase R 反应液,37 ℃消化RNA 15 min,70 ℃处理10 min 使RNase R 灭活,qRT-PCR实验检测circ-0008583、DLG1的表达水平。用2 μg/mL 的放线菌素D 处理细胞6、12、18、24 h 后,按照1.2.3方法提取细胞总RNA,qRT-PCR实验检测circ-0008583、DLG1 的表达水平。
1.2.5 克隆形成实验 将转染24 h 后的各组细胞移植到6 孔板当中(每孔500 个细胞)。培养箱中37 ℃培养2 周后,甲醇固定15 min,然后用0.1%结晶紫染色,在显微镜下观察、拍照并计数。
1.2.6 TUNEL 染色 将处理后各组细胞用4%多聚甲醛固定30 min,PBS 洗涤1 次后,加入含0.1%Triton X-100 的PBS,冰浴孵育2 min。PBS 洗涤2 次后,加入TUNEL 检测液,37 ℃避光孵育60 min,PBS洗涤后,用抗荧光猝灭封片液封片后荧光显微镜下观察并拍照。
1.2.7 RNA 结合蛋白免疫沉淀(RIP)实验 收集各组细胞,加入等体积细胞裂解液冰浴裂解5 min后,收集裂解物。重悬protein A/G 免疫沉淀磁珠,NT-2 buffer 洗涤磁珠2 次 后,加 入EIF4A3 以 及U2AF65 抗体以及阴性对照IgG,室温混悬1 h,弃去上清,在NT-2 buffe 重悬的磁珠中加入细胞裂解液,使用垂直混合器在4 ℃条件下孵育过夜。加入NT-2 洗涤磁珠后,蛋白酶K 消化后提取RNA 进行后续分析。本实验所用溶液均不含RNA 酶。
1.2.8 蛋白质免疫印迹(Western blot) 收集各组细胞,用预冷的全蛋白裂解液冰浴10 min 裂解细胞,提取总蛋白。BCA 蛋白定量试剂盒进行定量分析,取50 μg 蛋白在100 V 条件下SDS-PAGE凝胶电泳1.5 h。在60 V 条件下转膜2 h,将分离的蛋白转到PVDF 膜上。5%脱脂奶粉封闭2 h 后,加入一抗4 ℃孵育过夜,TBST 洗涤2 ~3 次后,加入HRP 标记的二抗室温孵育2 h,加入ECL 反应液进行发光反应,化学发光仪下观察并拍照。
1.2.9 统计学方法 所有实验均进行3次平行实验,并用GraphPad Prism8.0 进行统计学分析,两组间比较采用独立t检验,P<0.05为差异有统计学意义。
2 结果
2.1 circ-0008583 在肝癌组织及细胞中高表达 在GSE94508 芯片数据中,和正常组织相比,circ-0008583 在肝癌组织中高表达;在我院收集的30 例癌及癌旁组织中发现,和癌旁组织相比,circ-0008583在肝癌组织中高表达(t=56.74,P<0.001);在肝癌细胞系中,和人肝永生化细胞THLE-2相比,circ-0008583 在肝癌细胞(MHCC97-H、HCCLM3、Huh-7、HCC-2)中高表达(MHCC97-H:t= 22.92,HCCLM3:t=9.40,Huh-7:t=25.46,HCC-2:t=5.06,P<0.01)。由于circ-0008583 在MHCC97-H、Huh-7细胞中表达最高,故而选择这两种细胞进行下一步研究。
2.2 circ-0008583 的circRNA 特 性验证 RNase R能够降解线性RNA,故而多用RNase R 处理验证circRNA的环状特性。在MHCC97-H、Huh-7细胞中,用RNase R 处理显著降低DLG1 mRNA 的表达水平(MHCC97-H:t= 9.16,Huh-7:t=9.79,P<0.001),而对circ-0008583 的表达水平无影响(P>0.05)。circRNA 的环状结构使其稳定性大大增加。在MHCC97-H、Huh-7细胞中,与circ-0008583 相比,放线菌素D 处理加速DLG1 mRNA 降解(MHCC97-H:t= 11.30,Huh-7:t=21.10,P<0.001)。
2.3 干扰circ-0008583 抑制肝癌细胞增殖、促进凋亡 circ抑制组显著降低MHCC97-H、Huh-7细胞中circ-0008583的表达水平(circ抑制组1:t=12.77,circ 抑制组2:t= 21.40,circ 抑制组3:t= 17.25,P<0.001),其中circ 抑制组2 抑制效果最为显著(图1A-B),故而选择其进行下一步实验。见图1C-D,和阴性对照组相比,circ 抑制组2 的细胞克隆数降低(MHCC97-H:t=8.49,Huh-7:t=6.19,P<0.01)。见图1E-F,和阴性对照组相比,circ 抑制组2 细胞凋亡水平升高(MHCC97-H:t= 14.18,Huh-7:t=19.38,P<0.001)。
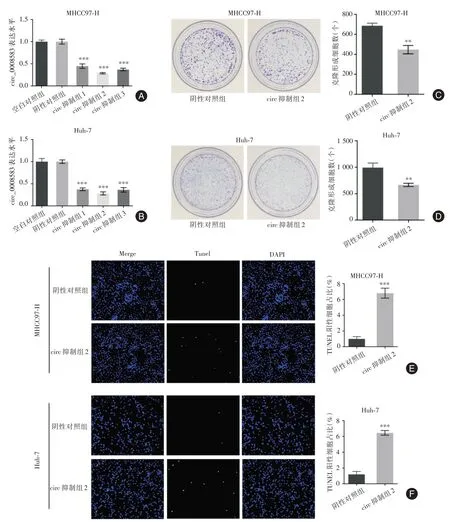
图1 干扰circ-0008583 抑制肝癌细胞增殖、促进凋亡Fig.1 Interference with CIRC-0008583 can inhibit the proliferation and promote apoptosis of HCC cells
2.4 circ-0008583 与EIF4A3 互相结合 通过检索Circular RNA Interactome 数据库(https://circinteractome.irp.nia.nih.gov/)发现circ-0008583能够与EIF4A3和U2AF65 结合。RIP 实验证实,在MHCC97-H、Huh-7 细胞中circ-0008583 均与EIF4A3 和U2AF65结合(图2)。

图2 circ-0008583 与EIF4A3 互相结合Fig.2 circ-0008583 is combined with EIF4A3
2.5 EIF4A3在肝癌组织和细胞中高表达 在我院收集的30 例肝癌及癌旁组织中,与癌旁组织相比,EIF4A3 在癌组织中高表达(t= 43.15,P<0.001)。qRT-PCR 实验和western blot 实验发现,与THLE-2细胞相比,EIF4A3 在肝癌细胞系(MHCC97-H、HCCLM3、Huh-7、HCC-2)中高表达(EIF4A3 mRNA:MHCC97-H:t= 22.19,HCCLM3:t= 14.24,Huh-7:t=14.81,HCC-2:t=5.00,均P<0.001)。
2.6 过表达EIF4A3 逆转干扰circ-0008583 对肝癌细胞增殖、凋亡的影响 见图3A,在MHCC97-H 细胞中,circ抑制组2降低EIF4A3的蛋白表达水平;同时过表达EIF4A3 则在一定程度上提高EIF4A3 蛋白表达(t= 5.80,P<0.001)。见图3B,circ抑制组2降低MHCC97-H 细胞的克隆形成能力(t= 10.59,P<0.001),而过表达EIF4A3 使细胞克隆形成能力得到一定程度的回复(t=5.48,P<0.001)。见图3C,circ抑制组2促进MHCC97-H细胞的凋亡(t=24.08,P<0.001),而过表达EIF4A3 使细胞凋亡得到一定程度的抑制(t=7.33,P<0.001)。

图3 过表达EIF4A3 逆转干扰circ-0008583 对肝癌细胞增殖、凋亡的影响Fig.3 Overexpression of EIF4A3 reverses the effect of circ-0008583 on proliferation and apoptosis of HCC cells
3 讨论
circRNA 是一类生物体内广泛存在、稳定且保守的非编码RNA,通过其3′和5′末端的反向剪接形成共价环状闭合结构[9]。由外显子、内含子、外显子-内含子等多种方式环化形成,通过调节可变剪接、RNA-蛋白质相互作用、海绵吸附miRNA 等多种方式进一步发挥其分子作用[10-12]。circRNA 广泛参与肿瘤的发生发展,是肿瘤潜在的生物标志物和治疗靶点[13-14]。关于circ-0008583 在肝癌中的作用机制仍需要研究。本研究发现,circ-0008583在肝癌组织和细胞中高表达。由于circRNA 特殊的环状结构,使具有更强的稳定性。用RNase R处理RNA,发现circ-0008583 不被降解,证实circ-0008583 具有环状结构。进一步通过放线菌素D处理RNA,发现circ-0008583 的稳定性远远高于DLG1 mRNA。为了明确circ-0008583在肝癌细胞中的分子功能,进一步实验证实干扰circ-0008583 表达抑制肝癌细胞增殖,促进细胞凋亡。最近也有报道称Has_circ_0008583 影响肝癌恶性进展,其机制可能与miR-1301-3p/METTL3通路有关[15]。circRNA能够通过与RNA结合蛋白结合,进而调控肿瘤细胞凋亡和周期组织[16-17]。因此推测circ-0008583 可能有类似的调控作用。通过生物信息学数据挖掘发现circ-0008583 能够和EIF4A3 和U2AF65 结合,并通过RIP 实验证实circ-0008583 与两个蛋白都能够结合。由于EIF4A3 中circ-0008583 的富集程度最高,故而选择其进一步探索。EIF4A3 是EIF4A 真核翻译起始因子家族成员之一,转录后修饰蛋白的表达[18]。本研究发现EIF4A3 在肝癌组织及细胞系中高表达,和其他研究保持一致。而在干扰circ-0008583 表达的同时过表达EIF4A3,发现其能逆转干扰circ-0008583 表达对肝癌细胞系增殖抑制作用和凋亡的促进作用。EIF4A3 在肿瘤的恶性进展中发挥重要作用,如在结直肠癌中,circCSE1L 与EIF4A3 结合下调PCNA 表达,抑制了结直肠癌细胞的增殖[19];此外,在肝癌中,EIF4A3高表达和肝癌患者预后不良相关;长链非编码RNA CASC11 通过EIF4A3介导E2F1激活促进肝癌发生和HCC恶性进展[20];circ_0072995通过调节miR-1253/EIF4A3 信号促进肝癌细胞的增殖和侵袭[21]。
本研究通过生物信息学分析、临床组织及细胞系验证,发现circ-0008583 在肝癌组织及细胞系中高表达。体外功能实验发现干扰circ-0008583表达抑制肝癌细胞增殖、促进细胞凋亡。分子机制研究表明circ-0008583 与EIF4A3 结合,进而促进肝癌细胞增殖、抑制细胞凋亡。然而circ-0008583 和EIF4A3 在肝癌细胞中的作用机制仍然需要在体内实验中进一步的验证,该研究为肝癌的治疗提供新的治疗思路和理论依据。
