苍术酮对肝癌荷瘤小鼠肿瘤生长、上皮-间充质转化和凋亡标志物表达的影响
2022-06-21麦静愔陈澍柯碧莲何青青王浩艺平键陈建杰成扬
麦静愔,陈澍,柯碧莲,何青青,王浩艺,平键,陈建杰,成扬
(1.上海市光华中西医结合医院,上海 200052;2.复旦大学附属华山医院,上海 200040;3.上海市第一人民医院,上海 200080;4.上海中医药大学附属曙光医院,上海 201203)
原发性肝癌是高病死率的恶性肿瘤之一,给世界各国人民的健康带来极大危害。我国是原发性肝癌的重灾区,患者数量和病死率均占世界前列。目前肝癌治疗尚无特效药,基本采用综合治疗方案,早期以手术治疗为主,对无法手术或者不能耐受手术的,采用TACE、姑息治疗和综合对症处理,以此控制肿瘤生长和转移,延长患者生存期[1-2]。肝癌是一种具有高转移潜能的恶性肿瘤,其复发和转移是大多数肝癌患者治疗失败和死亡的主要原因。上皮-间充质转化(epithelial-mesenchymal transition,EMT)被认为是肿瘤细胞扩散的初始步骤,可导致恶性肿瘤的侵袭和转移,因此抑制肿瘤细胞EMT 的发生对肿瘤的治疗具有积极意义[3-4]。
在肝癌的预防治疗中,从中医药宝库中发掘有效的辅助治疗方法,无疑是其发展方向之一[1]。苍术为菊科草本植物茅苍术[Atractylodes lancea(Thunb.)DC.]或北苍术[Atractylodes chinensis(DC.)Koidz.]的干燥块茎,味辛、苦,性温,具有燥湿健脾、祛风散寒的功效,是临床许多中药方剂的重要组成部分。苍术酮是从苍术中分离得到的倍半萜类有效成分,现代药理研究表明,苍术酮具有保肝、抗病毒和抗肿瘤等多种药理活性[5-6]。本课题组前期研究发现苍术酮可抑制肝癌HepG2细胞的增殖和迁移,诱导肿瘤细胞的凋亡[7]。本研究拟在既往研究基础上,通过在非肥胖糖尿病/重症联合免疫缺陷小鼠(non-obese diabetes/server combined immune deficiency,NOD/SCID)小鼠左侧背部皮下种植HepG2 细胞悬液的方法制备肝癌荷瘤小鼠模型,以进一步研究苍术酮对肿瘤生长、EMT 和凋亡的影响。
1 材料与方法
1.1 肝癌细胞株培养
肝癌细胞株HepG2(美国ATCC,MD,USA)采用常规传代保种。细胞使用DMEM 培养基(美国Hyclone公司)培养,添加10%胎牛血清(美国Gibco 公司)和1%的青霉素和链霉素(美国Hyclone 公司),于5%CO2,37°C培养箱中培养。
1.2 模型制备、分组和给药
NOD/SCID 小鼠,体质量18~22 g,6~8周龄,购自北京华阜康公司。动物饲养温度(22 ± 2)°C,湿度50%~60%。所有动物自由进食饮水。适应环境1 周后开始实验。在NOD/SCID 小鼠左侧背部,皮下种植100 μL的HepG2细胞悬液,剂量为1×107/只。当注射位置肿瘤生长到50~100 mm3之后,将小鼠随机分为对照组、苍术酮低剂量组(低剂量组)和苍术酮高剂量组(高剂量组),每组6只。根据课题组前期预实验,将苍术酮溶于玉米油中,低、高剂量组分别按照5、10 mg/kg剂量灌胃给药;对照组给予玉米油灌胃。每日1 次,共15 d。
1.3 观测指标
1.3.1 肿瘤组织体积与质量
实验结束后处死小鼠,采集血液和相应组织标本,肿瘤瘤体立刻拍照并称重,取部分肿瘤组织固定于福尔马林溶液中,待进一步检测。皮下肿瘤体积测量公式如下:
肿瘤体积(mm3)=0.5×L×W2
其中,L是肿瘤长度,W是宽度。
1.3.2 免疫组化染色法观察肿瘤组织细胞增殖情况
将固定好的肿瘤组织采用石蜡进行包埋,切成5 μm 组织切片,贴附在载玻片上。使用二甲苯和梯度分级乙醇对切片进行脱蜡和再水化,再将切片浸入目标回收溶液中水浴30 min。用3% H2O2阻断内源性过氧化物酶15 min,用山羊血清阻断非特异性结合50 min。切片依次用Ki-67 Ⅰ抗和HRP 标记的Ⅱ抗聚合物共孵育反应,最后用DAB 染色和甲基绿复染,在显微镜下观察拍摄。
1.3.3 Western blot 法检测肿瘤组织EMT 标志物、凋亡相关因子蛋白表达水平
用含有1 mmol/L PMSF的RIPA裂解缓冲液(上海碧云天生物技术有限公司)裂解组织样品,使用BCA法测定蛋白质浓度。用5%脱脂牛奶阻断非特异性结合1.5 h,Ⅰ抗(Bcl-2、Bax、裂解Caspase-3、α-SMA、波形蛋白、N-钙黏蛋白、E-钙黏蛋白、MMP-2、MMP-9、TIMP-2和GAPDH)在膜上孵育4°C 过夜。Ⅱ抗在室温下孵育1 h。通过化学发光试剂显示蛋白质条带,采用Amersham prime ECL Plus detection system(Pittsburgh,PA)进行定量检测分析。
1.4 统计学分析
统计分析采用SPSS 13.0 软件,所有数据均以均数±标准差(±s)表示,多样本间的比较采用单因素方差分析,以P<0.05代表差异具有统计学意义。
2 结果
2.1 苍术酮对肝癌荷瘤小鼠肿瘤体积和质量的影响
实验结果显示,对照组肝癌荷瘤小鼠的肿瘤体积和质量都比较大。经治疗后,低、高剂量组的肿瘤组织体积和质量均明显下降(P<0.01),并呈现剂量依赖性,且高剂量组明显低于低剂量组(P<0.05)。见图1、表1。
表1 各组荷瘤小鼠肿瘤体积和质量比较(±s)

表1 各组荷瘤小鼠肿瘤体积和质量比较(±s)
注:与对照组比较,1)P <0.01;与低剂量组比较,2)P <0.05。
组别对照组低剂量组高剂量组n6 6 6肿瘤体积(mm3)810.90±111.54 392.85±69.131)329.82±58.231)2)肿瘤质量(mg)730.81±53.70 238.96±40.571)190.41±41.281)2)

图1 肝癌荷瘤小鼠肿瘤组织
2.2 苍术酮对肝癌荷瘤小鼠肿瘤细胞增殖的影响
Ki-67 免疫组化染色显示,对照组Ki-67 阳性染色面积十分明显,显示皮下注射的HepG2 细胞增殖活跃;苍术酮组Ki-67 阳性染色面积均显著缩小,尤其以高剂量组最为明显。可见,苍术酮治疗抑制了肿瘤细胞的增殖。见图2。

图2 肝癌荷瘤小鼠肿瘤组织Ki-67免疫组织化学染色图(×100)
2.3 苍术酮对肝癌荷瘤小鼠肿瘤组织EMT 标志物的影响
Western blot检测结果显示,低、高剂量苍术酮的干预均对EMT(E-钙黏蛋白、N-钙黏蛋白、波形蛋白和α-SMA)和EMT促进因子(MMP-2、MMP-9和TIMP-2)的表达产生了作用。与对照组相比较,低、高剂量组均显著上调了上皮标记物(E-钙黏蛋白)的表达,下调了间充质标记物(N-钙黏蛋白、波形蛋白和α-SMA)的表达,显著增加了TIMP-2的表达,降低了MMP-2和MMP-9的表达,差异均具有统计学意义。见图3、表2。
表2 各组荷瘤小鼠肿瘤组织EMT标记物的蛋白表达量比较(±s)
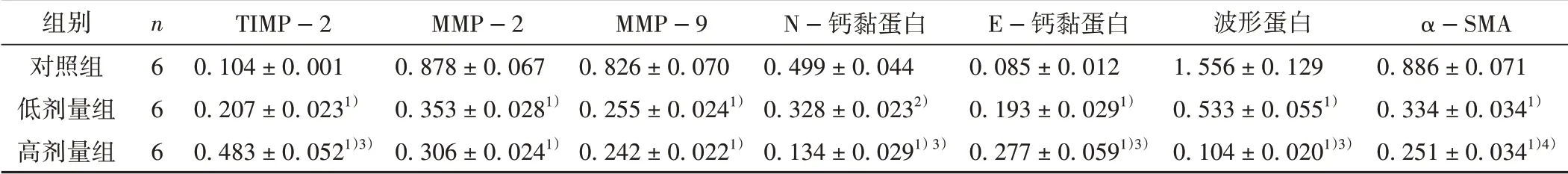
表2 各组荷瘤小鼠肿瘤组织EMT标记物的蛋白表达量比较(±s)
注:与对照组比较,1)P <0.01,2)P <0.05;与低剂量组比较,3)P <0.01,4)P <0.05。
组别对照组低剂量组高剂量组n6 6 6 TIMP-2 0.104±0.001 0.207±0.0231)0.483±0.0521)3)MMP-2 0.878±0.067 0.353±0.0281)0.306±0.0241)MMP-9 0.826±0.070 0.255±0.0241)0.242±0.0221)N-钙黏蛋白0.499±0.044 0.328±0.0232)0.134±0.0291)3)E-钙黏蛋白0.085±0.012 0.193±0.0291)0.277±0.0591)3)波形蛋白1.556±0.129 0.533±0.0551)0.104±0.0201)3)α-SMA 0.886±0.071 0.334±0.0341)0.251±0.0341)4)
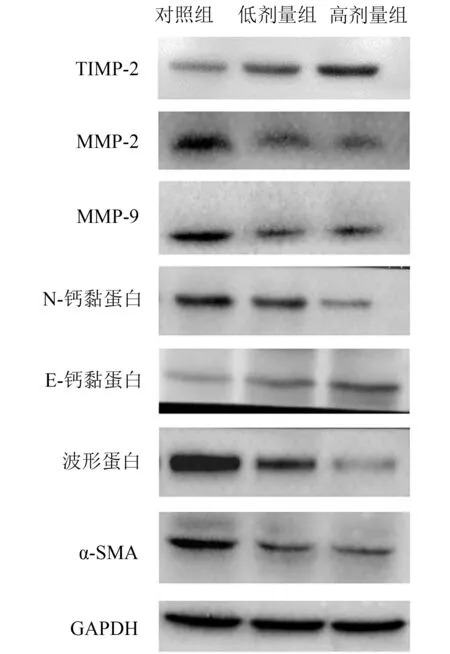
图3 各组肝癌荷瘤小鼠肿瘤组织EMT标记物检测结果
2.4 苍术酮对肝癌荷瘤小鼠肿瘤细胞凋亡标志物的影响
Western blot 检测结果显示,与对照组比较,低、高剂量苍术酮的干预均显著降低了Bcl-2 的表达水平,显著增加了Bax 和裂解Capase-3 的表达水平,差异均有统计学意义。与低剂量组比较,高剂量组影响更显著。见图4、表3。
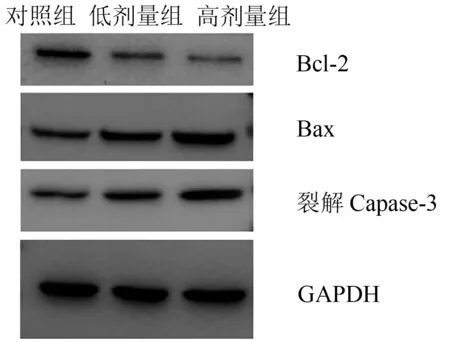
图4 肝癌荷瘤小鼠肿瘤组织Bcl-2、Bax和裂解Caspase-3检测结果
表3 各组荷瘤小鼠肿瘤组织Bcl-2、Bax和裂解Caspase-3的蛋白表达量比较(±s)

表3 各组荷瘤小鼠肿瘤组织Bcl-2、Bax和裂解Caspase-3的蛋白表达量比较(±s)
注:与对照组比较,1)P <0.01,2)P <0.05;与低剂量组比较,3)P <0.05,4)P <0.01。
组别对照组低剂量组高剂量组n6 6 6 Bcl-2 0.663±0.058 0.203±0.0251)0.123±0.0201)3)Bax 0.561±0.037 0.731±0.0772)1.094±0.0431)4)裂解Capase-3 0.265±0.033 0.398±0.0372)0.882±0.0761)4)
3 讨论
由于肝癌早期临床症状常不明显,大多数患者在确诊时已发展到晚期,导致治疗十分困难,预后较差。肿瘤细胞的侵袭和迁移能够促进远处转移,这是肝癌患者高复发率和高病死率的主要原因之一。由于肝癌发病的分子机制十分复杂,目前临床药物的疗效有限,效果不甚理想[8]。近年来中医药在对肝癌的治疗中不断取得进展,可从整体上系统地调控机体抑制肿瘤,在临床上已经渐渐显露出独特优势[1-2]。中草药提取物或其衍生物已成为发现和开发新型抗癌药物的重要来源[5-6]。作为从苍术中分离得到的活性成分,既往研究发现苍术酮能够降低肝癌HepG2 细胞线粒体膜电位,增加细胞内ROS 水平,诱导其早期凋亡,并可呈剂量依赖性地抑制肝癌HepG2 细胞的增殖和迁移[7]。本次研究发现,苍术酮在整体动物模型上能够抑制NOD/SCID 小鼠皮下荷瘤的生长,减少了肿瘤体积和质量;Ki-67 免疫组化染色显示其抑制了肿瘤细胞的生长活性,表明其具有一定的体内抗肿瘤效应。
大量证据表明,上皮细胞恶性肿瘤可以通过EMT获得迁移和侵袭能力,从而促进肿瘤的扩散和转移[9]。EMT 的主要特征是上皮标记物,如E-钙黏蛋白和ZO-1 的丢失,并伴随间充质标记物,如波形蛋白、α-SMA 和N-钙黏蛋白的增加[10]。本次研究结果显示,苍术酮干预上调了上皮标志物E-钙黏蛋白水平,降低了间充质标志物α-SMA、N-钙黏蛋白和波形蛋白水平。结果提示表面苍术酮能够抑制肝癌皮下荷瘤的EMT 过程。
由于肿瘤转移是涉及一系列复杂相互作用的多步骤过程,细胞外基质和基底膜的降解是促进肿瘤细胞迁移和侵袭的关键步骤。基质金属蛋白酶(matrix metalloproteinase,MMP)家族是一类重要的降解细胞外基质的蛋白水解酶,在细胞外基质的降解中起重要作用,MMP 的高表达可促进肿瘤细胞的侵袭和迁移。MMP-2 和MMP-9 是两种重要的MMP,在多种肿瘤中高表达,在降解细胞外基质基本骨架Ⅳ胶原中发挥重要作用[11-12]。本研究发现,苍术酮能有效抑制MMP-2 和MMP-9 的表达,并增加MMP 抑制剂TIMP-2 的表达。综合这些结果表明,苍术酮可通过抑制EMT和下调MMP-2和MMP-9的表达来抑制肝癌细胞的迁移和侵袭。
Bcl-2家族蛋白在线粒体依赖性凋亡中起主要调节作用,在正常情况下,Bax 定位于细胞质并与Bcl-2结合形成异二聚体,稳定促凋亡蛋白的胞质定位,抑制细胞凋亡。如果Bcl-2/Bax 平衡被凋亡诱导信号破坏,导致Bax 与Bcl-2/Bax 异二聚体分离并转移到线粒体膜上,即可启动凋亡途径[13-15]。本次研究结果显示,苍术酮显著降低了Bcl-2 的表达水平,增加了Bax和裂解Caspase-3的表达水平,结合既往研究,显示其可能通过凋亡途径发挥对肝癌细胞的抑制作用[7]。
综合研究结果显示,苍术酮具有一定的体内抗肿瘤效应,可通过抑制EMT 和下调MMP-2 和MMP-9的表达来抑制肝癌细胞的迁移和侵袭,通过凋亡抑制肝癌细胞的生长。综合国内外研究显示,苍术酮具有抗肿瘤、降血压、保护呼吸系统、抗炎、镇痛、抗氧化、保肝、抗流感病毒和除螨等广泛良好的药理活性[5,16-17]。深入开展对苍术酮治疗肝癌的研究,可扩展对该成分在现代药理学方面的新认识,也对合理开发中药新药具有重要意义。
