西洋参总皂苷通过调控TGF-β1/CTGF通路对压力性尿失禁大鼠尿道损伤及排尿功能的改善作用研究
2022-06-21张凯敏李留霞袁新枝张红彬
张凯敏,李留霞,袁新枝,张红彬
(1.漯河市妇幼保健院,河南 漯河 462300;2.郑州大学第一附属医院,河南 郑州 450000;3.郑州大学第三附属医院,河南 郑州 450014)
压力性尿失禁(stress urinary incontinence,SUI)即腹压突然增加(如咳嗽或打喷嚏),尿液在膀胱内压驱使下从尿道流出,其特点为正常情况下膀胱无遗尿,腹压突增时尿液自动溢出,又被称为真性压力性尿失禁或应力性尿失禁[1]。流行病学调查表明,SUI发病率逐年升高,成年女性发病率约为20%,其中年龄≥40岁女性居多,SUI 不仅严重影响女性生活质量,同时也导致其心理和生理负担加重,目前,SUI 已上升为社会和公共卫生问题[2]。SUI 的非手术疗法(如盆底肌肉训练、药物治疗、生物反馈治疗、子宫托以及针灸疗法等)已取得一定进展,但因其易复发、副作用大等特点造成临床推广困难,因此,仍需要更具前景的药物进行治疗。西洋参也称西洋人参或花旗参,属五加科植物,具有广泛生物活性与药理作用,其药用部分主要为根和茎叶[3]。西洋参总皂苷是从西洋参茎叶中提取的一种有效活性成分,具有降血糖、抑制脑组织细胞凋亡等药理作用。虽有研究发现人参皂苷Rb1 可修复产后尿道组织损伤[4],但目前关于西洋参总皂苷对SUI 大鼠尿道损伤修复作用研究尚未见文献报道。因此,本研究通过建立大鼠SUI 模型,初步探讨西洋参总皂苷对SUI 大鼠尿道损伤与排尿功能影响及作用机制,为临床应用研究提供佐证材料。
1 材料与方法
1.1 材料
1.1.1 实验动物
70 只SPF 级雌性未育SD 健康大鼠,体质量180~220 g,8周龄,购自上海市计划生育科学研究所实验动物经营部,许可证号:SCXK(沪)2018-0006,适应性饲养1 周,饲养环境室温(24±1)℃,空气相对湿度(55±5)%,光照昼夜交替循环12 h。
1.1.2 药物、主要试剂和仪器
纯度98%的西洋参总皂苷(陕西昂煦生物科技有限公司);盐酸米多君(国药集团川抗制药有限公司,国药准字H20060551);兔抗鼠转化生长因子-β1(transforming growth factor-beta1,TGF-β1)多抗、结缔组织生长因子(connective tissue growth factor,CTGF)多抗、胶原蛋白Ⅰ(Collagen Ⅰ)多抗、胶原蛋白Ⅲ(Collagen Ⅲ)多抗、羊抗兔二抗-HRP(英国Abcam 公司);电泳仪、垂直电泳槽(美国Satan Cruz公司)。
1.2 方法
1.2.1 建模和分组
随机选取60 只大鼠戊巴比妥钠麻醉,仰卧固定,依据模拟产伤并联合双侧卵巢切除法建立SUI 模型,经导管排空膀胱,于腹部正中切口(1.0~1.5 cm),剥离双侧卵巢,缝合切口,取8 Fr弗莱氏导尿管置于阴道处,经气囊注射无菌生理盐水(3.0 mL),致使其阴道充分扩张,4 h 后撤掉导尿管,阴道气囊扩张2 周后,麻醉大鼠,剥离组织,将大鼠两侧卵巢无菌摘除后缝合,结束后开展喷嚏实验,排空大鼠膀胱,并注射美兰液,刺激其鼻孔出现喷嚏反射,当大鼠尿道口出现蓝色液体,即造模成功[5-6]。将建模成功的56 只大鼠,随机分为模型组、西洋参总皂苷低剂量组、西洋参总皂苷高剂量组和阳性药物组,每组各14 只,余下10 只未经任何处理,设为对照组。
1.2.2 干预方法
建模成功24 h 后,参照文献[3]用量,西洋参总皂苷低、高剂量组大鼠分别按照50、100 mg/kg 剂量灌胃西洋参总皂苷,阳性药物组大鼠灌胃20 mg/kg 剂量盐酸米多君,对照组与模型组大鼠给予等量生理盐水,每日灌胃1次,共计6周。
1.3 观测指标
1.3.1 尿动力学指标检测
末次给药干预后,排空大鼠膀胱,通过导尿管向大鼠膀胱内注射无菌生理盐水(100 μL/min),当大鼠尿道口第一滴尿液出现时的膀胱容积即为膀胱最大容积(maximum bladder capacity,MBC),并记录此刻大鼠膀胱压力即漏尿点压力(leak point pressure,LPP),结束后排空膀胱,以相同流速继续注射生理盐水(注射量为LPP 测定时MBC 的50%),在大鼠腹部用手指缓慢施压,致使腹压逐步升高直至尿道口观察到有液体溢出,记录此时膀胱压即为腹压漏尿点压(abdominal leakage pressure point,ALPP),重复多次,取均值。
1.3.2 膀胱内压测定
尿动力学指标检测结束后,将一根三通管导管通过大鼠左侧颈静脉置于膀胱内(作为给药途径),缝合并固定,一导管口连接压力检测器监测膀胱压力,另一导管口持续注射无菌生理盐水(灌注速度依据MBC 确定),诱导膀胱收缩排尿,收集尿液,观察大鼠排尿量、残余尿量以及排尿效率,反复多次,取均值。
1.3.3 尿道组织形态学观察
膀胱内压测定结束后,处死大鼠,无菌摘取尿道组织,4%多聚甲醛固定,石蜡包埋,切片(4 μm),脱蜡(20 min),苏木精染色(3~5 min),1%(V/V)H2O2浸泡(10~30 s),伊红染色(20 min),二甲苯透化(10 min),中性树脂封固,光学显微镜观察。
1.3.4 尿道组织TGF- β1、CTGF、Collagen Ⅰ、Collagen ⅢmRNA水平检测
取尿道组织,匀浆,Trizol法提取总RNA,测定纯度、浓度,逆转录得cDNA,实时荧光定量PCR反应。反应体系:1.2 μL Taq 聚合酶、0.8 μL 上下游引物、4 μL 模板cDNA、14 μL ddH2O。扩增条件:预变性(94 ℃,30 s)、变性(94 ℃,5 s)、退火(59 ℃,30 s),共40个循环,加熔解曲线,降温(50 ℃,30 s)。其中GAPDH为内参对照,数据分析采用2-△△Ct法,重复多次,取Ct均值。引物序列见表1。

表1 引物序列
1.3.5 尿道组织TGF- β1、CTGF、Collagen Ⅰ、Collagen Ⅲ蛋白水平检测
取尿道组织,加RIPA 裂解缓冲液,离心取上清(5 000 r/min,15 min,离心半径20 cm),采用蛋白BCA 试剂盒测定总蛋白浓度,将待测样品通过电泳分离(100 V,80 min),转至PVDF膜,5%脱脂牛奶的磷酸盐缓冲液封闭2 h,样品和TGF-β1(1:500)、CTGF(1∶500)、Collagen Ⅰ(1∶1 000)、Collagen Ⅲ(1∶1 000)一抗共同过夜孵育(4 ℃),TBST缓冲液洗膜,添加二抗HRP标记IgG(1∶2 000)孵育(室温,2 h),洗膜,曝光,显影。Image J软件检测样品与GAPDH条带灰度值。目标蛋白相对表达水平计算,即目标条带与GAPDH条带灰度间比值。
1.4 统计学分析
采用SPSS 27.0 统计学软件进行数据分析,计量资料采用均数±标准差(±s)表示,多样本计量资料比较采用单因素方差分析,组间比较进行LSD-t检验,以P<0.05代表差异具有统计学意义。
2 结果
2.1 尿动力学指标水平比较
尿动力学指标MBC、LPP、ALPP水平经组间比较,差异有统计学意义(P<0.001)。与对照组比较,模型组MBC、LPP、ALPP 均水平降低(P<0.05);与模型组比较,西洋参总皂苷低、高剂量组与阳性药物组MBC、LPP、ALPP水平均升高(P<0.05);与西洋参总皂苷低剂量组比较,西洋参总皂苷高剂量组与阳性药物组MBC、LPP、ALPP 水平均升高,且阳性药物组高于西洋参总皂苷高剂量组(P<0.05)。见表2。
表2 各组大鼠尿动力学指标水平比较(±s)
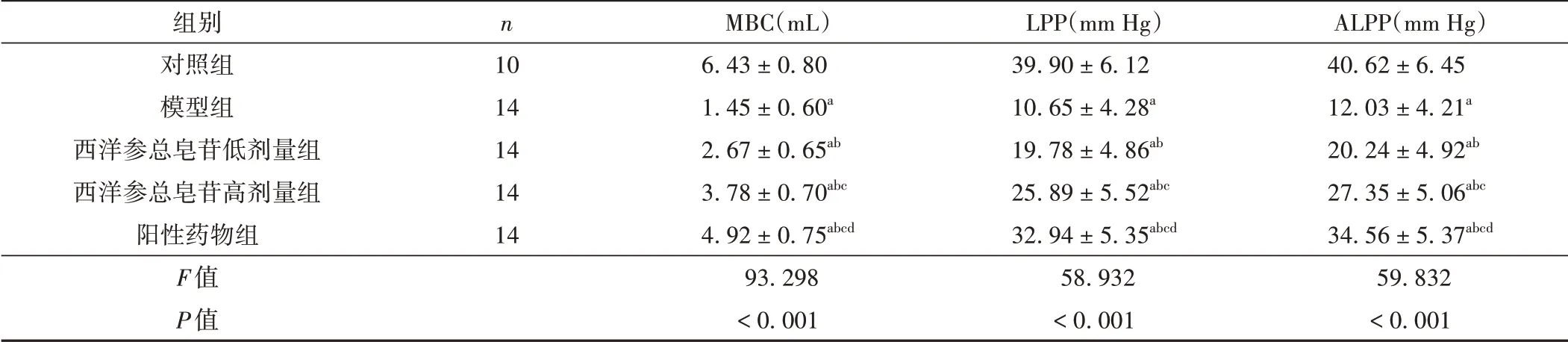
表2 各组大鼠尿动力学指标水平比较(±s)
注:与对照组比较,aP <0.05;与模型组比较,bP <0.05;与西洋参总皂苷低剂量组比较,cP <0.05;与西洋参总皂苷高剂量组比较,dP <0.05。
组别对照组模型组西洋参总皂苷低剂量组西洋参总皂苷高剂量组阳性药物组F值P值n 10 14 14 14 14 MBC(mL)6.43±0.80 1.45±0.60a 2.67±0.65ab 3.78±0.70abc 4.92±0.75abcd 93.298<0.001 LPP(mm Hg)39.90±6.12 10.65±4.28a 19.78±4.86ab 25.89±5.52abc 32.94±5.35abcd 58.932<0.001 ALPP(mm Hg)40.62±6.45 12.03±4.21a 20.24±4.92ab 27.35±5.06abc 34.56±5.37abcd 59.832<0.001
2.2 膀胱内压相关指标水平比较
膀胱内压相关指标排尿量、残余尿量排尿效率经组间比较,差异有统计学意义(P<0.001)。与对照组比较,模型组排尿量、残余尿量升高,排尿效率降低(P<0.05);与模型组比较,西洋参总皂苷低、高剂量组与阳性药物组排尿效率升高,排尿量、残余尿量降低(P<0.05);与西洋参总皂苷低剂量组比较,西洋参总皂苷高剂量组与阳性药物组排尿效率升高,排尿量、残余尿量降低(P<0.05);与西洋参总皂苷高剂量组比较,阳性药物组排尿效率升高,排尿量、残余尿量降低(P<0.05)。见表3。
表3 各组大鼠膀胱内压相关指标水平比较(±s)
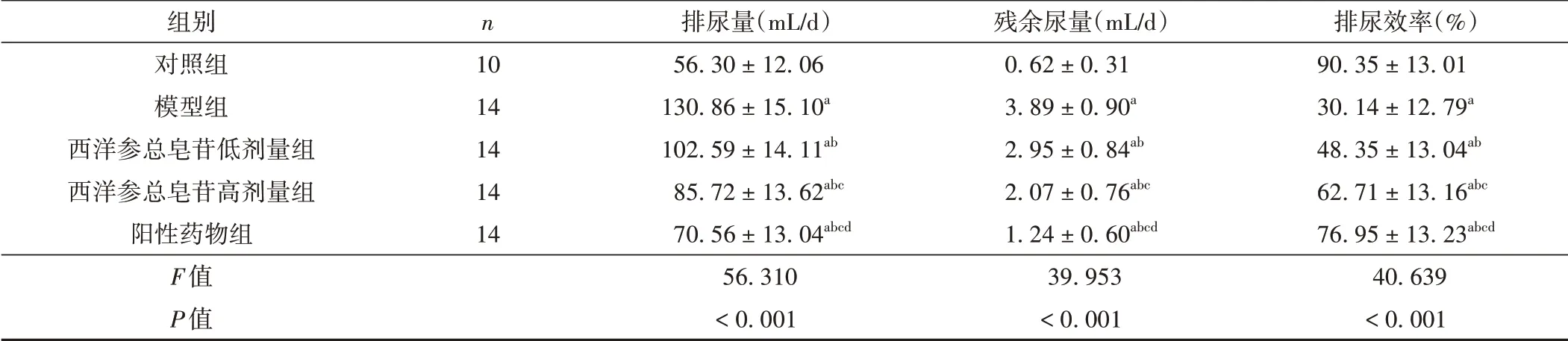
表3 各组大鼠膀胱内压相关指标水平比较(±s)
注:与对照组比较,aP <0.05;与模型组比较,bP <0.05;与西洋参总皂苷低剂量组比较,cP <0.05;与西洋参总皂苷高剂量组比较,dP <0.05。
组别对照组模型组西洋参总皂苷低剂量组西洋参总皂苷高剂量组阳性药物组F值P值n 10 14 14 14 14排尿量(mL/d)56.30±12.06 130.86±15.10a 102.59±14.11ab 85.72±13.62abc 70.56±13.04abcd 56.310<0.001残余尿量(mL/d)0.62±0.31 3.89±0.90a 2.95±0.84ab 2.07±0.76abc 1.24±0.60abcd 39.953<0.001排尿效率(%)90.35±13.01 30.14±12.79a 48.35±13.04ab 62.71±13.16abc 76.95±13.23abcd 40.639<0.001
2.3 尿道组织病理学变化比较
对照组大鼠尿道组织括约肌细胞结构清晰、完整,无异常病理变化;模型组组织细胞、细胞核数量减少、萎缩且结构紊乱,肌层厚度变薄、各肌束间隙扩大,染色不均匀,细胞出现空泡现象;西洋参总皂苷各剂量组与阳性药物组病理状况改善显著,结构相对清晰、细胞核数量相对增加,肌层厚度增加且各肌束细胞间隙缩小,细胞内几乎观察不到空泡现象。见图1。

图1 尿道组织括约肌病理学变化(HE,×200)
2.4 尿道组织TGF-β1、CTGF、Collagen Ⅰ、Collagen ⅢmRNA水平比较
尿道组织TGF-β1、CTGF、Collagen Ⅰ、Collagen ⅢmRNA 水平经组间比较,差异有统计学意义(P<0.001)。与对照组比较,模型组TGF-β1、CTGF、Collagen Ⅰ、Collagen ⅢmRNA 水平降低(P<0.05);与模型组比较,西洋参总皂苷低、高剂量组与阳性药物组TGF-β1、CTGF、Collagen Ⅰ、Collagen ⅢmRNA 水平升高(P<0.05);与西洋参总皂苷低剂量组比较,西洋参总皂苷高剂量组与阳性药物组TGF-β1、CTGF、Collagen Ⅰ、Collagen ⅢmRNA 水平升高,且阳性药物组高于西洋参总皂苷高剂量组(P<0.05)。见表4。
表4 各组大鼠尿道组织TGF-β1、CTGF、Collagen Ⅰ、Collagen ⅢmRNA水平比较(±s)
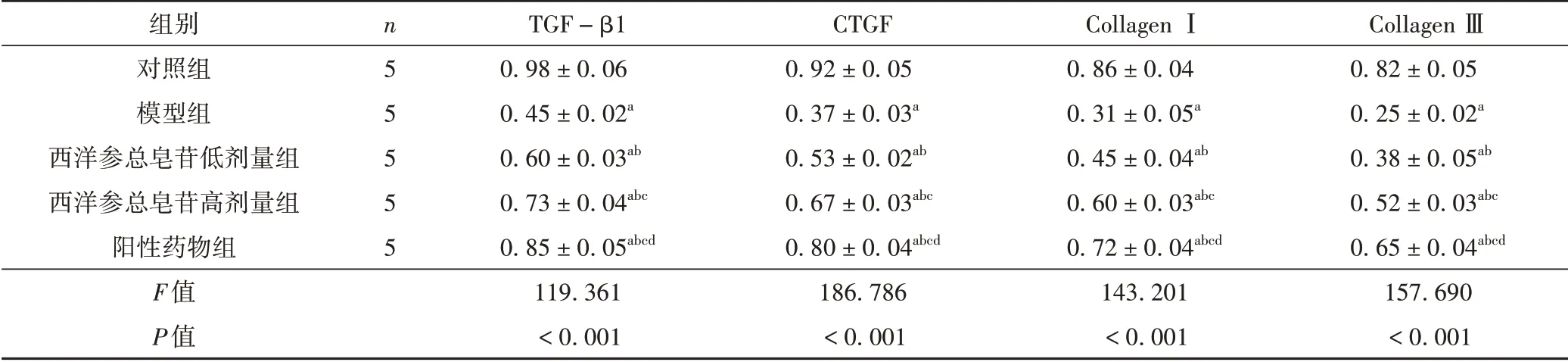
表4 各组大鼠尿道组织TGF-β1、CTGF、Collagen Ⅰ、Collagen ⅢmRNA水平比较(±s)
注:与对照组比较,aP <0.05;与模型组比较,bP <0.05;与西洋参总皂苷低剂量组比较,cP <0.05;与西洋参总皂苷高剂量组比较,dP <0.05。
组别对照组模型组西洋参总皂苷低剂量组西洋参总皂苷高剂量组阳性药物组F值P值n5 5 5 5 5 TGF-β1 0.98±0.06 0.45±0.02a 0.60±0.03ab 0.73±0.04abc 0.85±0.05abcd 119.361<0.001 CTGF 0.92±0.05 0.37±0.03a 0.53±0.02ab 0.67±0.03abc 0.80±0.04abcd 186.786<0.001 Collagen Ⅰ0.86±0.04 0.31±0.05a 0.45±0.04ab 0.60±0.03abc 0.72±0.04abcd 143.201<0.001 Collagen Ⅲ0.82±0.05 0.25±0.02a 0.38±0.05ab 0.52±0.03abc 0.65±0.04abcd 157.690<0.001
2.5 尿道组织TGF- β1、CTGF、Collagen Ⅰ、Collagen Ⅲ蛋白水平比较
尿道组织TGF-β1、CTGF、Collagen Ⅰ、Collagen Ⅲ蛋白水平经组间比较,差异有统计学意义(P<0.001)。与对照组比较,模型组TGF-β1、CTGF、Collagen Ⅰ、Collagen Ⅲ蛋白水平降低(P<0.05);与模型组比较,西洋参总皂苷低、高剂量组与阳性药物组TGF-β1、CTGF、Collagen Ⅰ、Collagen Ⅲ蛋白水平升高(P<0.05);与西洋参总皂苷低剂量组比较,西洋参总皂苷高剂量组与阳性药物组TGF-β1、CTGF、Collagen Ⅰ、Collagen Ⅲ蛋白水平升高,且阳性药物组高于西洋参总皂苷高剂量组(P<0.05)。见表5、图2。

图2 尿道组织TGF-β1、CTGF、Collagen Ⅰ、Collagen Ⅲ蛋白表达
表5 各组大鼠尿道组织TGF-β1、CTGF、Collagen Ⅰ、Collagen Ⅲ蛋白水平比较(±s)

表5 各组大鼠尿道组织TGF-β1、CTGF、Collagen Ⅰ、Collagen Ⅲ蛋白水平比较(±s)
注:与对照组比较,aP <0.05;与模型组比较,bP <0.05;与西洋参总皂苷低剂量组比较,cP <0.05;与西洋参总皂苷高剂量组比较,dP <0.05。
组别对照组模型组西洋参总皂苷低剂量组西洋参总皂苷高剂量组阳性药物组F值P值n5 5 5 5 5 TGF-β1 0.89±0.05 0.35±0.06a 0.49±0.03ab 0.62±0.04abc 0.75±0.05abcd 101.126<0.001 CTGF 0.83±0.06 0.28±0.05a 0.42±0.02ab 0.55±0.03abc 0.68±0.04abcd 128.528<0.001 Collagen Ⅰ0.76±0.06 0.22±0.05a 0.36±0.03ab 0.49±0.05abc 0.61±0.04abcd 99.707<0.001 Collagen Ⅲ0.80±0.07 0.20±0.05a 0.30±0.02ab 0.40±0.03abc 0.56±0.04abcd 134.757<0.001
3 讨论
SUI 被认为是尿道对控尿因“开关-阀门”失控引起的功能性障碍疾病。由于SUI 病理复杂,具体作用机制至今尚未阐明,依据现有研究认为其主要由妊娠、阴道分娩以及绝经后雌性激素水平下降等因素,造成盆底组织松弛、阴道结缔组织支撑减少、尿道内括约肌功能障碍所致[7]。SUI 临床典型症状即腹压增加出现不自主漏尿等现象(包括尿频尿急、急迫性尿失禁、排尿后膀胱区胀满感等)[8]。
作为泌尿系统基本结构与功能单位,尿道括约肌细胞结构和功能异常与SUI发展息息相关。尿道括约肌细胞凋亡、肌小节结构与功能异常,使得具有收缩功能的肌细胞数量减少、单位肌纤维收缩能力减弱,从而导致尿道括约肌功能以及控尿能力下降[9-10]。本研究结果显示,与模型组比较,西洋参总皂苷低、高剂量组和阳性药物组MBC、LPP、ALPP、排尿效率升高,排尿量、残余尿量降低;HE 结果显示,与模型组比较,西洋参总皂苷各剂量组、阳性药物组大鼠尿道组织病理变化均得以有效改善,说明西洋参总皂苷能有效改善大鼠膀胱相关排尿功能,减轻尿道组织损伤。
成纤维细胞在盆底纤维结缔组织中含量丰富,它可通过分泌多类细胞外基质(extracellular matrix,ECM),进而起到调节胶原作用,其中TGF-β1、CTGF因子能促进成纤维细胞分泌和收缩[11]。TGF-β1、CTGF在SUI患者纤维结缔结构组织中含量可能发生变化,推测其可能与SUI发生发展密不可分。TGF-β1是一类多功能蛋白多肽,具有促进成纤维细胞生长、调节ECM合成等作用,且可直接参与组织损伤修复[12]。TGF-β1既与胶原、弹性蛋白合成、降解直接相关,又介导ECM降解酶和相关抑制因子活性表达,且在分娩或手术等造成盆底结缔组织损伤修复过程中起关键作用,TGF-β1不仅和多种细胞因子相关,还可上调胶原mRNA和蛋白表达[13]。CTGF是一种富含半胱氨酸的分泌蛋白,经TGF-β激活后由成纤维细胞合成和分泌,是成纤维细胞增殖的下游介质[14-15]。TGF-β1因子可作为伤口愈合、组织修复和过度ECM积累的驱动因素,它依赖CTGF相关生物功能(如促进细胞增殖、ECM合成等)发挥作用,此外,CTGF作为下游重要调节剂,也是各组织中TGF-β1下游效应分子[16]。研究发现,CTGF可促进TGF-β1信号传导,进而介导ECM相关蛋白(如胶原蛋白)表达[17]。本研究结果显示,西洋参总皂苷各剂量组尿道组织TGF-β1、CTGF、Collagen Ⅰ、Collagen ⅢmRNA和蛋白水平升高,提示西洋参总皂苷可通过调控TGF-β1、CTGF、Collagen Ⅰ、Collagen Ⅲ分子表达,降低SUI大鼠尿道损伤及相关功能障碍。
综上所述,西洋参总皂苷可能通过介导TGF-β1/CTGF 通路相关分子表达,减轻SUI 大鼠尿道损伤,改善排尿功能障碍,这一结果可为西洋参总皂苷相关药物研发与应用提供新思路。
