雷帕霉素对三角褐指藻岩藻黄素含量及关键酶基因表达的影响
2022-06-20韦凤娟龚一富陈荣实王何瑜杨冰迪
韦凤娟,龚一富,章 丽,陈荣实,王何瑜,杨冰迪
(1.宁波大学 海洋学院,宁波 315832;2.宁波大学 食品与药学学院,宁波 315832)
三角褐指藻(Phaeodactylumtricornutum)中含有岩藻黄素(Fucoxanthin)等光辅助合成色素,是生产高品质岩藻黄素的潜在资源[1]。岩藻黄素具有抗癌、抗炎、减肥、抗肿瘤、抗氧化、调节血糖、提高免疫力等多种生物学功能[2-7]。但岩藻黄素产量低,市场对岩藻黄素需求较大,如何提高岩藻黄素产量是目前国内外研究者的关注焦点。前人使用硫酸铈铵、乙酰水杨酸、花生四烯酸、光质等不同诱导子和培养条件提高三角褐指藻岩藻黄素含量[8-11],但要实现岩藻黄素的商业化生产,还需要筛选更多提高岩藻黄素含量的诱导子。
雷帕霉素(Rapamycin,RPM)是从复活节岛的土壤吸湿链霉菌(Streptomyceshygroscopicus)中分离的一种免疫抑制性大环内酯类抗生素[12]。雷帕霉素靶蛋白(Target of Rapamycin,TOR)可使40S核糖体蛋白S6激酶(S6K)磷酸化,并通过调节不敏感的油菜素类固醇-2(BR INSENSITIVE 2)促进叶绿体的产生和幼苗生长[13]。过表达拟南芥(Arabidopsisthaliana)TOR有利于促进生长[14]。RPM可使牡丹(Paeoniasuffruticosa)衰老延迟、切花保鲜期延长[15]。在藻类次生代谢调节的研究中,RPM促进莱茵衣藻(Chlamydomonasreinhardtii)甘油三酯(triacylglycerol,TAG)含量积累[16-17],目前RPM对三角褐指藻次生代谢产物含量影响及机理的研究尚未见报道,本实验研究RPM对三角褐指藻岩藻黄素含量的影响,将扩大RPM在藻类次生代谢调控方面的应用。
岩藻黄素合成途径已基本清楚,八氢番茄红素脱氢酶基因(pds)和番茄红素β-环化酶基因(lcyb)是岩藻黄素生物合成下游途径中的关键酶,其基因表达与岩藻黄素合成息息相关[9-11],且pds和lcyb基因对岩藻黄素积累贡献率最高[9]。前人研究还表明,岩藻黄素含量与光合作用相关[11,18],光系统II蛋白D1基因(psbA)、核酮糖-1,5-二磷酸羧化酶大亚基基因(rbcL)、核酮糖-1,5-二磷酸羧化酶小亚基基因(rbcS)是参与光系统II、决定碳同化速率和植物光呼吸的关键酶,光合抑制剂(DCMU)抑制psbA和rbcL基因的表达,通过抑制光合作用效率从而抑制岩藻黄素的积累[18]。水杨酸处理大豆后rbcS基因表达上升[19],岩藻黄素在植物体内与叶绿素a集合形成蛋白复合体(FCP)参与光合作用[20]。但RPM是否通过合成途径相关酶基因表达调控岩藻黄素的合成,或光合作用相关酶基因表达调控,又或二者共同参与,均未见相关报道。因此,实验通过RPM对三角褐指藻岩藻黄素含量变化影响,以及对岩藻黄素生物合成基因pds、lcyb和光合作用相关基因psbA、rbcL、rbcS、fcpb表达数据分析,为研究RPM对植物次生代谢产物调控提供前期基础研究。
1 材料与方法
1.1 材料
三角褐指藻藻种由宁波大学海洋学院藻类实验室培养提供,藻液体培养基由天然海水过滤高温灭菌,加入1∶1 000比例灭菌MAV母液[21]备用,藻固体培养基在液体培养基基础上加1.2%的琼脂灭菌备用。藻种在固体培养基纯化后加入液体培养基扩繁。
1.2 方法
1.2.1 三角褐指藻的培养及RPM浓度设置
天然海水过滤后高温灭菌,添加1∶1 000灭菌MAV母液制备三角褐指藻培养基,以1∶10比例接入无菌原藻液扩繁培养,藻液置于20 ℃± 1 ℃,12 h/12 h(黑暗/光照)62.5 μmol photons/(m2·s)培养7 d至对数生长期。RPM(上海阿拉丁生化试剂有限公司)溶于无菌水,微量乙醇(国药集团化学试剂有限公司)助溶。0、2.5、5、7.5和10 mmol/L 5个水平的RPM质量浓度,加入三角褐指藻藻液中,共3个生物学重复。
1.2.2 三角褐指藻生长曲线测定
三角褐指藻标准生长曲线参考徐润洁等[11]测定方法。藻液加入RPM后每间隔24 h定时取藻液用紫外分光光度计(UV-5200,上海元析仪器有限公司)测定藻液OD680数值,3个生物学重复。根据标准生长曲线公式换算各RPM处理组藻细胞数作生长曲线。
1.2.3 三角褐指藻叶绿素a含量测定
量取平台末期藻液30 mL,在4 ℃、5 000 r/min离心10 min,弃上清液,藻泥用蒸馏水2次洗涤,1 mL无水乙醇混匀藻泥,避光静置24 h,测量静提液A649、A665处吸光值,计算叶绿素a含量[22]。
Chl a(mg/L)=13.95 ×A665-6.88 ×A649
(1)
1.2.4 岩藻黄素含量的测定
收集各RPM组藻细胞,提取岩藻黄素和测定含量[23-24],3个生物学重复。量取90 mL藻液,4 ℃ 5 000 r/min离心10 min,弃上清液,藻泥-80℃冻存10 h,冷冻干燥48 h,冻干藻泥称重研磨成粉末,约0.1 g。加入1 mL无水乙醇充分混匀,60 ℃避光浸提1 h,2次。4 ℃ 5 000 r/min离心10 min,取上清液,测定提取液A445,计算岩藻黄素含量。
岩藻黄素含量(mg/g DW)=

(2)

1.2.5 RT-QPCR测定岩藻黄素生物合成及光合作用相关基因表达分析
RPM处理对数生长期三角褐指藻24 h,量取藻液90 mL在4 ℃ 5 000 r/min离心10 min,弃上清液,总RNA提取按Plant RNA Kit试剂盒说明书,总RNA反转录cDNA使用Takara Prime Script RT Reagent Kit试剂盒。
三角褐指藻岩藻黄素生物合成代谢通路相关核心序列和转录组测序结果从NCBI下载[9],选出岩藻黄素合成关键酶基因pds和lcyb序列,光合作用相关基因psbA、rbcL、rbcS和fcpb序列。引物设计应用Primer Primer 5.0软件(表1),上海生工生物工程公司合成,模板cDNA为RPM处理组cDNA。SYBR 10 μL、上游引物0.8 μL、下游引物0.8 μL、超纯水6.4 μL、模板2 μL,共20 μL为PCR反应体系。程序在Mastercycler ep realplex实时荧光定量PCR仪(Eppendorf,German)进行,扩增反应程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火40 s,72 ℃延伸20 s,共40个循环;72 ℃延伸10 min。基因相对表达量数据以β-actin作为内参基因,采用2-ΔΔCT法[25]计算得出。

表1 实时荧光定量PCR引物序列
1.2.6 数据分析
采用Mircosoft Excel 2019对数据进行统计、Origin 7.0作图,采用SPSS22.0进行显著性分析。将RPM处理三角褐指藻岩藻黄素生物合成及光合作用相关的6个基因和叶绿素a含量作为指标,与岩藻黄素含量作相关性分析和主成分分析(PCA)。对数据进行标准化处理,提取主成分的特征值/方差,然后提取每个变量的特征值,绘制变量和相关曲线。通过PCA分析,找到对主成分重要的变量,消除嘈杂的数据。
2 结果与分析
2.1 不同浓度RPM对三角褐指藻藻细胞生长的影响
RPM对三角褐指藻细胞生长变化结果表明(图1),RPM处理后1~2 d藻细胞数增长速率均比对照组(0 mmol/L)快,第3天藻细胞数总体下降,第4~5天藻细胞数保持上升,其中5 mmol/L RPM处理组藻细胞数增加得最多。

图1 RPM对三角褐指藻细胞生长的影响
2.2 RPM对三角褐指藻叶绿素a含量的影响
RPM对三角褐指藻叶绿素a含量变化结果表明(图2),7.5 mmol/L RPM处理组的三角褐指藻叶绿素a含量比对照组(0 mmol/L)高,表明7.5 mmol/L RPM可促进三角褐指藻光合作用及色素积累。其他浓度处理组的叶绿素a含量下降,2.5 mmol/L和10 mmol/L RPM对三角褐指藻叶绿素a抑制明显(P<0.01)。
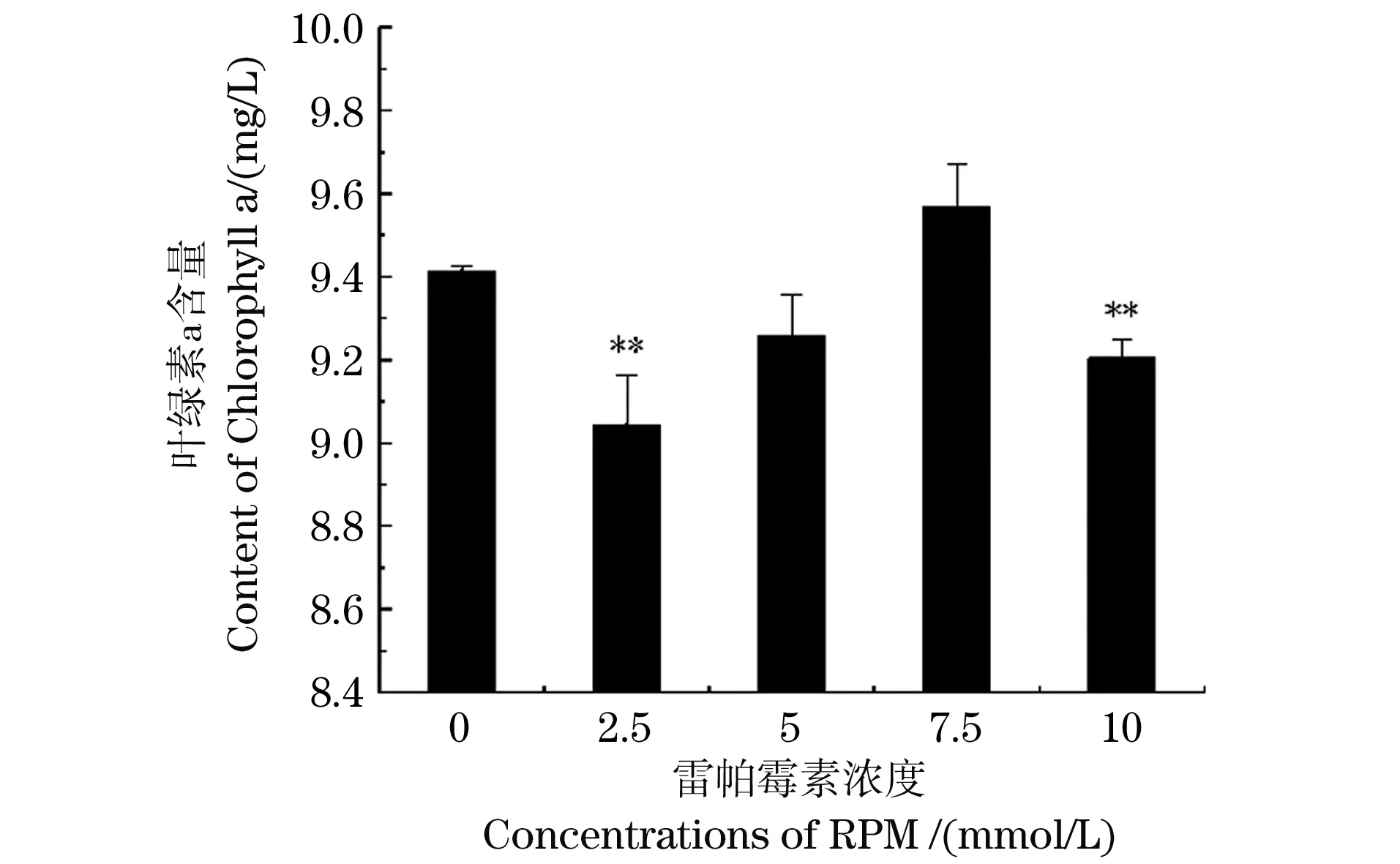
** 为P<0.01。
2.3 RPM对三角褐指藻岩藻黄素含量的影响
RPM对三角褐指藻岩藻黄素含量的影响结果表明[图3(a)],RPM处理组三角褐指藻岩藻黄素含量均高于对照组(0 mmol/L)(P<0.01),其中5 mmol/L和2.5 mmol/LRPM处理组的三角褐指藻岩藻黄素含量都提高了40%。RPM处理对单位藻细胞岩藻黄素含量的影响结果表明[图3(b)],RPM处理单位藻细胞岩藻黄素含量变化跟总岩藻黄素含量变化趋势基本一致,2.5 mmol/L和5 mmol/L RPM处理组三角褐指藻岩藻黄素含量提高31%(P<0.01),表明RPM处理对三角褐指藻岩藻黄素含量积累具有促进作用。
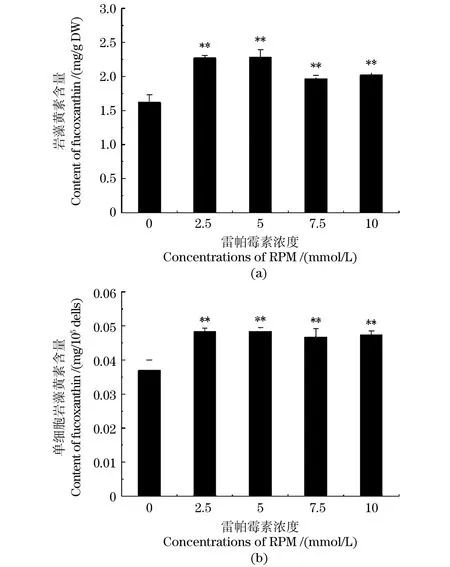
** 为P<0.01。
2.4 RPM对三角褐指藻岩藻黄素生物合成及光合作用相关基因表达影响
RT-qPCR研究结果表明(图4),RPM处理组岩藻黄素合成途径贡献率最高的基因是pds和lcyb,在7.5 mmol/L和10 mmol/L处理组pds的表达量均高于对照组(P<0.01),5 mmol/L处理组pds表达量低于对照组。lcyb基因表达量在RPM处理组中均低于对照组。psbA、rbcL和rbcS3个光合作用相关基因在5 mmol/L RPM处理组表达均上调(P<0.01),fcpb基因则在7.5 mmol/L和10 mmol/L处理组表达上调(P<0.01),即RPM可促进合成途径基因pds及光合基因psbA、rbcL、rbcS和fcpb转录表达。RPM处理组基因转录表达与岩藻黄素含量结果趋势稍有差异,说明岩藻黄素合成途径相关基因和光合作用相关基因共同参与岩藻黄素生物合成。

** 为P<0.01。
2.5 三角褐指藻岩藻黄素含量积累因子的主成分分析
主成分分析结果表明(表2),PC1、PC2和PC3的累计贡献率达91.9%。相关性分析表明(图5),前3个主成分均包含有rbcS、psbA和rbcL基因,均是光合作用相关基因,而岩藻黄素合成基因对岩藻黄素积累贡献率不高,说明光合作用rbcS、psbA和rbcL基因转录是影响三角褐指藻岩藻黄素积累的最重要因子。

表2 8个主成分的贡献率和累积贡献率

图5 岩藻黄素生物合成基因、光合作用相关基因与其含量的主成分分析
3 讨论与结论
施加诱导剂处理藻类,藻类育种、生长形态和生物量的积累有一定改变,RPM在调节代谢、翻译和转录中具有关键作用,通过下游靶标TOR的磷酸化控制细胞增殖、发育和生长[26-27],RPM复合物可调控营养物质、光和能量而促进植物生长[28-29]。研究结果表明,RPM处理三角褐指藻前期促进藻细胞生长,后期抑制藻细胞生长。7.5 mmol/L RPM促进叶绿素a含量,叶绿素a主要参与光合作用,在光合植物中将光能传递给光合电子传递链(PETC)并在其上转化为化学能,植物细胞感光强度和PETC工作速率取决于受盐度、pH值、温度和营养成分等影响的细胞代谢环境[30],故植物受到外界因子刺激伴随一系列反应促进光合作用。光合系统能量过剩时,激发态叶绿素a将能量传递给其他分子转化为热量[31],叶绿素a含量消耗,可能是光合系统叶绿素a含量下降原因之一。RPM处理组三角褐指藻岩藻黄素含量和单位藻细胞岩藻黄素含量均上升(P<0.01),5 mmol/L RPM处理组含量上升最高。光合作用辅助色素中类胡萝卜素在植物类囊体中捕获光照和传递能量,岩藻黄素与叶绿素a结合形成岩藻黄素-叶绿素蛋白复合体(FCP)作为主要类胡萝卜素参与光合作用[20],在植物内起到快速的光保护作用,消耗过剩能量[31]。叶绿素a消耗促进光合作用可能是促进岩藻黄素含量上升因素之一。
研究中岩藻黄素生物合成基因pds和lcyb,光合作用相关基因psbA、rbcL、rbcS和fcpb的表达水平与岩藻黄素含量存在正相关性,rbcS对岩藻黄素合成促进作用明显。贺超英等[19]发现大豆中rbcS基因表达量在NaCl和水杨酸处理24 h后出现高峰。植物中促进rbcS基因的表达具有明显的叶组织特异性和光诱导特异性[32],可提高植物光合效率[33]。DCMU处理三角褐指藻,藻细胞岩藻黄素含量结果[18]与实验结果一致,证明光合作用对岩藻黄素积累具有促进作用。光合作用是植物生产物质量的基础条件,rbcL和rbcS作为Rubisco酶亚基基因可调节酶活直接影响大豆光合效率[34],据基因转录水平推测rbcL和rbcS通过提高藻光合效率促进岩藻黄素含量上升目的;psbA是psⅡ光反应中心D1(32 ku)蛋白的基因,D1蛋白作为psⅡ电子受体参与光诱导的电子传递[35],D1蛋白和Rubisco酶在电子传递链上下游,5 mmol/L RPM处理下藻细胞增量最多,说明电子传递速率高,psbA基因表达水平上调,其他处理组未显著变化,推测高浓度RPM可能会阻断电子链传递;在褐藻中主要收集光的叶黄素是岩藻聚糖,岩藻聚糖复合物包含约相同量的岩藻黄素和叶绿素,高浓度RPM处理组fcpb转录水平出现上调表明在电子传递链受阻到一定临界时,藻内环境可能会自我调节,适应外界环境胁迫,呈现负反馈调节。合成岩藻黄素后两步的催化反应与光照条件有关[36],这也说明光照、光合作用都影响岩藻黄素的积累。徐润洁等[11]的实验结果也验证了这一点。岩藻黄素合成途径贡献率最高的pds和lcyb表达水平未随着RPM浓度呈线性关系,从另一角度说明岩藻黄素合成过程并不仅仅只有生物合成关键酶基因参与了,光合作用也扮演着重要角色。在RPM处理下的藻细胞如何通过自我调节完成岩藻黄素生物量积累过程,还有待探索和研究。
