猪流行性腹泻病毒变异毒株的分离鉴定及遗传演化分析
2022-06-20辛忠昊郭效珍逯晓寒焦安琪刘丽萍孙淑红吴家强
辛忠昊,郭效珍,逯晓寒,焦安琪,刘丽萍,于 江,黄 兵,孙淑红,吴家强,
(1.山东农业大学 动物科技学院,泰安 271018;2.山东省农业科学院家禽研究所 山东省家禽疫病诊断与免疫重点实验室,济南 250000;3.山东省农业科学院畜牧兽医研究所 山东省畜禽疫病防治与繁育重点实验室,济南 250000)
猪流行性腹泻病毒(PEDV)是冠状病毒科冠状病毒属的成员[1],可引起新生仔猪的急性腹泻、呕吐、脱水及高死亡率[2]。该病于1971年首次在英国发现,被命名为病毒流行性腹泻(epidemic viral diarrhea,EVD),EVD-2型病毒株CV777被命名为PEDV[3],1980年我国首次分离到PEDV[4],但并未造成大规模流行及经济损失。2010年末中国养猪场出现了对仔猪具有较高毒力的PEDV变异株[5],并迅速蔓延至国内大部分猪场。该病毒对各阶段的猪均可感染[6],1周龄以下的哺乳仔猪感染后的病死率最高可达100%[7],对我国养猪业造成严重的经济损失[8]。
本研究收集了2020—2021年山东省疑似感染PEDV的临床病料,通过RT-PCR、细胞培养、IFA、测序等方法进行病毒分离鉴定,并应用数据分析软件MEGA 7.0和DNA star将测序数据与NCBI的参考序列进行分析对比和遗传进化分析,以期为我国PEDV的防控及疫苗研发提供理论参考。
1 材料与方法
1.1 病料来源及处理
两份临床阳性病料来自山东某腹泻猪场,取其中一份10日龄腹泻仔猪小肠组织进行研磨稀释,进行后续分离鉴定。
1.2 主要试剂
RNA提取试剂盒、胶回收试剂盒购自BioFlux;One step RT-PCR试剂、DL2000 marker、DL5000 marker购自TaKaRa公司;胎牛血清(FBS)购自BI公司;DMEM培养基、胰蛋白酶购自gibco公司;TPB购自Solarbio公司;鼠源抗PEDV-S蛋白单克隆抗体由华中农业大学何启盖教授实验室惠赠;辣根过氧化物(HRP)标记的羊抗鼠 IgG 二抗购自ABclonal公司。
1.3 细胞及载体
Vero 细胞由本实验保存、DH5α感受态细胞、pMD18T Easyvector购自宝生物工程有限公司。
1.4 病料核酸的提取和RT-PCR检测
根据BioFlux核酸提取试剂盒说明书提取各样品RNA,随后RT-PCR扩增PEDV较保守的N基因。扩增程序如下:45 ℃反转录30 min;94 ℃预变性3 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,35个循环;终延伸5 min。PCR产物经1%的琼脂糖凝胶电泳鉴定结果。
1.5 病毒分离
待小细胞瓶中的Vero细胞密度长至80%左右,将电泳鉴定为阳性病料的组织研磨液冻融3次后10 000 r/min离心,过滤上清液,取滤液500 μL与500 μL维持液(含10 μL胰酶和1%双抗)混合均匀。然后用DMEM洗涤细胞3次。将上述处理好的接毒液接种于小细胞瓶,同时设置一个阴性对照,一同置于37 ℃、5%CO2温箱中,孵育1 h后补液至5 mL。48 h左右观察到有明显病变后收毒。按照此方法,每次收取病毒液后冻融3次,传至第10代后收毒提取RNA用RT-PCR扩增鉴定。
1.6 间接免疫荧光试验
200 μL PEDV病毒液接种于Vero细胞密度为80%左右的24孔板,24~32 h后观察出现细胞病变时弃去维持液,每孔用PBS洗涤3次,随后用4%多聚甲醛室温固定15 min,PBS洗涤3次,用4 ℃预冷的冰甲醇透化10 min,PBS洗涤3次。再用BSA液封闭30 min,最后加入比例稀释好的抗S蛋白单克隆抗体,37 ℃孵育60 min,PBS洗涤3次。再加入同样稀释好的二抗(HRP标记山羊抗鼠IgG)孵育30 min,PBS洗涤3次后置于荧光倒置显微镜下观察。
1.7 PEDV分离株的全基因组扩增及测序
参考PEDV AJ1102株设计该毒株的基因组全长引物,共19段,各段引物序列见表1。用设计的19段引物分段扩增全基因组。PCR产物经电泳鉴定后,用胶回收试剂盒进行回收,然后将回收产物分段连接于pMD-18T载体并转化至Trans 5α感受态细胞中,挑菌PCR鉴定为阳性送至公司测序。

表1 引物序列
1.8 分离株的全基因组及S基因序列对分析和系统发育树构建
用DNA star软件将分离毒株的全基因组和S基因测序结果与NCBI参考序列进行同源性比对,对分离株的核苷酸、氨基酸变异程度进行分析并应用PROVEAN(provean.jcvi.org)对分离毒株S蛋白中的氨基酸突变进行功能预测,构建系统发育树观察该毒株的遗传演化情况及分析氨基酸突变对毒株产生的影响,毒株参考序列见表2。

表2 PEDV参考毒株及序列信息
2 结果与分析
2.1 病料检测
使用本实验室设计的PEDV-N引物对送检样品进行RT-PCR检测,PCR产物经1%琼脂糖凝胶电泳鉴定,扩增长度为1 326 bp,与预期长度一致(图1)。
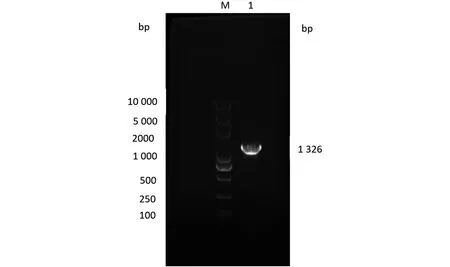
M:DL10000 DNA Marker;1:分离株N蛋白基因。
2.2 毒株的分离鉴定
将送检的小肠组织上清液接种于Vero细胞,48 h后收毒。按照此步骤盲传3代后发现细胞瓶中出现轻微的病变,收毒后继续接毒传代培养至第10代,发现细胞病变显著(图2)。将第10代病毒液进行RT-PCR鉴定结果为阳性,同时将第10代细胞毒进行IFA鉴定,利用抗S蛋白的单克隆抗体进行检测,结果为阳性。证明成功分离到一株PEDV,将其命名为QH-202105株。

(a)阴性对照;(b)分离株第10代病毒引起的病变;(c)IFA绿色荧光;(d)DAPI;(e)Merge。放大倍数为100倍。
2.3 PEDV分离毒株的全基因组扩增、测序拼接
通过RT-PCR对分离株QH-202105的分段扩增,成功扩增出全基因组各片段,各片段大小符合预期。将扩增的全部片段送至擎科生物公司测序,利用Seqman软件对测序结果进行拼接,得到完整的QH-202105全基因组序列。
2.4 全基因组序列的遗传发育树分析
应用MEGA7.0对分离株QH-202105和NCBI中国内外21株PEDV参考毒株进行对比和遗传发育树构建(图3)以分析其遗传变异情况,遗传发育树采用Neighbor-joining方法进行绘制,并进行1 000次Bootstrap举例计算。结果显示,22株PEDV序列主要形成G1、G2两个基因群,本研究分离株属于G2基因群,与G1基因群中经典毒株CV777属不同分支,与G2基因群中变异株AJ1102亲缘关系较近。

▲分析代表本研究分离毒株。
2.5 全基因组核苷酸的同源性分析
通过MegAlign软件对分离株QH-202105同国内外21株PEDV参考序列全基因组进行核苷酸同源性对比,结果显示QH-202105与美国分离株USA/Colorado/2013核苷酸同源性最高,为99.1%,与CHM2013同源性最低,为96.5%。与AJ1102变异株同源性较高,为98.2%,与经典毒株CV777的同源性较低,为96.6%(图4)。
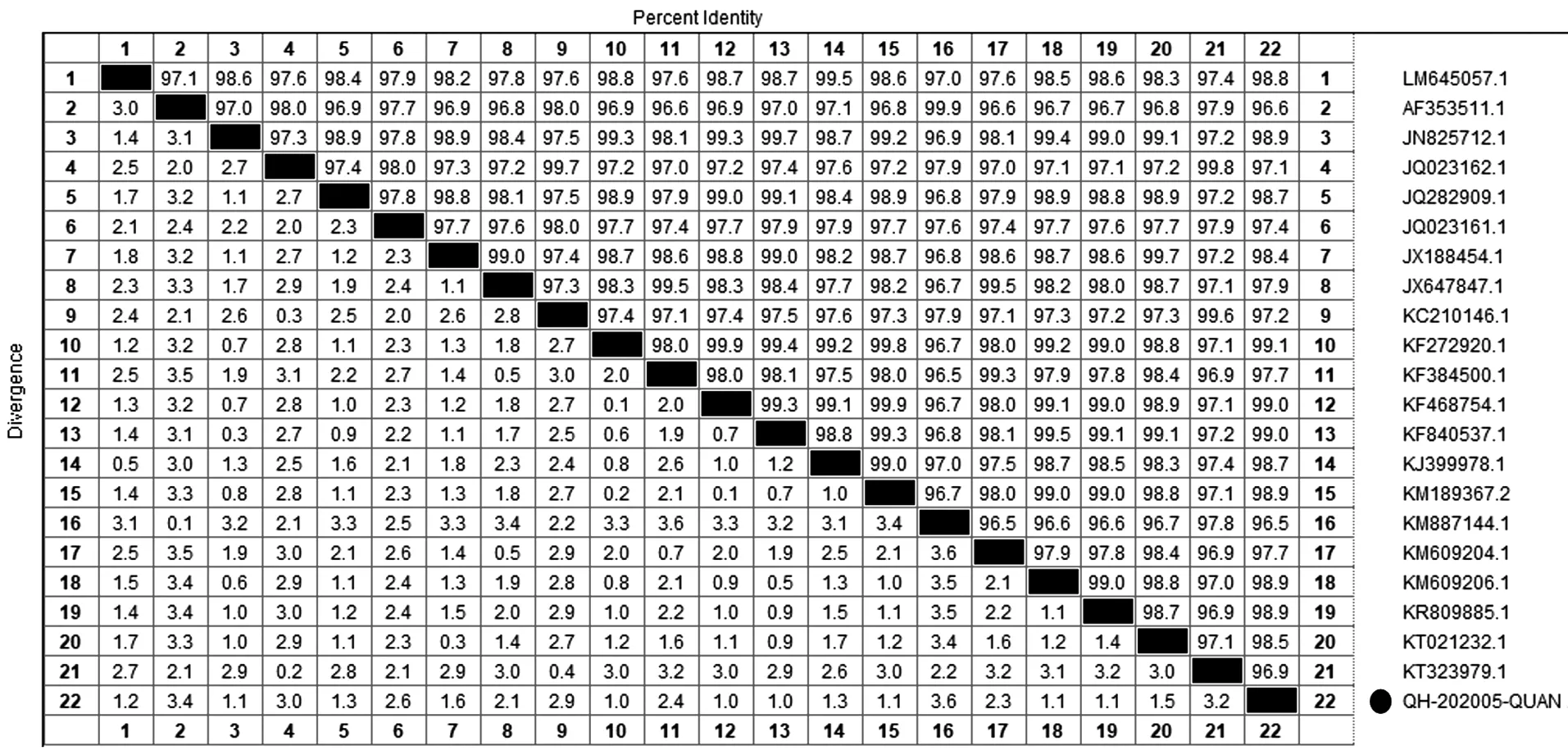
图4 QH-202105和参考毒株全基因组的核苷酸比对
2.6 S基因序列的遗传进化树分析
S基因遗传进化树绘制及算法同全基因组。结果显示,所有毒株分为两大基因群,分别是G1和G2,又将两个群分为a和b两个亚群,与参考毒株不同分支表明S基因存在变异,见图5。本研究的毒株属于G2b亚群,与毒株KM609213.1的亲缘关系最近,与经典毒株CV777亲缘关系较远,属于变异株。

●表示本研究分离毒株。
2.7 S基因序列核苷酸的同源性分析
本研究中分离株QH-202105的S基因全长为4 161 bp,利用与全基因组序列相同的核苷酸比对方法将分离株同31株国内外流行毒株用MegAlign软件进行核苷酸同源性分析,结果表明本研究的分离株S基因与毒株KM887144.1同源性最低,同源性为93.6%,和经典毒株CV777同源性为93.9%,亲缘关系较低,与毒株KM609213.1亲缘关系最近,同源性为99.0%,与中国毒株AJ1102同源性为97.5%(图6)。

●为分离毒株。
2.8 S基因的氨基酸序列分析
分离株S基因的总长为4 161 bp,编码1 387个氨基酸。进一步同USA lowa107 2013、AJ1102、CHM2013、CV777、DR13、OH851等参考毒株进行氨基酸序列变异分析,结果显示,分离株QH-202105在S基因的N端有60多处突变,两处氨基酸插入(包括第59~62位氨基酸的QGVN 4个氨基酸插入,第145位氨基酸N的插入)和两处氨基酸缺失(第115~118氨基酸的缺失,第167~168氨基酸的缺失),以及只有分离株在第32位氨基酸处的突变(F→L)、第143处(N→D)、第235处(P→L)、第239处(N→D),见图7。此外,进一步与变异毒株AJ1102进行比较,发现该分离株在S蛋白的其中一个关键抗原中和表位区(aa 499~638),发现3处氨基酸的突变,第505处(T→I)、第514处(N→I)、第526处(A→S),见图8。PROVEAN预测结果显示,与G2基因群中经典的变异毒株AJ1102进行S蛋白氨基酸比对,QH-202105毒株在1 361处氨基酸由G突变为C,此处的突变被判定为“Deleterious”(图9)。

图7 S蛋白基因的氨基酸序列变异

图8 S蛋白抗原中和表位区氨基酸的突变

图9 QH-202105的氨基酸突变对其毒株功能的影响
3 讨论
1973年PED首次在中国暴发[9],给我国养猪业甚至公共卫生事业造成严重的威胁[10]。中国成功分离出PEDV后[11],经典的CV777毒株被制成灭活疫苗,PEDV得到了一定的控制[12]。但自2010年以来,中国多省份开始暴发PED[13],即使是接种过CV777疫苗的猪场也在所难免,这与PEDV的变异有着重要关系[7]。
PEDV目前只有一个血清型,由于在S基因编码的氨基酸N端的不同,PEDV被分为两大基因群,G1群(G1a、G1b)和G2群(G2a、G2b),2010年之前,亚洲和欧洲绝大多数的PEDV都属于G1a亚群[14]。2010年之后,G2b亚群开始在美国、加拿大和南美洲传播[15],开始与经典PEDV毒株共存,通过构建S基因进化树显示我们分离的毒株属于G2b亚群。已知S蛋白是介导病毒进入并在自然宿主中诱导中和抗体,S1亚单位是细胞外结构域,可与靶细胞受体结合[16],它对细胞膜融合和病毒进入非常重要,是中和抗体的抗原靶点[17]。S0也称为N末端区域,是猪流行性腹泻病毒的功能性受体。PEDV使用N末端区域作为细胞进入的主要受体[18],这是帮助病毒侵入细胞的第一个重要步骤[16]。
任何氨基酸突变都可以改变冠状病毒的毒力[19],将本研究毒株S基因与31株S基因的参考序列对比发现,QH-202105存在大量氨基酸突变、插入或缺失。以USA lowa107 2013、CHM2013、CV777、DR13、OH851等经典毒株为参考,将该毒株的蛋白功能区序列进一步分析发现,在59~62位氨基酸的QGVN 4个氨基酸插入,第145位氨基酸N的插入,这些氨基酸的插入可能会导致当前疫苗和药物效力的下降,这也解释了为什么CV777疫苗不能对仔猪产生足够的保护作用。此外,通过氨基酸的同源性分析发现本研究的分离毒株与同为变异毒株AJ1102有密切关系,在第32位氨基酸处的突变(F→L)、第143处(N→D)、第235处(P→L)、第239处(N→D)。更值得注意的是,QH-202105的S蛋白1 361处的氨基酸突变(G→C)被判定为“Deleterious”时,可以推测,本研究的分离毒株出现了类似于“细胞自噬”的现象以适应当前地区的环境和条件,从而使病毒本身向着有利于自身生存的方向出发,这可能会间接影响QH-202105毒株的侵袭力及毒力。另外,现已证实S蛋白表面的中和表位有4个(aa 499~638、748~755、764~771、1368~1374),本研究分离株的S蛋白在aa 499~638处产生多处氨基酸突变,这对病毒的抗原性和毒力可能会产生重要影响。有研究进一步支持了我们的假设,该研究表明S基因中和表位区域的突变导致疫苗接种效率低下[20]。研究表明,S蛋白、N蛋白和辅助ORF3蛋白在调节PEDV毒株的毒力方面也起着重要作用,可通过逃避宿主免疫机制而造成严重损害[21],辅助蛋白ORF3被鉴定为一种离子通道,具有多种调节功能[22],ORF3蛋白可以与S蛋白一起在病毒复制步骤组装PEDV。ORF3蛋白也通过其在病毒产生中的调节过程与PEDV的毒力相关,总之,ORF3蛋白是PEDV致病性和分子流行病学研究的重要毒力基因[23]。因此,S蛋白和ORF3蛋白中的氨基酸替换可能有助于QH-202105毒株逃避宿主免疫系统,并可能使其病毒的毒力和抗原性发生改变。
通过对分离毒株的核苷酸同源性分析和遗传演化分析发现,参考毒株与QH-202105的同源性较低,这可能提示我们当下PEDV流行毒株不断发生变异和进化,进而可能产生新的毒株。其中S基因的高变异趋势可能增强病毒毒力和侵袭力,从而进一步对我国养猪业造成严重威胁,因此应该密切关注PEDV的流行情况。
