二茂铁基吡喃酮并喹啉化合物的高效合成及其抗氧化性能
2022-06-17张晓平金桂勇马胜涛王二彬赵学斌陈芝飞楚文娟席高磊
张晓平, 金桂勇, 马胜涛, 王二彬, 赵学斌,陈芝飞, 李 倬, 楚文娟, 赵 旭, 席高磊
(1. 河南农业大学烟草学院河南省香精香料与调香工程技术研究中心, 郑州 450002;2. 河南中烟工业有限责任公司技术中心, 郑州 450016)
1 引 言
当前,对天然产物提取或天然骨架结构进行修饰尤其是将多种抗氧化天然骨架结构或官能团集成,已成为当今国际抗氧化技术研究领域的热点[1, 2]. 吡喃酮和喹啉类化合物是两类存在于天然产物中的杂环类化合物,其天然骨架分别包含氧杂环和氮杂环,两者具有广泛的生理或药理作用,如:抗菌[3, 4]、抗氧化[5, 6]和抗肿瘤[7, 8]等. 二茂铁基由于存在富电子体系,常被作为抗氧化官能团,其衍生物拥有较强的抗氧化能力[9, 10]. 然而,国内外关于将二茂铁基团、吡喃酮和喹啉合成为单个化合物以及对其抗氧化性能的研究少有报道. 近年来,本课题组[11]在Povarov三组分反应做了大量研究,以Ce(OTf)3为单一催化剂,催化4-甲基-7-氨基苯并吡喃酮、芳香醛和二茂铁基乙炔合成了二茂铁基吡喃酮并喹啉化合物,产率为24%~62%,发现其具有一定的捕获自由基性能. 此外,文献[12-14]报道采用复合催化剂能够有效提高有机反应的效率和目标化合物的合成产率. 鉴于此,本文开展了二茂铁基吡喃酮并喹啉化合物化合物高效合成及抗氧化活性的研究.
文献[15]报道在催化成环反应过程中,Ce(OTf)3和Sc(OTf)3作为催化剂复合后具有协同作用,这种独特的相互作用能够增强彼此的催化作用. 因此,本文以4-甲基-7-氨基苯并吡喃酮、芳香醛和二茂铁基乙炔为原料,以Ce(OTf)3和Sc(OTf)3为复合催化剂,在加热回流条件下实现了Povarov三组分反应,高效合成了15种二茂铁基吡喃酮并喹啉化合物(1a~1o),产率为40.0%~66.8%,明显高于文献[11]报道的产率. 其中,1a~1o均为文献[11]报道的化合物,其分子结构采用1H NMR、13C NMR和HR-MS(ESI)进行表征. 经抑制自由基引发DNA氧化反应对其抗氧化性能进行测试,以探究多结构骨架化合物抗氧化的构效关系. 测试结果表明15种化合物具有较好的抗氧化活性,这为新型抗氧化剂的开发应用提供了理论支持.
2 实验部分
2.1 主要仪器与试剂
Agilent 1200/6220超高效液相色谱-电喷雾离子源-质谱联用仪,美国Agilent科技有限公司产;Avance AMX-400核磁共振谱仪,美国Bruker公司产;UV1101紫外-可见分光光度计,上海菁华科学仪器有限公司产;JH40全自动熔点仪,上海佳航仪器仪表有限公司产;XS-225A标准电子天平(感量0.1 mg),德国Sartorius公司产;RV10数显型旋转蒸发仪,德国IKA集团产.
分析纯药品:4-甲基-7-氨基苯并吡喃酮、三氟甲磺酸铈、三氟甲磺酸钪,上海阿拉丁生化科技股份有限公司产;三氯乙酸(TCA),上海达瑞精细化学品有限公司产;还原型谷胱甘肽(GSH)、四氯氢醌(TCHQ),上海源叶生物科技有限公司产;2-硫代巴比妥酸(TBA)国药集团化学试剂有限公司产.标准品药品:脱氧核糖核酸钠盐(DNA),比利时Acros Organics公司产;其他使用试剂均为分析纯.
2.2 化合物1a~1o的合成方法
将二茂铁乙炔0.42 g (2.0 mmol)、芳香醛(2.4 mmol)、4-甲基-7-氨基苯并吡喃酮0.42 g (2.4 mmol)、Ce(OTf)30.06 g (0.1 mmol)、Sc(OTf)30.05 g (0.1 mmol)和甲苯10 mL一起加入25 mL圆底烧瓶,搅拌后于110 ℃回流反应2 h (TLC检测). 冷至室温,溶剂浓缩,残留物经硅胶柱层析[洗脱剂:V(二氯甲烷)/V(乙酸乙酯)=20/1]纯化后得到化合物1a~1o(图1). 按此方法合成参比化合物4-甲基-6,8-二苯基吡喃酮并喹啉(1p),为二茂铁基团对吡喃酮并喹啉类抗氧化能力的影响进行深层次研究.

图1 目标化合物合成路线1a~1oFig.1 Synthetic route of target compounds 1a~1o
2.3 抗氧化性能测试
2.3.1 抑制HO·引发的DNA氧化反应检测体系 按照文献[16]方法对产物抑制HO·引发的DNA氧化反应进行检测. 移取13.4 mL 2.24 g/L DNA溶液,加入1 mL 30 mmol/L的H2O2溶液、0.5 mL 120 mmol/L TCHQ溶液和0.1 mL 7.5 mmol/L待测化合物储备液,充分混合后于37 ℃水浴30 min. 从中移取2 mL,再加入1 mL 1% TBA溶液和1 mL 3.0% TCA溶液,于100 ℃水浴加热30 min,冷却至室温,加入1.5 mL正丁醇充分振荡萃取TBARS. 在535 nm下测定正丁醇的吸光度A化合物,以蒸馏水代替化合物储备液测其吸光度A空白.
2.3.2 抑制GS·引发的DNA氧化反应检测体系 按照文献[17]方法对产物抑制GS·引发的DNA氧化反应进行检测.移取13.4 mL 2.24 g/L DNA溶液,加入1 mL 75 mmol/L的CuSO4溶液、0.5 mL 90 mmol/L GSH溶液和0.1 mL 7.5 mmol/L待测化合物储备液,充分混合后于37 ℃水浴90 min. 从中移取2 mL,再加入1 mL 30 mmol/L EDTA溶液、1.0 mL 1.0% TBA溶液和1 mL 3% TCA溶液,于100 ℃水浴加热30 min,冷却至室温,加入1.5 mL正丁醇充分振荡萃取TBARS,在535 nm下测定正丁醇的吸光度A化合物,以蒸馏水代替化合物储备液测吸光度A空白.
3 结果与讨论
3.1 合 成
3.1.1 催化剂筛选 以化合物1a的合成为例,探讨反应条件对化合物1a产率的影响,结果见表1. 由表1可以看出,以Ce(OTf)3和Sc(OTf)3为复合催化剂,110 ℃加热反应2 h,是合成目标化合物的较佳方法,化合物1a的产率为64.8%,高于文献[11]方法产率. 原因是Povarov反应分为两步:首先芳香胺和醛形成Schiff碱,之后Schiff碱与炔发生Diels-Alder反应形成喹啉分子中的吡啶环. 而Ce(OTf)3和Sc(OTf)3不仅可以催化芳香胺和醛形成Schiff碱,也能够活化炔上的C≡C,促使Schiff碱与炔发生Diels-Alder反应生成喹啉. 两者复合后存在协同作用,这种独特的相互作用能够增强彼此的催化作用[15],进一步提高Povarov反应中醛胺缩合反应和Diels-Alder反应的效率,从而产生高于Ce(OTf)3和Sc(OTf)3单独使用时的催化效能,使反应向正方向进行,减少副产物生成,大大提高Povarov-3CR的反应效率.

表1 反应条件对1a产率的影响
3.1.2 化合物结构表征 分别采用JH40全自动熔点仪、核磁共振谱仪(NMR)和超高效液相色谱-电喷雾离子源质谱联用仪(UHPLC-ESI-MS)对化合物1a~1p进行结构表征.
4-甲基-6-二茂铁基-8-苯基吡喃酮并喹啉(1a):黄色固体; 产率64.8%; m.p. 218~220 ℃;1H NMR (400 MHz, CDCl3)δ: 8.68 (s, 1H), 8.27 (s, 2H), 8.10 (s, 1H), 7.82 (s, 1H), 7.60 (d,J= 6.0 Hz, 2H), 7.54 (t,J= 6.8 Hz, 1H), 6.27 (s, 1H), 4.71 (s, 2H), 4.53 (s, 2H), 4.22 (s, 5H), 2.51 (s, 3H);13C NMR (100 MHz, CDCl3): 159.2, 157.3, 152.6, 150.9, 130.1, 129.1, 127.5, 126.3, 124.8, 124.1, 117.1, 115.8, 114.4, 88.4, 72.3, 69.9, 68.5, 19.5; HR-MS(ESI)m/z: Calcd for C29H21FeNO2{[M+H]+} 472.1000, found 472.1008.
4-甲基-6-二茂铁基-8-呋喃基吡喃酮并喹啉(1b):黄色固体; 产率59.7%; m.p. 253~255 ℃;1H NMR (400 MHz, CDCl3)δ: 8.63 (s, 1H), 7.99 (d,J= 8.8 Hz, 1H), 7.79 (d,J= 9.2 Hz, 1H), 7.71 (s, 1H), 7.34 (s, 1H), 6.66~6.67 (m, 1H), 6.25 (s, 1H), 4.69 (s, 2H), 4.51 (s, 2H), 4.23 (s, 5H), 2.49 (s, 3H);13C NMR (100 MHz, CDCl3): 159.2, 153.2, 152.5, 150.9, 149.1, 147.5, 144.7, 126.1, 124.1, 123.3, 117.0, 115.6, 114.3, 112.5, 111.1, 88.4, 72.2, 69.9, 68.3, 19.5; HR-MS(ESI)m/z: Calcd for C27H19FeNO3{[M+H]+} 462.0793, found 462.0790.
4-甲基-6,8-二二茂铁基吡喃酮并喹啉(1c):红色固体; 产率62.2%; m.p. 242~244 ℃;1H NMR (400 MHz, CDCl3)δ: 8.30 (s, 1H), 7.94 (s, 1H), 7.76 (s, 1H), 6.24 (s, 1H), 5.17 (s, 2H), 4.70 (s, 2H), 4.58 (s, 2H), 4.53 (s, 2H), 4.29 (s, 5H), 4.15 (s, 5H), 2.49 (s, 3H);13C NMR (100 MHz, CDCl3): 160.5, 159.5, 152.7, 151.1, 145.5, 145.4, 125.9, 125.1, 123.7, 116.4, 115.2, 113.8, 88.8, 72.3, 71.0, 69.9, 69.8, 68.2, 68.1, 19.5; HR-MS(ESI)m/z: Calcd for C33H25Fe2NO2{[M+H]+} 580.0662, found 580.0660.
4-甲基-6-二茂铁基-8-(4-二甲氨基苯基)吡喃酮并喹啉(1d):黄色固体; 产率47.7%; m.p. 285~287 ℃;1H NMR (400 MHz, CDCl3)δ: 8.53 (s, 1H), 8.27 (s, 3H), 7.81 (s, 1H), 6.91 (s, 2H), 6.27 (s, 1H), 4.79 (s, 2H), 4.58 (s, 2H), 4.30 (s, 5H), 3.12 (s, 6H), 2.51 (s, 3H);13C NMR (100 MHz, CDCl3): 159.5, 152.6, 151.8, 151.0, 128.6, 127.7, 125.9, 124.0, 123.8, 120.9, 116.4, 115.2, 113.8, 112.3, 89.0, 72.2, 69.8, 68.2, 40.3, 19.5; HR-MS(ESI)m/z: Calcd for C31H26FeN2O2{[M+H]+} 515.1422, found 515.1425.
4-甲基-6-二茂铁基-8-(2-甲氧基苯基)吡喃酮并喹啉(1e):黄色固体; 产率66.8%; m.p. 214~216 ℃;1H NMR (400 MHz, CDCl3)δ: 8.69 (s, 1H), 8.12 (s, 1H), 7.91 (d,J= 7.2 Hz, 1H), 7.81 (d,J= 6.0 Hz, 1H), 7.49 (t,J= 7.6 Hz, 1H), 7.18 (t,J= 7.6 Hz, 1H), 7.12 (d,J= 8.4 Hz, 1H), 6.28 (s, 1H), 4.67 (s, 2H), 4.50 (s, 2H), 4.24 (s, 5H), 3.97 (s, 3H), 2.51 (s, 3H);13C NMR (100 MHz, CDCl3): 159.4, 157.4, 157.3, 152.6, 151.0, 150.6, 145.9, 131.9, 130.9, 128.9, 128.7, 126.5, 123.5, 121.4, 117.0, 115.7, 114.3, 111.5, 88.1, 72.3, 69.8, 68.3, 55.5, 19.5; HR-MS(ESI)m/z: Calcd for C30H23FeNO3{[M+H]+} 502.1106, found 502.1103.
4-甲基-6-二茂铁基-8-(3-甲氧基苯基)吡喃酮并喹啉(1f):红色固体; 产率64.9%; m.p. 259~261 ℃;1H NMR (400 MHz, CDCl3)δ: 8.68 (s, 1H), 8.10 (s, 1H), 7.87 (s, 1H), 7.82 (d,J=7.6 Hz, 2H), 7.51 (t,J= 7.6 Hz, 1H), 7.09 (d,J= 7.6 Hz, 1H), 6.28 (s, 1H), 4.71 (s, 2H), 4.53 (s, 2H), 4.22 (s, 5H), 3.97 (s, 3H), 2.51 (s, 3H);13C NMR (100 MHz, CDCl3): 160.3, 159.3, 157.1, 152.6, 150.9, 140.2, 140.1, 130.1, 126.5, 124.9, 123.9, 119.8, 117.2, 116.1, 115.7, 114.4, 112.6, 88.5, 72.3, 69.9, 68.4, 55.5, 19.5; HR-MS(ESI)m/z: Calcd for C30H23FeNO3{[M+H]+} 502.1106, found 502.1110.
4-甲基-6-二茂铁基-8-(4-甲氧基苯基)吡喃酮并喹啉(1g):黄色固体; 产率61.9%; m.p. 241~243 ℃;1H NMR (400 MHz, CDCl3)δ: 8.64 (s, 1H), 8.25 (d,J= 8.4 Hz, 2H), 8.03 (d,J= 6.4 Hz, 1H), 7.79 (d,J= 8.8 Hz, 1H), 7.11 (d,J= 8.0 Hz, 2H), 6.25 (s, 1H), 4.69 (s, 2H), 4.51 (s, 2H), 4.22 (s, 5H), 3.92 (s, 3H), 2.49 (s, 3H);13C NMR (100 MHz, CDCl3): 161.3, 159.3, 157.0, 152.6, 151.0, 150.7, 147.1, 131.2, 129.5, 128.8, 126.3, 124.3, 123.8, 116.8, 115.5, 114.5, 114.1, 88.8, 72.3, 69.8, 68.3, 55.5, 19.5; HR-MS(ESI)m/z: Calcd for C30H23FeNO3{[M+H]+} 502.1106, found 502.1109.
4-甲基-6-二茂铁基-8-(2-氯苯基)吡喃酮并喹啉(1h):黄色固体; 产率66.3%; m.p. 243~245 ℃;1H NMR (400 MHz, CDCl3)δ: 8.54 (s, 1H), 8.05 (d,J= 8.8 Hz, 1H), 7.84 (d,J= 8.8 Hz, 1H), 7.79 (dd,J= 2.4 Hz,J= 6.8 Hz, 1H), 7.58 (dd,J= 2.0 Hz,J= 7.2 Hz, 1H), 7.42~7.49 (m, 2H), 6.29 (s, 1H), 4.69 (s, 2H), 4.51 (s, 2H), 4.19 (s, 5H), 2.52 (s, 3H);13C NMR (100 MHz, CDCl3): 159.2, 157.8, 152.6, 151.1, 150.4, 146.9, 138.9, 132.3, 131.8, 130.5, 130.4, 128.3, 127.4, 126.6, 124.0, 117.3, 116.1, 114.7, 87.9, 72.4, 69.9, 68.6, 19.6; HR-MS(ESI)m/z: Calcd for C29H20ClFeNO2{[M+H]+} 506.0610, found 506.0609.
4-甲基-6-二茂铁基-8-(3-氯苯基)吡喃酮并喹啉(1i):红色固体; 产率62.4%; m.p. 225~227 ℃;1H NMR (400 MHz, CDCl3)δ: 8.65 (s, 1H), 8.31 (s, 1H), 8.11 (d,J= 6.8 Hz, 1H), 8.05 (d,J= 8.8 Hz, 1H), 7.82 (d,J= 8.8 Hz, 1H), 7.49~7.54 (m, 2H), 6.28 (s, 1H), 4.70 (s, 2H), 4.53 (s, 2H), 4.21 (s, 5H), 2.51 (s, 3H);13C NMR (100 MHz, CDCl3): 159.1, 155.8, 152.5, 150.9, 150.5, 148.0, 140.5, 135.3, 130.3, 129.9, 127.7, 126.5, 125.3, 124.5, 124.1, 117.3, 115.9, 114.6, 88.3, 72.3, 69.9, 68.5, 19.5; HR-MS(ESI)m/z: Calcd for C29H20ClFeNO2{[M+H]+} 506.0610, found 506.0603.
4-甲基-6-二茂铁基-8-(4-氯苯基)吡喃酮并喹啉(1j):黄色固体; 产率64.4%; m.p. 286~288 ℃;1H NMR (400 MHz, CDCl3)δ: 8.63 (s, 1H), 8.23 (d,J= 7.6 Hz, 2H), 8.09 (s, 1H), 7.83 (d,J= 7.2 Hz, 1H), 7.57 (d,J= 7.2 Hz, 2H), 6.28 (s, 1H), 4.71 (s, 2H), 4.54 (s, 2H), 4.20 (s, 5H), 2.50 (s, 3H);13C NMR (100 MHz, CDCl3): 159.1, 157.5, 157.5, 156.0, 152.5, 150.9, 136.4, 129.3, 128.8, 126.4, 126.3, 126.3, 124.4, 124.3, 117.2, 115.9, 114.6, 72.3, 69.9, 68.6, 19.5; HR-MS(ESI)m/z: Calcd for C29H20ClFeNO2{[M+H]+} 506.0610, found 506.0608.
4-甲基-6-二茂铁基-8-(2-羟基苯基)吡喃酮并喹啉(1k):黄色固体; 产率48.3%; m.p. 248~250 ℃;1H NMR (400 MHz, CDCl3)δ: 8.81 (s, 1H), 8.08 (s, 1H), 7.96 (d,J= 6.8 Hz, 1H), 7.80 (s, 1H), 7.37 (t,J= 7.2 Hz, 1H), 7.13 (d,J= 8.0 Hz, 1H), 7.05 (t,J= 7.2 Hz, 1H), 6.29 (s, 1H), 4.74 (s, 2H), 4.57 (s, 2H), 4.12 (s, 5H), 2.49 (s, 3H);13C NMR (100 MHz, CDCl3): 158.9, 152.4, 150.8, 148.8, 148.8, 147.4, 125.1, 123.9, 123.8, 123.8, 123.8, 116.2, 114.8, 88.4, 72.6, 70.1, 68.8, 19.7; HR-MS(ESI)m/z: Calcd for C29H21FeNO3{[M+H]+} 488.0949, found 488.0943.
4-甲基-6-二茂铁基-8-(3-羟基苯基)吡喃酮并喹啉(1l):红色固体; 产率44.1%; m.p. 267~269 ℃;1H NMR (400 MHz, DMSO-d6)δ: 9.77 (s, 1H), 8.67 (s, 1H), 7.98 (dd,J= 8.8 Hz,J= 16.0 Hz, 2H), 7.77~7.80 (m, 2H), 7.43 (t,J= 8.0 Hz, 1H), 6.97 (d,J= 7.6 Hz, 1H), 6.38 (s, 1H), 4.86 (s, 2H), 4.46 (s, 2H), 4.17 (s, 5H), 3.34 (s, 3H);13C NMR (100 MHz, DMSO-d6): 158.3, 158.0, 155.8, 153.3, 150.3, 149.9, 147.0, 139.1, 130.1, 125.7, 125.0, 123.9, 117.9, 117.3, 116.0, 115.5, 113.8, 113.7, 87.2, 72.0, 69.8, 68.0, 20.7; HR-MS(ESI)m/z: Calcd for C29H21FeNO3{[M+H]+}488.0949, found 488.0946.
4-甲基-6-二茂铁基-8-(4-羟基苯基)吡喃酮并喹啉(1m):红色固体; 产率40.0%; m.p. 275~277 ℃;1H NMR (400 MHz, DMSO-d6)δ: 10.02 (s, 1H), 8.64 (s, 1H), 8.24 (d,J= 8.0 Hz, 2H), 7.93 (dd,J= 8.4 Hz,J= 20.0 Hz, 2H), 7.00 (d,J= 8.0 Hz, 2H), 6.36 (s, 1H), 4.85 (s, 2H), 4.45 (s, 2H), 4.16 (s, 5H), 3.34 (s, 3H);13C NMR (100 MHz, DMSO-d6): 160.1, 158.9, 156.3, 153.9, 150.9, 150.6, 147.2, 129.2, 129.0, 126.0, 125.4, 123.7, 116.4, 115.9, 115.7, 114.0, 87.7, 72.5, 70.4, 68.4, 19.3; HR-MS(ESI)m/z: Calcd for C29H21FeNO3{[M+H]+} 488.0949, found 488.0944.
4-甲基-6-二茂铁基-8-(3-甲氧基-4-羟基苯基)吡喃酮并喹啉(1n):黄色固体; 产率47.4%; m.p. 281~283 ℃;1H NMR (400 MHz, DMSO-d6)δ: 9.63 (s, 1H), 8.68 (s, 1H), 7.97 (dd,J=8.8 Hz,J= 16.8 Hz, 2H), 7.93 (d,J= 2.0 Hz, 1H), 7.86 (dd,J= 2.0 Hz,J= 8.4 Hz, 1H), 7.02 (d,J= 8.0 Hz, 1H), 6.38 (d,J= 1.2 Hz, 1H), 4.87 (s, 2H), 4.46 (s, 2H), 4.19 (s, 5H), 3.97 (s, 3H), 3.32 (s, 3H);13C NMR (100 MHz, DMSO-d6): 158.9, 156.3, 153.9, 150.9, 150.5, 149.6, 148.5, 147.0, 129.4, 126.1, 125.3, 124.1, 121.0, 116.4, 116.0, 115.7, 114.0, 111.2, 88.1, 72.5, 70.3, 68.4, 56.1, 19.3; HR-MS(ESI)m/z: Calcd for C30H23FeNO4{[M+H]+} 518.1055, found 518.1052.
4-甲基-6-二茂铁基-8-(3,4-二羟基苯基)吡喃酮并喹啉(1o):红色固体; 产率50.7%; m.p. 178~180 ℃;1H NMR (400 MHz, DMSO-d6)δ: 9.48 (s, 1H), 9.37 (s, 1H), 8.61 (s, 1H), 7.92 (dd,J= 8.8 Hz,J= 24.0 Hz, 2H), 7.86 (d,J= 1.6 Hz, 1H), 7.70 (dd,J= 2.0 Hz,J= 8.4 Hz,1H), 6.97 (d,J= 8.4 Hz, 1H), 6.35 (s, 1H), 4.82 (s, 2H), 4.44 (s, 2H), 4.18 (s, 5H), 3.34 (s, 3H);13C NMR (100 MHz, DMSO-d6): 158.9, 156.4, 153.9, 150.9, 150.6, 148.5, 146.8, 146.2, 129.4, 126.0, 125.3, 123.8, 119.4, 116.5, 115.9, 115.6, 114.7, 113.9, 88.0, 72.4, 70.3, 68.4, 19.3; HR-MS(ESI)m/z: Calcd for C29H21FeNO3{[M+H]+} 504.0898, found 504.0893.
4-甲基-6,8-二苯基吡喃酮并喹啉(1p):白色固体; 产率71.6%; m.p. 279~281 ℃;1H NMR (400 MHz, CDCl3)δ: 8.24 (d,J= 7.2 Hz, 3H), 7.91 (d,J= 8.4 Hz, 1H), 7.85 (s, 1H), 7.51~7.56 (m, 6H), 7.43~7.45 (m, 2H), 6.24 (s, 1H), 2.51 (s, 3H);13C NMR (100 MHz, CDCl3): 159.0, 157.9, 152.3, 150.8, 150.4, 149.4, 141.0, 138.2, 130.2, 129.0, 128.1, 128.0, 128.0, 127.7, 126.3, 126.2, 124.4, 122.4, 116.2, 115.9, 114.6, 19.4; HR-MS(ESI)m/z: Calcd for C25H17NO2{[M+H]+} 364.1338, found 364.1336.
3.2 抑制自由基引发的DNA氧化反应性能
3.2.1 抑制HO·引发的DNA氧化反应检测分析 空白实验和加入目标化合物后测得的吸光度值分别记为A空白和A化合物,化合物抗氧化能力可以通过相对于空白TBARS吸光度的百分数(TBARS百分数)进行衡量,即(A化合物/A空白)×100%[18]. 为了更直观地表达化合物抗氧化构效关系,参照文献[19]方法制得化合物TBARS百分数与结构之间的梯形图(图2).
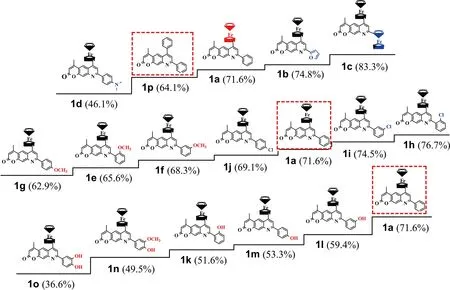
图2 1a~1p抑制HO·引发的DNA氧化反应性能梯形图
由图2可知,化合物1a~1p的TBARS百分数在36.6%~83.3%之间,均远低于空白的100%,表明16个化合物均能够抑制HO·氧化DNA. 化合物1a、1c和1p的TBARS百分数分别为71.6%、83.3%和64.1%. 随着分子中苯环被二茂铁基取代,化合物的TBARS百分数逐渐增大,说明二茂铁基团不利于提高吡喃酮并喹啉化合物抑制HO·引发DNA氧化反应的能力,且随着二茂铁基团数量的增加,抗氧化性能不断降低. 这是因为二茂铁中Fe2+能够与H2O2发生Fenton反应生成Fe3+、HO·和OH-,增加了反应体系中HO·的量,起到促氧化作用[20]. 与化合物1a相比,化合物1b的TBARS百分数相比增加3.2%,说明呋喃环对二茂铁基吡喃酮并喹啉抑制HO·引发的DNA氧化反应能力的贡献低于苯环. 化合物1d的TBARS百分数远小于化合物1a,表明-N(CH3)2起到了提高抗氧化能力的作用,即-N(CH3)2是较为有用的抗氧化官能团[21]. 化合物1e~1g的TBARS百分数在62.9%~68.3%之间,低于化合物1a,说明-OCH3也能提高化合物的抗氧化性能,三者TBARS百分数符合“间位>邻位>对位”规律(-OCH3位置),即-OCH3处于对位时,化合物具有更强的抑制HO·引发DNA氧化反应性能[11]. 化合物1h~1j的TBARS百分数介于69.1%~76.7%,仅化合物1j的TBARS百分数低于化合物1a,说明苯环对位的-Cl起到了抗氧化作用,而邻位和间位的-Cl则发挥了促氧化作用. 含有酚羟基化合物1k~1o的TBARS百分数在36.6%~59.4%之间,远低于化合物1a,说明酚羟基是化合物抑制HO·引发DNA氧化反应的主要官能团. 其中,单羟基化合物中,化合物1k的TBARS百分数最小,说明羟基处于邻位时最有利于提高化合物抑制HO·引发的DNA氧化反应性能. 在化合物1m分子中羟基邻位增加一个-OCH3得到化合物1n,其TBARS百分数继续下降,说明经典的抗氧化结构片段(3-甲氧基-4-羟基苯基结构)[15]发挥了很好的抗氧化作用. 双羟基化合物1o的TBARS百分数明显低于单羟基化合物1k~1m,说明随羟基数目增加,化合物抑制HO·引发DNA氧化反应的性能不断提高.
3.2.2 抑制GS·引发的DNA氧化反应检测分析 参考3.2.1节方法对化合物1a~1p进行抑制GS·引发DNA氧化反应检测,得出TBARS百分数,并做梯形图(图3).
由图3可知,化合物1a~1p的TBARS百分数在22.9%~67.2%之间,远低于空白的100%,说明16种化合物均可抑制GS·引发DNA氧化,与3.2.1节抑制HO·引发DNA氧化结果相同. 其中,化合物1p的TBARS百分数是62.7%,引入单个二茂铁基和两个二茂铁基所生成的化合物1a和1c,其TBARS百分数分别是57.7%和43.3%,三者TBARS百分数顺序为化合

图3 1a~1p抑制GS·引发的DNA氧化反应性能梯形图Fig.3 The activities ladder diagram of 1a~1p in inhibiting GS·induced oxidation of DNA

图4 二茂铁基喹啉抑制GS·引发的DNA氧化反应性能梯形图
物1c<化合物1a<化合物1p,表明二茂铁基团能够提高化合物抑制GS·引发DNA氧化反应的能力,而且随二茂铁基团数量增加,抗氧化性能迅速提高.这与抑制HO·引发DNA氧化反应所得结论相反,原因在于引入二茂铁基团增大了化合物的共轭体系,增加了与GS·发生自由基加成的位点,提高了抑制GS·引发DNA氧化反应的性能,同时二茂铁基中Fe2+也起到了一定的抗氧化作用[22]. 化合物1b的TBARS百分数低于化合物1a,表明2′-呋喃基比苯基有利于抑制GS·引发的DNA氧化反应,这与抑制HO·引发的DNA氧化反应体系的结果相反. 化合物1d的TBARS百分数远小于化合物1a,说明4′-(N(CH3)2)有助于化合物抑制GS·引发的DNA氧化反应,与抑制HO·引发的DNA氧化反应一致. 在化合物1a的8-位苯环不同位置引入-OCH3或-Cl后,所得化合物1e~1g的TBARS百分数在52.2%~55.6%之间,均低于化合物1a,而化合物1h~1j的TBARS百分数介于63.1%~67.2%,均高于化合物1a,说明给电子基团-OCH3有抗氧化作用,而吸电子基团-Cl则有促氧化作用. 其中,化合物1e、1f和1g的TBARS百分数符合(-OCH3位置)“间位>对位>邻位”的规律,说明-OCH3处于邻位更有利于化合物抑制GS·引发DNA氧化反应. 含羟基化合物1k~1o的TBARS百分数均小于48%,表明酚羟基作为传统抗氧化基团,能够有效提高化合物抑制GS·引发的DNA氧化反应能力. 其中,化合物1m的TBARS百分数小于化合物1k和1l,表明羟基处于对位最有利于提高化合物抑制GS·引发的DNA氧化反应性能. 化合物1n的TBARS百分数小于化合物1m,表明-OCH3和-OH存在协同作用,可进一步提高单羟基化合物的抗氧化作用. 16种化合物中,双羟基化合物1o的TBARS百分数最低,说明随羟基数目增加,化合物抑制GS·引发DNA氧化反应的性能不断提高. 此外,将文献[23]报道的13种二茂铁基喹啉化合物抑制GS·引发DNA氧化反应结果作图(图4), 对比发现,其TBARS百分数明显高于结构对应的二茂铁基吡喃酮并喹啉化合物,表明后者的抗氧化性能明显优于前者,即增大共轭体系能够提高化合物抑制GS·引发DNA氧化反应的性能. 原因是随化合物的空间位阻增大,分子更容易识别DNA,并嵌入DNA凹槽与其结合,起到抗氧化的作用[11, 24].
4 结 论
本文采用Ce(OTf)3和Sc(OTf)3复合催化Povarov三组分反应高效制备了15种二茂铁基吡喃酮并喹啉化合物(1a~1o),通过检测化合物抑制自由基(HO·和GS·)引起的DNA氧化反应探究其抗氧化性能. 结果表明:15个二茂铁基吡喃酮并喹啉化合物均可有效抑制自由基(HO·和GS·)引发DNA氧化,其抗氧化能力优于对应的二茂铁基喹啉化合物,是一类性能优良的抗氧化剂. 二茂铁基吡喃酮并喹啉分子中引入推电子基团(-N(CH3)2、-OCH3和-OH)能够提高其抗氧化活性,推电子基团还有一定的协同抗氧化作用,而且随推电子基团数目增加,抗氧化能力随之提升;分子结构引入吸电子基团(-Cl)则抗氧化能力有所降低. 分子结构引入二茂铁基团和呋喃基团降低了化合物抑制HO·引发DNA氧化能力,但提高了抑制GS·引发DNA氧化能力. 化合物1o抑制HO·和GS·引发DNA氧化反应TBARS百分数分别是36.6%和22.9%,与其他化合物相比最优,是优异的抗氧化剂.
