17β-雌二醇抑制LPS诱导Raw264.7细胞炎症反应及其作用机制
2022-06-17余紫薇王晓杜罗通旺巴少波宋泉江宋厚辉邵春艳
余紫薇,王晓杜,罗通旺,姜 胜,巴少波,王 磊,宋泉江,周 彬,宋厚辉,邵春艳
(浙江农林大学 动物科技学院/动物医学院,浙江省畜禽绿色生态健康养殖应用技术研究重点实验室/动物健康互联网检测技术浙江省工程研究中心/浙江省动物医学与健康管理国际科技合作基地/中澳动物健康大数据分析联合实验室, 浙江 杭州 311300)
子宫内膜炎是一种常发生于奶畜产后的生殖系统疾病,可引起奶畜子宫复旧不全、产奶量下降、受孕率降低甚至不孕,发病率高达 10%~20%,严重影响奶畜的生产性能,给奶畜养殖业造成巨大的经济损失,阻碍养殖业的健康发展[1-3]。导致子宫内膜炎发生最直接的原因是病原微生物感染,但同时也受机体性激素周期性变化的影响[4-7]。大量研究显示,当奶畜机体雌激素水平降低时,更易感染子宫内膜炎[8-10]。研究显示,雌激素不仅对生殖系统有不可缺少的作用,对免疫系统也有重要的调节作用[11-13]。17β-雌二醇(17β-E2)是一种甾体雌激素,是雌性动物生殖阶段最主要的性激素[14]。脂多糖(LPS)是革兰阴性细菌细胞壁外壁的组成成分,具有很强的致炎活性,能诱导细胞炎症因子不同程度表达,在体外试验中常用于诱导不同细胞构建细胞炎症模型[15-16]。截止目前,关于雌激素对子宫内膜炎的保护作用及其作用机理还不甚明确。因此本试验首先添加17β-E2进行预处理,再以LPS诱导小鼠巨噬细胞Raw264.7细胞炎症,通过测定细胞炎性因子IL-1β、IL-18和NLRP3 mRNA的表达量和细胞内及上清中IL-1β的蛋白表达量,探究17β-E2对Raw264.7细胞炎症的保护作用,并研究其对炎症通路NF-κB信号通路相关因子蛋白水平的调控,以期揭示17β-E2抑制LPS诱导的Raw264.7细胞炎症机制,为奶畜子宫内膜炎的防控与治疗提供理论依据。
1 材料与方法
1.1 主要材料和试剂细胞株小鼠巨噬细胞Raw264.7购自中国科学院上海细胞库;17β-E2、PHTPP(ERβ抑制剂)、LPS(O111:B4)和5′-三磷酸腺苷(ATP)购自Sigma公司;ICI 182 780(ER抑制剂)购自Abcam公司;DMEM培养基、无血清无酚红培养基、PBS(pH7.2)、0.25% Trypsin-EDTA和双抗购自Gibco公司;IL-1β检测试剂盒购自RD公司;抗体p-IκBα、IκBα、PARP、IL-1β和NF-κB p65购自CST公司;MPP(ERα抑制剂)和anti-β-actin购自Santa Cruz公司;qRT-PCR荧光定量检测试剂盒购自TaKaRa公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术有限公司。
1.2 实验仪器超净操作台(苏州净化);移液枪(Eppendorf);电动移液器(Bio-Rad);超声波细胞破碎仪(宁波新芝);蛋白电泳仪(Bio-Rad);台式高速冷冻离心机(Beckman);多功能酶标仪(Bio Tek);制冰机(宁波格兰特)。
1.3 LPS最佳作用浓度及时间的筛选Raw264.7细胞培养于含有10% FBS的DMEM培养液中,待细胞长满后用0.25% Trypsin-EDTA消化,调整细胞密度为6.5×106个/L,200 μL/孔接种至96孔细胞板,待细胞长至80%左右时,分别向细胞上清中添加LPS,其终质量浓度分别为0,1,10,100和1 000 μg/L,在收集细胞前30 min再加入ATP(终浓度5 mmol/L),分别于LPS刺激后1,2,4和8 h收集细胞,用于TLR4、IL-1β和IL-18 mRNA水平检测。
1.4 17β-E2预处理及细胞分组为研究17β-E2对细胞炎症的作用效果,在Raw264.7细胞长至80%左右时,将细胞培养液更换为无血清无酚红培养基。先向细胞中加入17β-E2(终浓度100 nmol/L)孵育24 h,再加入LPS(终质量浓度1 000 μg/L)作用4 h,在收集细胞前30 min再加入ATP(终浓度5 mmol/L)。为研究雌激素受体及其亚型对17β-E2的抑制效果,在加入17β-E2前30 min先分别加入ICI 182 780/MPP/PHTPP(终浓度均为250 nmol/L),再依次加入17β-E2、LPS和ATP,并分别设置空白组(Mock)、对照组(DMSO)、LPS组和E2/ICI 182 780/MPP/PHTPP单独对照组。
1.5 qRT-PCR法检测Raw264.7相关因子mRNA表达根据试验分组,收集各组细胞,加入TRNzol裂解液提取细胞RNA,根据反转录试剂盒说明,将RNA反转录为cDNA,使用实时荧光定量试剂盒进行qRT-PCR检测。用DNAStar与Beacon Designer软件设计引物,TLR4、IL-1β、IL-18、NLRP3和β-actin具体引物序列见表1,所用引物由苏州金唯智生物科技有限公司合成。各组细胞分别设置3个复孔,记录各孔Ct值,采用分析2-△△Ct法对结果进行。

表1 引物序列
1.6 Western blot法检测Raw264.7相关蛋白表达根据试验分组,收集各组细胞,加入适量细胞裂解液及1%蛋白酶抑制剂,冰上吹打后超声,4℃,12 000 r/min 离心15 min后取上清,用BCA蛋白浓度测定试剂盒进行蛋白定量。上样量为20 μg,制胶后进行SDS-PAGE电泳,湿转至PVDF膜上,5%脱脂奶粉室温封闭2 h,TBST洗膜3次,分别用IL-1β、NF-κB p65、p-IκBα、IκBα、PARP、β-actin一抗室温孵育1 h,TBST洗膜3次,二抗室温孵育1 h,再用TBST洗膜3次。滴加ECL显色液显影拍照,并用Image J软件对各蛋白表达情况进行灰度值分析。
1.7 ELISA法检测Raw264.7细胞上清中IL-1β含量根据试验分组,收集各组细胞上清,采用酶联免疫吸附法(ELISA)检测各组细胞上清中IL-1β含量变化,按照试剂盒说明书开展试验,用酶标仪测定各组吸光度。
1.8 细胞免疫荧光法检测NF-κB p65在细胞内的表达和定位按上述分组进行制备细胞爬片,用4%多聚甲醛固定爬片15 min,0.5% Triton X-100室温通透20 min 1% BSA室温封闭30 min。移除封闭液,每张爬片滴加1∶400稀释的一抗,4℃孵育过夜,PBST 清洗爬片3次,移除多余液体后滴加1∶500 稀释的荧光二抗,37℃孵育1 h。PBST清洗爬片3次,滴加1∶1 000稀释的DAPI避光37℃孵育5 min,封片,荧光显微镜下观察采集图像。
2 结果
2.1 LPS对Raw264.7细胞炎性相关因子mRNA表达的影响以不同质量浓度LPS分别作用Raw264.7不同的时间,通过qRT-PCR法检测Raw264.7细胞中TLR4、IL-1β和IL-18 mRNA表达水平。结果如图1所示,与Mock组相比, 1 000 μg/L浓度的LPS作用Raw264.7细胞4 h时,TLR4、IL-1β、IL-18 mRNA表达均极显著提高(P<0.01)。因此后续试验选取1 000 μg/L的LPS作用Raw264.7细胞4 h为本试验的体外研究细胞炎症模型。
2.2 17β-E2对LPS诱导的Raw264.7细胞TLR4及炎症相关因子mRNA表达的影响为研究17β-E2对炎症反应的影响,通过qRT-PCR法检测Raw264.7细胞中TLR4、IL-1β、IL-18和NLRP3 mRNA表达水平。结果如图2显示,与Mock组相比,DMSO处理对细胞炎症因子的表达无明显影响。LPS诱导Raw264.7细胞后4 h,TLR4的mRNA水平显著提高(P<0.05),IL-1β、IL-18、NLRP3 mRNA表达极显著提高(P<0.01)。与LPS组相比, E2+LPS共处理组TLR4、IL-1β 、IL-18和NLRP3 mRNA表达均降低,差异显著(P<0.05)。

与Mock组相比,*P<0.05,**P<0.01;与LPS组相比,#P<0.05,##P<0.01。下同
2.3 17β-E2对LPS诱导Raw264.7细胞中IL-1β蛋白表达量的影响为验证17β-E2对LPS诱导的Raw264.7细胞炎症反应的影响,首先向Raw264.7细胞中添加终浓度为250 nmol/L的雌激素受体抑制剂ICI 182 780孵育30 min,再依次加入17β-E2、LPS和ATP,分别收集细胞上清和沉淀,用WB和ELISA法检测各组IL-1β的表达情况。结果如图3所示,与Mock组相比,E2处理组IL-1β细胞上清和沉淀中蛋白表达水平均无显著变化(P>0.05),LPS处理极显著提高IL-1β蛋白表达水平(P<0.01)。与LPS组相比,E2+LPS组细胞和上清中IL-1β蛋白表达量均下降,差异极显著(P<0.01),而ICI 182 780+E2+LPS组细胞中IL-1β蛋白表达量与LPS组相比则无显著性差异(P>0.05)。

图3 17β-E2对LPS诱导Raw264.7细胞中IL-1β蛋白表达量的影响
2.4 17β-E2对LPS诱导Raw264.7细胞中p-IκBα和NF-κB p65表达的影响为进一步探究17β-E2抑制LPS引起的细胞炎症反应的分子机制,分别收集各组细胞沉淀抽提细胞核和细胞浆蛋白,用WB方法分别检测细胞核内NF-κB p65,细胞浆中NF-κB p65、p-IκBα和IκBα的蛋白表达情况。结果如图4所示,与Mock组相比,LPS处理极显著提高了细胞核中NF-κB p65的蛋白表达量(P<0.01),E2处理细胞核中NF-κB p65表达量和细胞浆中p-IκBα水平均无明显变化(P>0.05)。与LPS组相比, E2+LPS组细胞核中NF-κB p65的蛋白表达量和细胞浆中p-IκBα水平均极显著下降(P<0.01)。

图4 17β-E2对LPS诱导Raw264.7细胞中p-IκBα和NF-κB p65表达的影响
2.5 17β-E2对LPS诱导的Raw264.7细胞内NF-κB p65表达量的变化为进一步探究17β-E2发挥抗炎作用的ER亚型,分别使用ERα和ERβ拮抗剂进行试验。首先向Raw264.7细胞中分别添加终浓度为250 nmol/L的ER抑制剂ICI 182 780,ERα的选择性拮抗剂MPP,ERβ的选择性拮抗剂PHTPP,孵育30 min,而后再依次加入17β-E2、LPS和ATP。用免疫荧光法观察NF-κB p65在细胞内的表达量和定位情况。结果如图5所示,与Mock组相比,LPS处理组NF-κB p65在细胞核内的表达量急剧升高,E2+LPS组p65多在细胞质内有表达,ICI182 780+E2+LPS组NF-κB p65在细胞核中的表达量再次升高,MPP+E2+LPS组NF-κB p65主要在细胞质中有表达,PHTPP+E2+LPS组NF-κB p65在细胞核中的表达量较高。
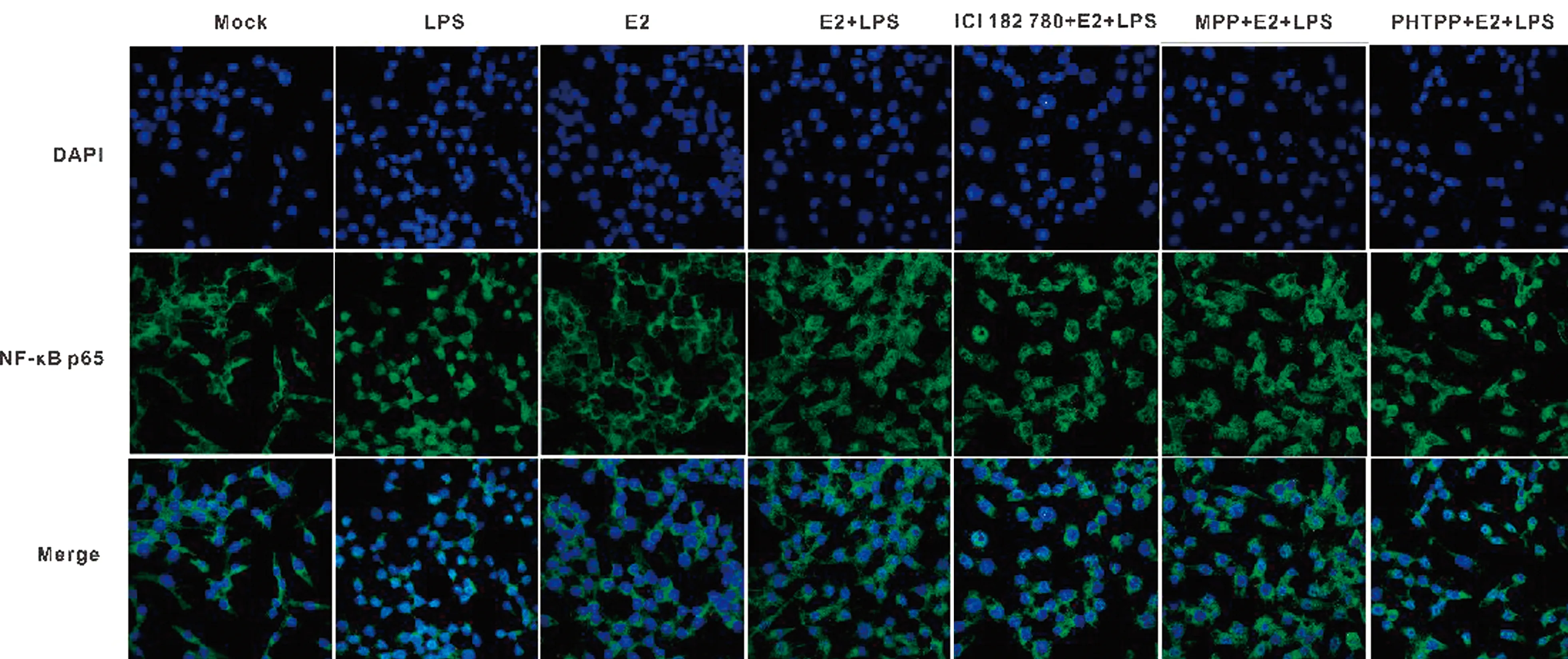
图5 17β-E2对LPS诱导的Raw264.7细胞内NF-κB p65表达量的变化(6 400×)
3 讨论
雌激素是主要是由卵巢的卵泡分泌的一种类固醇激素,主要包括雌酮、雌二醇和雌三醇等,其中雌二醇(17β-E2)的生物活性最强。除了促进雌性生殖系统生长发育外,雌激素还参与细胞的生长、分化、免疫应答和炎症反应等,还与自身免疫性疾病密切相关[17-21]。在人医领域,广泛采用雌激素联合甲硝唑治疗绝经后老年性阴道炎,疗效显著[22]。但截止目前,雌激素抗炎作用的具体机制尚不清楚[4]。本试验采用质量浓度1 000 μg/L的LPS作用Raw264.7细胞4 h,构建细胞炎症模型来探讨17β-E2对LPS诱导细胞炎症的保护作用。结果显示,从mRNA表达水平上看,与Mock组相比,LPS处理后细胞IL-1β、IL-18、NLRP3表达极显著提高(P<0.01),TLR4表达提高(P<0.05),与LPS组相比,E2+LPS处理组极显著抑制了IL-1β 、IL-18和NLRP3表达(P<0.01),显著降低了TLR4表达(P<0.05),这与张莉莉等[23]的研究结果一致。从蛋白表达水平上看,与Mock组相比,LPS处理极显著提高细胞内和细胞上清中IL-1β水平(P<0.01),与LPS组相比,E2+LPS组细胞内和上清中IL-1β蛋白表达量均极显著下降(P<0.01)。而ICI 182 780+E2+LPS组细胞上清中IL-1β蛋白表达量提高(P<0.05)。结果表明17β-E2可抑制LPS引起的细胞炎症反应,而ICI 182 780又可以拮抗E2的炎症抑制反应,进一步验证了17β-E2的抗炎作用。
核因子kappa B(NF-κB)家族的转录因子是免疫发育、免疫反应、炎症和癌症的关键调节器[24-25]。NF-κB家族主要成员包括p65和p50,正常生理情况下,两者以异二聚体形式存在于细胞质中,当受到炎症等刺激因素时,NF-κB通路被激活,p65从细胞质转移至细胞核,进而促进促炎因子TNF-α、IL-1β、IL-6的释放[26-28]。在本试验中,通过分离细胞核和细胞浆蛋白,用WB方法分别检测细胞核内NF-κB p65以及细胞浆中NF-κB p65、p-IκBα、IκBα的表达情况。结果显示,与Mock组相比,LPS处理极显著提高了细胞核中NF-κB p65的蛋白表达量(P<0.01),与LPS处理组相比,E2+LPS组细胞核中NF-κB p65的蛋白表达量和细胞浆中IκBα的磷酸化水平均极显著下降(P<0.01)。
雌激素受体(ER)是雌激素作用的关键配体,其与雌激素结合后可调控下游靶基因的表达,其主要包括两种亚型ERα和ERβ[29]。研究显示,患有子宫内膜炎母犬和母马中,子宫腺中ER表达量均显著低于正常母犬和母马[4,30]。本试验分别通过添加ER、ERα和ERβ拮抗剂的方式,观察17β-E2对LPS诱导的Raw264.7细胞内NF-κB p65入核的变化。结果显示,LPS处理组NF-κB p65在细胞核内的表达量急剧升高,E2+LPS组p65多在细胞质内有表达,加入ERβ的选择性拮抗剂PHTPP后,p65在细胞核中的表达量较高,而加入ERα选择性拮抗剂MPP,p65仍主要在细胞质中表达。这表明雌激素主要通过与ERβ结合后,抑制NF-κB p65进入细胞核和抑制IκBα磷酸化的水平,从而抑制细胞炎症反应的发生。
综上所述,17β-E2对LPS诱导RAW264.7细胞炎症具有保护作用,其机制可能是通过与雌激素受体ERβ结合介导NF-κB 信号通路,进而抑制促炎因子IL-1β的表达,从而发挥抗炎作用。
