布鲁菌M5疫苗株感染对宿主细胞自噬溶酶体途径的影响
2022-06-17杨宁宁易继海陈创夫
杨宁宁,张 倩,易继海,王 震*,陈创夫*
(1.石河子大学 动物科技学院 人兽共患病重点实验室,新疆 石河子 832000;2.西部地区高发人兽共患传染性疾病防治协同创新中心,新疆 石河子 832000;3.新疆农垦科学院 省部共建绵羊遗传改良与健康养殖国家重点实验室,新疆 石河子832000)
自噬是一种广泛存在于真核细胞中高度保守的细胞内降解过程[1]。通过自噬作用,细胞质里的物质被自噬体双层膜结构所包裹,通过与溶酶体融合形成自噬溶酶体,胞质里的物质就被溶酶体所降解[2]。按照细胞内底物运送至溶酶体的方式的差异可将自噬分为3类,即:微自噬、巨自噬和分子伴侣介导的自噬,一般情况下“巨自噬”即常称为自噬[3]。自噬相关基因(autophagy-related gene,Atg)是细胞自噬的重要调节点[4-5]。目前仅有微管相关蛋白轻链 3 (microtubule-associated protein light chain 3,LC3)参与哺乳动物细胞自噬发生的整个过程,因此可作为细胞自噬过程中的重要标志之一[6-8]。 LC3在细胞内存在两种形式,即:LC3-Ⅰ和LC3-Ⅱ,由于 LC3-Ⅱ参与自噬体膜形成的始终,因此,细胞中 LC3-Ⅱ的含量在一定程度上反映了该细胞的自噬程度[9-11]。
研究发现,胞内病原微生物(细菌、病毒等)可通过自噬调控其在胞内的复制过程,一方面,自噬可以降解杀灭入侵的病原微生物,清除胞内病原体,维持机体的自身稳定;另一方面,自噬可被一些病原微生物所利用,促进其对宿主的感染,起到损伤宿主细胞作用[12-16]。本课题组前期的研究表明可以用绿色荧光蛋白表达质粒 pWal-GFP电转化布鲁菌(Brucella),再将转化后的pWal-GFP-Brucella侵染已经标记溶酶体红色荧光探针(Lyso-Tracker Red)的RAW264.7细胞,用激光共聚焦显微镜观察布鲁菌和溶酶体共定位,由于没有稳定的细胞系,导致操作比较繁琐,费工费时,且很难开展后续工作[17]。随后本课题组又构建了稳定表达 GFP-LC3 的RAW264.7 细胞株[18]。但随着自噬进程的发展,GFP在酸性条件下会发生淬灭,不利于观察自噬溶酶体。mCherry以及其他大多数红色荧光蛋白都是从珊瑚中分离出来的,因其颜色和单体分子的光稳定性,比其他荧光蛋白标签更优异,可以补偿 GFP 的不足,mCherry-GFP-LC3Ⅱ 融合蛋白优于 GFP-LC3 融合蛋白。本试验旨在设计含有 mCherry-GFP-LC3Ⅱ 目的基因的重组慢病毒表达质粒,经慢病毒感染和嘌呤霉素抗性筛选得到纯度较高的能够稳定表达mCherry-GFP-LC3Ⅱ 融合蛋白的RAW264.7细胞株,并对布鲁菌M5疫苗株与自噬的关系进行了初步探讨。
1 材料与方法
1.1 材料RAW264.7细胞和293T细胞购自北纳生物公司;胎牛血清购自Gibco公司;pMD2.G 包装质粒和pspa×2.0 包装质粒购自权阳生物公司;无内毒素质粒大提试剂盒购自天根生化科技(北京)有限公司;LipofectamineTM2000购自赛默飞世尔科技公司;4%多聚甲醛固定液购自武汉博士德生物工程有限公司;聚凝胺(polybrene)、嘌呤霉素(puromycin)、雷帕霉素(rapamycin)和氨苄西林(ampicillin)均购自北京索莱宝科技有限公司;DH5α 感受态细胞和BL21(DE3)感受态细胞购自北京全式金生物技术(TransGen Biotech)有限公司。
1.2 方法
1.2.1mCherry-GFP-LC3Ⅱ 质粒的合成及验证 根据需求将含有 mCherry、GFP 和 LC3 Ⅱ基因的质粒序列送权阳生物公司进行合成。将合成的 mCherry-GFP-LC3Ⅱ 质粒转化至 DH5α 感受态细胞中,并涂布于含ampicillin抗性的 LB 固体培养板上,倒置于37℃恒温培养箱中培养。次日挑取单个克隆恒温摇床培养 2 h,送至上海生工有限公司测序。将测序正确的重组质粒转化至大肠杆菌 BL21(DE3)感受态细胞,恒温摇床培养 6 h,甘油和菌1∶1的比例进行保菌。按照天根无内毒素大提试剂盒说明书操作步骤提取mCherry-GFP-LC3Ⅱ的质粒,并测定其浓度。
1.2.2慢病毒的包装和浓缩 用含有10%胎牛血清的 DMEM 细胞培养液培养 293T 细胞,转染前1 d,将 293T 细胞传代至 10 cm 细胞培养板中,当细胞密度达到 60%~70%时进行转染,转染前将细胞用 PBS 漂洗 3 次,换为无血清的 DMEM 完全培养液。放入细胞培养箱中平衡1 h,按照 LipofectamineTM2000 操作说明书, 将质粒 pMD2.G、pspa×2.0、mCherry-GFP-LC3Ⅱ 按 1∶1∶1 的比例共转染 293T 细胞。48 h后在倒置荧光显微镜下观察其转染效率,并分别于转染后48,72 h收集细胞上清,用 0.45 μm 的滤膜过滤后用超滤管中进行浓缩,冻存于-80℃冰箱。注意避免反复冻融,否则会影响病毒的滴度。
1.2.3稳定表达mCherry-GFP-LC3Ⅱ 的 RAW264.7细胞株的构建及筛选 将状态良好的 RAW264.7 细胞接种到 12 孔细胞培养板中,每孔细胞数为 1×105个。感染前,从-80℃冰箱取出病毒并在冰上缓慢融化,吸弃细胞培养液,用 PBS 漂洗 3 次,将病毒原液与 1/2 体积新鲜培养液混匀加入细胞中,并加入 8 mg/L polybrene 用以提高感染效率。感染后 5 h 补齐培养液至正常体积,并于感染后 24 h 换液,继续37℃、5% CO2培养。感染后 48 h,可通过倒置荧光显微镜观察 mCherry 和 GFP 的感染效率。72 h 后换含有 2 mg/L 的 puromycin新鲜完全培养液,筛选稳定传代的细胞株。
1.2.4自噬模型的验证 将获得的mCherry-GFP-LC3Ⅱ-RAW246.7细胞株以1×105个/孔均匀地铺于激光共聚焦细胞培养皿中,分别加入 rapamycin (100 nmol/L)、 DMSO (1/10 000)和 EBSS(2 mL)饥饿培养液处理4 h,PBS 漂洗 3 次后,加入 4%多聚甲醛固定液室温固定 15 min。吸弃固定液,PBS 漂洗 3 次,加入 200 μL PBS 使细胞保持湿润,在激光共聚焦显微镜下观察自噬进程并照相,对 mCherry-GFP-LC3Ⅱ 的阳性点数进行统计。
1.2.5布鲁菌M5疫苗株侵染后自噬特异性标签 mCherry-GFP-LC3Ⅱ puncta 的分布 将获得的mCherry-GFP-LC3Ⅱ-RAW246.7细胞株以1×105个/孔均匀地铺于激光共聚焦细胞培养皿中,分别加入M5疫苗株(MOI=100)、rapamycin (100 nmol/L)和 DMSO(1/10 000)处理细胞 4 h,PBS 漂洗 3 次,加入 4%多聚甲醛固定液室温固定细胞 15 min。吸弃固定液,PBS 漂洗 3 次,加入 200 μL PBS 使细胞保持湿润,激光共聚焦显微镜观察并照相,对 mCherry-GFP-LC3Ⅱ 的阳性点数进行统计。
2 结果
2.1 慢病毒的包装及浓缩慢病毒包装质粒(mCherry-GFP-LC3Ⅱ、pMD2.G 和 pspa×2.0)共转染 293T 细胞后 24 h, 在倒置荧光显微镜(明场)观察发现 293T 细胞生成状态良好,且高效表达 mCherry 和 GFP 荧光(图 1),说明慢病毒包装成功。收集细胞上清中的病毒进行浓缩,检测其病毒滴度为 1×109TU/mL。

图1 倒置荧光显微镜下 293T 细胞转染效果及 mCherry 和 GFP 在 mCherry-GFPLC3Ⅱ-RAW246.7 细胞中的表达(200×)
2.2 mCherry-GFP-LC3Ⅱ-RAW246.7 细胞株的构建及筛选浓缩的病毒与 RAW246.7 细胞共孵育48 h 后,通过倒置荧光显微镜(明场)可观察到细胞生长状态良好,且高效表达 mCherry 和 GFP 荧光,经 puromycin 筛选后用流式细胞仪检测mCherry-GFP-LC3Ⅱ-RAW246.7阳性细胞率,结果显示,无荧光细胞占比0%,mCherry-GFP细胞占比92.1%;GFP细胞占比7.3%;mCherry细胞占比0.6%(图2,3)。说明成功获得了稳定传代且纯度较高的 mCherry-GFP-LC3Ⅱ-RAW246.7细胞株。

图2 荧光显微镜下mCherry、GFP 在mCherry-GFP-LC3Ⅱ-RAW246.7细胞中的表达(200×)
2.3 自噬模型的验证根据mCherry-GFP-LC3Ⅱ puncta 的分布随机选择 10 个经 rapamycin、DMSO和 EBSS 饥饿培养液处理的细胞视野,通过激光共聚焦显微镜观察,结果如图4 所示,经DMSO 处理的对照组中黄色荧光较少,且处于弥散状态,而经 rapamycin和 EBSS 饥饿培养液处理的细胞中黄色荧光大量聚集,表明自噬形成增多,由于自噬体与溶酶体融合导致GFP淬灭,使自噬小体进入第二阶段(融合阶段)。
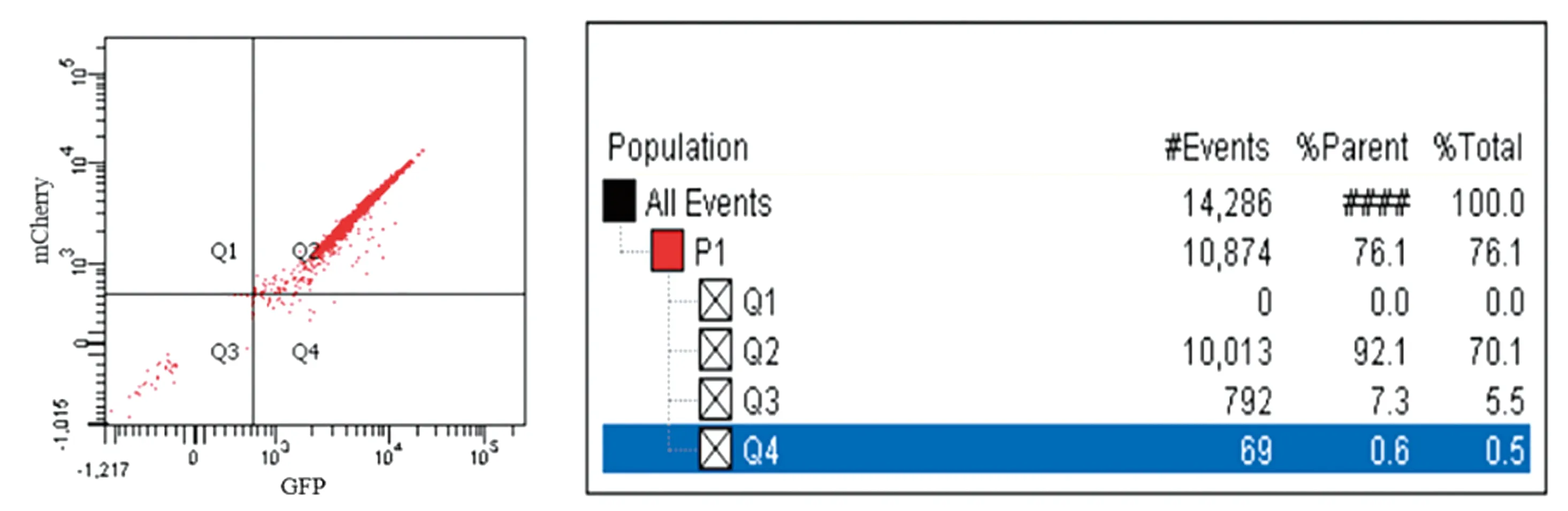
Q1.无荧光细胞区;Q2.mCherry-GFP细胞区域;Q3.GFP细胞区域;Q4.mCherry细胞区域

图4 激光共聚焦显微镜观察 mCherry-GFP-LC3Ⅱ puncta 的分布
2.4 布鲁菌M5疫苗株侵染后自噬特异性标签 mCherry-GFP-LC3Ⅱ puncta 的分布随机选择 10 个经EBSS 饥饿培养液、布鲁菌M5 疫苗株和DMSO处理的对照组细胞视野,通过激光共聚焦显微镜观察,结果如图 5 所示,与对照组相比,mCherry-GFP-LC3Ⅱ-RAW264.7经EBSS饥饿培养液和布鲁菌 M5疫苗株处理后,黄色荧光大量聚集,即mCherry-GFP-LC3Ⅱ puncta 较多,提示布鲁菌 M5疫苗株可促进自噬小体与溶酶体结合,促进细胞自噬进程。

图5 激光共聚焦显微镜观察布鲁菌M5 侵染后mCherry-GFP-LC3Ⅱ puncta 的分布
3 讨论
自噬过程主要由几个连续的步骤组成:外界刺激(主要因素有饥饿和一些病原微生物的侵袭)、转运至溶酶体、降解、降解产物的重吸收和利用,每一个步骤都非常复杂和相互关联[19-21]。运用 LC3 在自噬形成过程中能发生聚集的原理,开发出 GFP-LC3 指示技术:无自噬时,GFP-LC3 融合蛋白弥散在胞浆;自噬形成时,GFP-LC3 融合蛋白转位至自噬体膜,且在荧光显微镜下可以观察到多个明亮的绿色荧光斑点,一个斑点就相当于一个自噬体,研究人员可以通过计数斑点来评价自噬活性的高低[22-24]。由于 GFP 是一种酸性敏感蛋白,在酸性环境下会发生淬灭,因而本试验构建了 mCherry-GFP-LC3Ⅱ 双荧光自噬标记体系,用于标记及和追踪 LC3 以及自噬流的变化[25-27]。 自噬经历了吞噬泡、自噬小体和自噬溶酶体3个过程,当自噬小体进入第二阶段后,与溶酶体进行融合,即可形成自噬溶酶体[28-31]。自噬溶酶体由于其内部呈酸性,可导致 GFP 淬灭,因此,GFP 的弱化可指示自噬溶酶体形成的程度,GFP 越少,说明从自噬小体到自噬溶酶体阶段流通得越顺畅。反之,则说明自噬小体和溶酶体融合被抑制,即自噬溶酶体进程受阻。mCherry 自始至终都可以稳定表达,因而研究人员能够通过 GFP 与 mCherry 的亮点比例来评价自噬流的进程。
本试验通过慢病毒包装的方式获得了含 GFP 与 mCherry 荧光双标的病毒,并用其感染RAW264.7,经 puromycin 筛选后,成功获得了可稳定传代的mCherry-GFP-LC3Ⅱ-RAW246.7细胞株。分别用rapamycin、EBSS饥饿培养液、布鲁菌 M5疫苗株 和 DMSO 处理 mCherry-GFP-LC3Ⅱ-RAW246.7 细胞,在激光共聚焦显微镜下观察自噬斑点的形成,结果发现,经 rapamycin、EBSS饥饿培养液和布鲁菌 M5疫苗株处理后的 mCherryGFP-LC3-RAW246.7 细胞绿色荧光斑点和红色荧光斑点均明显多于 DMSO 处理组。本试验中,分别随机拍摄了 mCherry 和 GFP 荧光自噬性斑点,并用AimImageExaminer作图软件将其合并,显示黄色的斑点代表自噬体,显示红色的斑点代表自噬溶酶体,可更为准确、清晰和直观的观察自噬发生过程。
本课题组前期使用布鲁菌16M侵染RAW246.7细胞,对布鲁菌16M与自噬的关系进行了探讨,发现布鲁菌16M能够激活巨噬细胞自噬途径[16],而本试验选用的布鲁菌M5疫苗株是由布鲁菌16M反复传代致弱后的疫苗株,本试验首次使用mCherryGFP-LC3-RAW246.7细胞株探讨了布鲁菌M5疫苗株和自噬的关系,发现和布鲁菌16M一样,布鲁菌M5疫苗株也能激活巨噬细胞自噬途径。在其他病原菌如结核杆菌甚至肿瘤上等都已有使用该细胞株进行自噬机制相关的研究。尽管自噬的发现已将近 60 年,但细菌引起自噬的机制、自噬在固有免疫和获得性免疫中与细菌的相互作用以及这些过程中的信号通路及信号旁路等问题还有待进一步研究。本试验成功获得了纯度较高的 mCherry-GFP-LC3Ⅱ-RAW246.7 细胞株,可为病原微生物引起的自噬机制研究提供可靠的细胞平台。
