蜱传脑炎病毒E蛋白D Ⅲ的表达与抗体间接ELISA检测方法的建立
2022-06-17张梦瑶焦翠翠金宏丽白玉洁龚志远宋雨濛李媛媛张海丽王化磊
张梦瑶,焦翠翠,黄 培,金宏丽,白玉洁,龚志远,宋雨濛,李媛媛,张海丽,王化磊
(吉林大学动物医学学院 人兽共患病研究教育部重点实验室,吉林 长春 130062)
蜱传脑炎(tick-borne encephalitis,TBE)又称森林脑炎,是由蜱传脑炎病毒(tick-borne encephalitis virus,TBEV)引起的一种以中枢系统疾病为主的人兽共患传染病,临床上表现为脑膜炎、脑炎伴或不伴脊髓炎,可导致死亡或长期的神经系统并发症[1-2],严重危害人类健康和公共卫生安全。TBE主要在欧、亚地区流行,俄罗斯每年报告的人类感染病例1万~1.5万,欧洲每年报告的病例超过1.25万例[3]。大多数蜱传脑炎病例发生于生活或工作在森林中的人员,在中欧和东欧的许多山林地区,TBE发病率远高于所有其他中枢神经系统病毒感染的总和[4]。TBEV在自然界循环于蜱和野生动物之间,蜱是主要的传播媒介,此外,TBEV还可通过食用来自受感染牲畜的未经巴氏灭菌的奶制品传染给人和动物[5]。由于感染季节的延长和流行地区的扩大,TBE的发病率正在逐年增加[6]。1943年我国发现首例人类感染病例,1952年首次分离到TBEV[7]。近年来,我国TBEV的感染人数显著增加,一些以前未受感染的地区也发现了TBEV的存在,如云南、新疆、青海和西藏等[8-11]。目前,尚没有针对TBE的特效药物,临床治疗仍以缓解症状为主[12-13]。
TBEV E蛋白为包膜蛋白,是一个Ⅱ级融合蛋白,在病毒粒子的组装、出芽、病毒囊膜和宿主细胞膜融合过程中发挥着关键作用。E蛋白由3个结构域(DomainsⅠ,Ⅱ,Ⅲ)、1个茎区和1段跨膜域构成,茎区和疏水的锚定区形成E蛋白碳端第4个结构域(Domains Ⅳ)。Domain Ⅲ由约100个氨基酸残基构成,位于病毒颗粒表面,折叠形成一个IgG样结构,包含了E蛋白最重要的中和抗体表位,该结构能有效阻止E蛋白在pH诱导下产生构象变化,使E蛋白无法与抗体结合[14-15]。因此,E蛋白Domain Ⅲ是TBEV检测、免疫预防和药物研发的主要靶点。
1 材料与方法
1.1 质粒与菌株原核表达载体pET-30a(+)、TBEV E基因重组质粒、Stellar和大肠杆菌BL21(DE3)感受态细胞等均由吉林大学人兽共患病研究教育部重点实验室病毒病研究室构建和保存。
1.2 主要试剂2×PhantaMaxMaster Mix(含DNA聚合酶)购自南京诺唯赞生物科技有限公司,限制性核酸内切酶、BCA蛋白浓度测定试剂盒、小鼠抗His单克隆抗体均购自美国Thermo公司,Ni-NTA Agarose纯化柱购自德国QIAGEN公司。HRP 标记山羊抗小鼠IgG和山羊抗兔IgG为美国Bio-world 公司产品。TMB显色液、卡那霉素均购自北京索莱宝科技有限公司。TBEV阳性兔血清系利用昆虫细胞/杆状病毒表达系统表达的TBEV-prME蛋白免疫健康家兔所得;TBEV、JEV、ZIKV和WNV阳性鼠血清由纯化的病毒样颗粒免疫健康小鼠制备;TBEV病毒样颗粒(TBEV VLPs)由本实验室利用昆虫细胞/杆状病毒表达系统制备。
1.3 引物的设计与合成根据GenBank中公布的TBEV基因序列,选择远东亚型毒株WH2012(GenBank:KJ755186),合成E蛋白基因序列。根据E蛋白Domain Ⅲ基因序列,分别设计上游引物TBEV-E-D Ⅲ-F:5′-TAAGAAGGAGATATATACA-TATGAAAGGCCTGACCTACACCATG-T-3′(下划线部分为NdeⅠ 酶切位点)和下游引物TBEV-E-D Ⅲ-R:5′-GTGGTGGTGGTGGTGCTC-GAGTTTCTGGAACCACTGGTGGC-3′(下划线部分为XhoⅠ 酶切位点),由生工生物工程(上海)股份有限公司合成。
1.4 目的基因扩增以合成质粒TBEV-E为模板,TBEV-E-D Ⅲ-F和TBEV-E-D Ⅲ-R为引物,通过PCR扩增TBEV E Domain Ⅲ基因。反应体系为:2×PhantaMaxMaster Mix 25 μL,模板0.5 μL,上、下游引物(20 μmol/L)各1 μL,ddH2O 22.5 μL。扩增条件为:95℃ 3 min;95℃ 15 s,65℃ 15 s,72℃ 20 s,5个循环;95℃ 15 s,55℃ 15 s,72℃ 20 s,30个循环;72℃ 5 min。PCR产物经1.5%琼脂糖凝胶电泳鉴定正确后,回收目的基因条带。
1.5 重组质粒的构建及鉴定将原核表达载体pET-30a(+)经NdeⅠ 和XhoⅠ 双酶切,回收pET-30a(+)载体片段。将回收的pET-30a(+)载体片段与胶回收的TBEV E Domain Ⅲ基因PCR产物按一定比例混合,50℃连接20 min。连接产物转化至Stellar感受态细胞,挑取单克隆,经双酶切鉴定正确后进行序列测定分析。将鉴定正确的重组质粒命名为pET-30a(+)-TBEV-E-D Ⅲ,并将重组质粒转化至大肠杆菌BL21(DE3)构建重组表达菌株。
1.6 目的蛋白Western blot检测将构建的重组表达菌株和pET-30a(+)空载体菌株分别接种于含卡那霉素的LB培养基中,37℃摇菌培养至D600 nm处于0.6~0.8时,加入0.4 mmol/L IPTG,37℃诱导表达5 h,对未诱导的pET-30a(+)空载体、诱导的pET-30a(+)空载体、未诱导的重组菌和诱导的重组菌进行Western blot鉴定,确定目的蛋白是否成功表达。
1.7 重组菌株最佳表达条件与目的蛋白表达形式的确定将构建的重组表达菌株接种于含卡那霉素的LB培养基中,37℃摇菌培养至D600 nm处于0.6~0.8时,分别进行温度、IPTG浓度、时间等表达条件的优化[16]。将不同表达条件下收获的样品进行SDS-PAGE分析,确定重组菌株最佳表达条件。将最佳表达条件下培养的菌液4℃、12 000 r/min离心2 min,用溶菌酶重悬沉淀,室温下裂解30 min,4℃、12 000 r/min离心2 min,取出上清,用PBS重悬沉淀,将菌体上清、裂解上清和裂解后沉淀进行SDS-PAGE分析,确定重组蛋白的表达形式。
1.7.1温度 加入0.4 mmol/L的诱导剂IPTG,分别在16,25,30,37℃条件下诱导表达5 h。
1.7.2IPTG 加入不同浓度的IPTG(0,0.2,0.4,0.6,0.8,1.0,1.2,1.5,2.0 mmol/L),在37℃条件下诱导表达5 h。
1.7.3时间 加入0.4 mmol/L的IPTG,37℃条件下,分别诱导0,1,2,3,4,5,6,7,8 h。
1.8 目的蛋白的纯化在最佳表达条件下进行重组菌的大量增殖,4℃、8 000 r/min离心15 min收获菌体沉淀,超声破碎直至溶液澄清(冰上120 W超声破碎30 min)。将裂解的溶液经4℃、12 000 r/min离心15 min收集上清液,与His-Ni柱填料4℃结合过夜,按试剂盒说明书进行目的蛋白的纯化。纯化后的蛋白以SDS-PAGE进行鉴定,并用BCA方法测定蛋白浓度,分装后―80℃保存备用。
1.9 TBEV抗体间接ELISA检测方法的建立参考文献[17],按照棋盘滴定法分别探索重组蛋白包被质量浓度(0.1,0.5,1.0,5.0,10.0 mg/L)、待检血清最佳反应时间(0.5,1.0,1.5,2.0 h)、酶标二抗工作浓度(1∶5 000,1∶10 000,1∶20 000,1∶40 000)和孵育时间(0.5,1.0,1.5,2.0 h)等条件。用酶标仪测定D450 nm值,并计算P/N(检测值/阴性对照值)。P/N值≥2.1为阳性,比值最大时为最佳ELISA反应条件。
1.10 特异性与敏感性试验用建立的TBEV抗体间接ELISA方法分别检测TBEV、JEV、ZIKV和WNV阳性血清,评价该检测方法的特异性。将TBEV阳性兔血清分别按1∶800,1∶1 600,1∶3 200,1∶6 400,1∶16 800比例稀释后进行检测,评价该方法的敏感性。
1.11 重复性试验将同一批次纯化的重组蛋白TBEV E-D Ⅲ分别包被酶标板,建立TBEV抗体间接ELISA检测方法(3次),对不同的TBEV阳性血清(利用昆虫细胞/杆状病毒表达系统表达的TBEV-prME蛋白免疫健康家兔,第4,5,6次免疫后采取的血清)进行检测,每份样品重复4孔,判定批内重复性;分别以3个批次纯化的重组蛋白TBEV E-D Ⅲ包被酶标板,用建立的TBEV抗体间接ELISA检测方法对不同的TBEV阳性血清进行检测,判定批间重复性。
1.12 TBEV抗体间接ELISA检测方法的初步应用将纯化的TBEV VLPs按20 μg/只免疫小鼠(n=7),每3周进行1次加强免疫,三免后4周采集小鼠血清,以建立的TBEV抗体间接ELISA检测方法对小鼠血清进行TBEV抗体效价检测。
2 结果
2.1 重组质粒的构建与鉴定将PCR扩增后的TBEV E-D Ⅲ基因产物以琼脂糖凝胶电泳进行分析,结果显示在321 bp处出现预期大小的条带,与TBEV E-D Ⅲ基因片段大小相符(图1A)。将扩增产物和双酶切后的pET-30a(+)载体片段进行连接,并将连接产物转化至Stellar感受态细胞。挑取单菌落提取重组质粒后经SmaⅠ、KpnⅠ双酶切进行鉴定(图1B),鉴定正确的重组质粒进行序列测定分析,结果显示其序列与合成的TBEV E-D Ⅲ基因序列同源性为100%,表明成功构建了含TBEV E-D Ⅲ基因的重组质粒,将其命名为pET-30a(+)-TBEV-E-D Ⅲ。
2.2 目的蛋白的表达将重组质粒pET-30a(+)-TBEV-E-D Ⅲ与空载体质粒分别转化至大肠杆菌BL21(DE3)感受态细胞,用IPTG进行目的蛋白的诱导表达。Western blot鉴定表达产物,结果显示在12 kDa处出现特异性蛋白条带,与预期蛋白大小一致,表明重组菌经IPTG诱导后可成功表达目的蛋白(图2)。
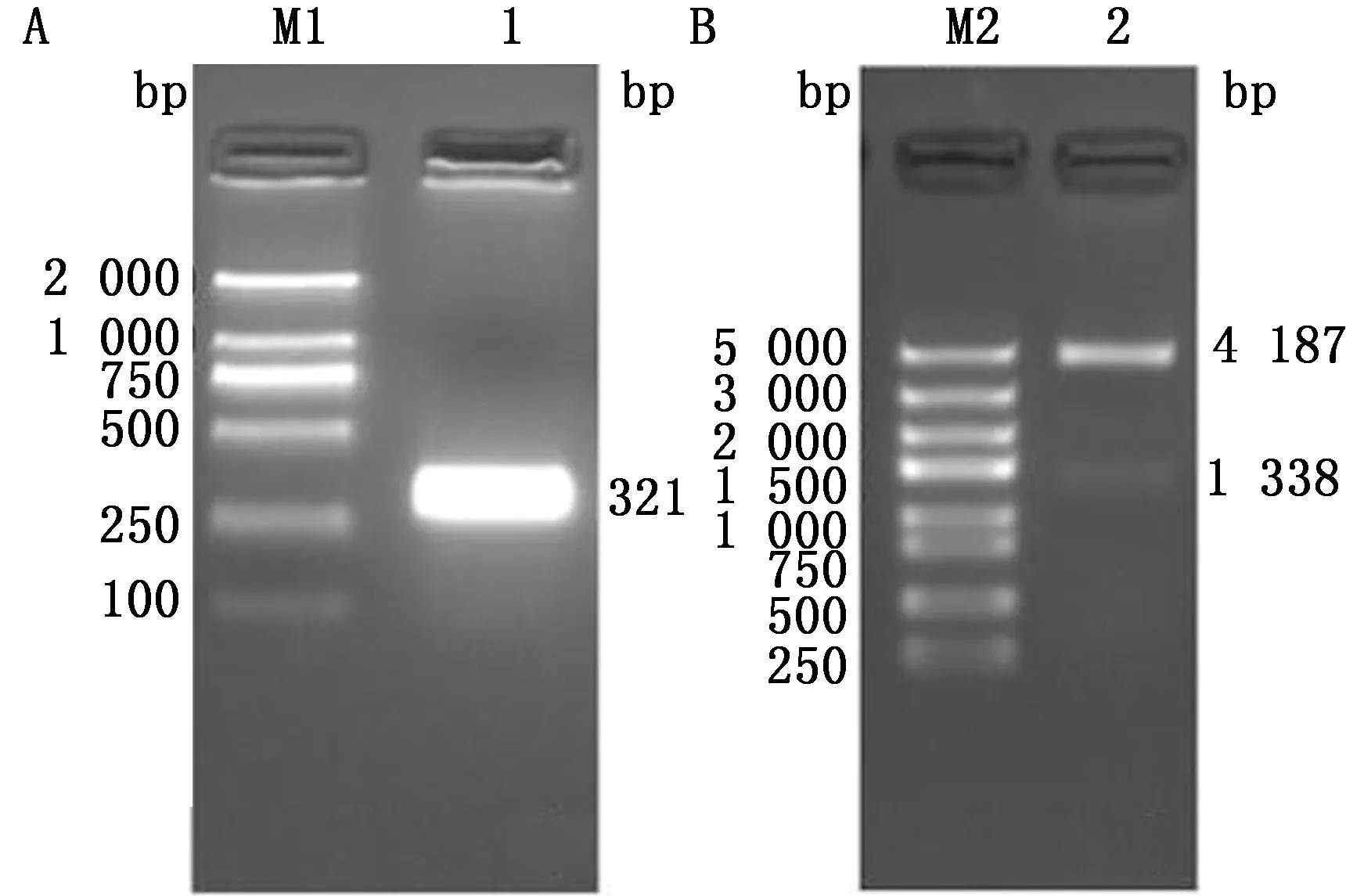
A.TBEV-E-D Ⅲ基因的PCR 扩增;B.重组质粒pET30a(+)-TBEV-E-D Ⅲ的鉴定。M1.DL2000 DNA Marker;1.TBEV-E-D Ⅲ基因的PCR扩增;M2.DL5000 DNA Marker;2.重组质粒的双酶切鉴定产物

M.蛋白Marker;1.IPTG诱导空载体;2.IPTG诱导重组菌;3.未诱导重组菌;4.未诱导空载体
2.3 目的蛋白的诱导表达及条件优化将重组菌株分别在不同温度(16,25,30,37℃)、不同浓度的IPTG(0~2 mmol/L),诱导不同时间(0~8 h)后,取样进行SDS-PAGE分析(图3,4,5)。本着“节约成本”原则,30℃、0.6 mmol/LIPTG诱导6 h为最佳蛋白诱导表达条件。

M.蛋白Marker;1~4.37,30,25,16℃诱导表达的重组菌

M.蛋白Marker;1~9.IPTG诱导0~8 h的重组菌

M.蛋白Marker;1~9.0,0.2,0.4,0.6,0.8,1.0,1.5,2.0 mmol/L IPTG诱导的重组菌
2.4 目的蛋白表达形式的鉴定将最佳表达条件下培养的菌液,经溶菌酶裂解,分别取菌液上清、裂解液上清、裂解后沉淀进行SDS-PAGE分析(图6),结果显示,目的蛋白主要以包涵体形式表达。
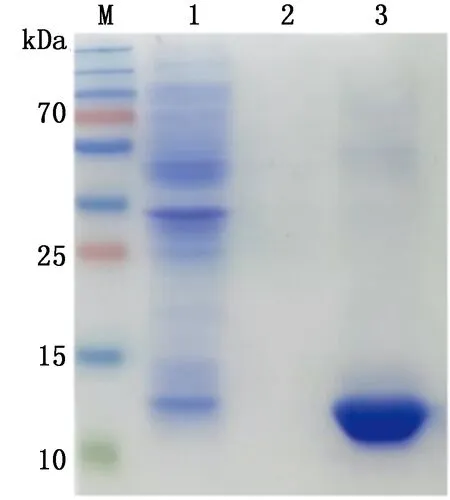
M.蛋白Marker;1.诱导后的重组菌裂解上清;2.诱导后的重组菌上清;3.诱导后的重组菌裂解沉淀
2.5 目的蛋白的纯化将诱导表达的重组蛋白以镍离子亲和层析柱进行纯化,纯化后的蛋白进行SDS-PAGE分析(图7),结果显示在12 kDa处出现单一的目的条带。
2.6 TBEV抗体间接ELISA检测方法的建立按照棋盘法进行TBEV抗体间接ELISA检测方法条件的优化,结果如表1,2,3所示,结合设定的优选原则:P/N值≥2.1为阳性,P/N比值最高。最终确定抗原的包被质量浓度为1 mg/L;一抗的孵育时间为0.5 h;酶标二抗的稀释度为1∶40 000,37℃孵育0.5 h。
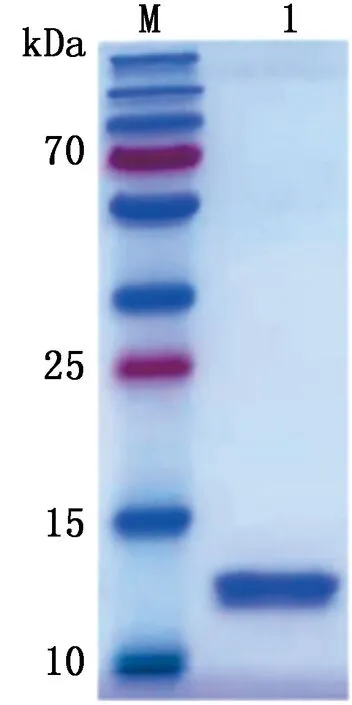
M.蛋白Marker;1.纯化后的重组蛋白TBEV E-D Ⅲ

表1 TBEV E-DⅢ蛋白包被量与血清稀释度

表2 一抗孵育时间
2.7 TBEV抗体间接ELISA检测方法的特异性和敏感性评价分别利用TBEV、JEV、WNV、ZIKV阳性血清评价所建立TBEV抗体间接ELISA检测方法的特异性(图8A),结果显示仅TBEV阳性血清的P/N值高于2.1为阳性,而JEV、WNV和ZIKV阳性血清检测的P/N值均低于2.1为阴性,表明该检测方法具有良好的特异性。将TBEV 阳性血清按1∶800,1∶1 600,1∶3 200,1∶6 400,1∶12 800进行稀释后,以建立的ELISA检测方法进行检测(图8B)。结果显示,当将TBEV阳性血清进行1∶12 800稀释时,检测结果仍为阳性(P/N= 2.24,大于2.1),表明该方法有良好的敏感性。

表3 酶标二抗稀释度和孵育时间

A.特异性检测;B.敏感性检测
2.8 重复性试验用同一批次纯化的重组蛋白TBEV E-D Ⅲ分别建立TBEV抗体间接ELISA检测方法,判定批内重复性;分别用3个批次纯化的重组蛋白TBEV E-D Ⅲ作为包被抗原建立检测方法,判定批间重复性。结果显示,3份TBEV阳性血清样本批内重复检测和批间重复检测的D450 nm值变异系数均低于10%,表明该ELISA方法具有良好的重复性(表4)。
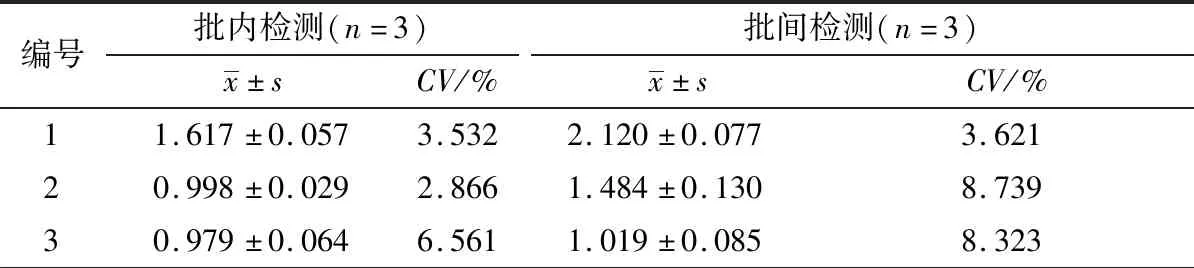
表4 TBEV抗体间接ELISA检测方法重复性试验检测结果
2.9 TBEV抗体间接ELISA检测方法的初步应用
将TBEV VLPs免疫小鼠血清进行2倍梯度稀释,应用建立的TBEV抗体间接ELISA检测方法测定血清TBEV IgG抗体水平。结果显示,TBEV VLPs免疫后小鼠血清中TBEV IgG平均抗体效价可达1∶40 960(n=7)(图9),表明该检测方法可用于血清TBEV IgG抗体水平检测。
3 讨论
近年来,TBEV在全球的流行趋势上升,疫源地不断扩大,且临床上仍没有特效救治药物[12-13,18-19],因此快速诊断和免疫预防显得尤为重要。根据基因型的不同TBEV可分为3种亚型:欧洲亚型、西伯利亚亚型和远东亚型,每一种亚型都可导致不同严重程度的临床疾病[8-9]。其中,远东亚型流行于俄罗斯、中国等地区,且毒力最强,病死率高达5%~20%,极易出现神经系统后遗症[20]。人和动物感染TBEV后,病毒血症存在的时间很短,PCR检测方法并不适用,血清学检测成为蜱传脑炎诊断的主要方法。目前,国外的TBEV检测方法多针对欧洲亚型和西伯利亚亚型[21],国内建立的针对远东亚型毒株的血清学检测方法多选用经典毒株“森张”株[22-23],该毒株于20世纪50年代分离,近年来在我国分离的TBEV流行毒株已与其有较大变异。本试验以2012年于我国分离的远东亚型毒株WH2012[24](GenBank:KJ755186)为对象,表达并纯化了E-D Ⅲ蛋白,同时建立了TBEV抗体间接ELISA检测方法,为我国蜱传脑炎的快速诊断和流行病学调查提供了技术手段。
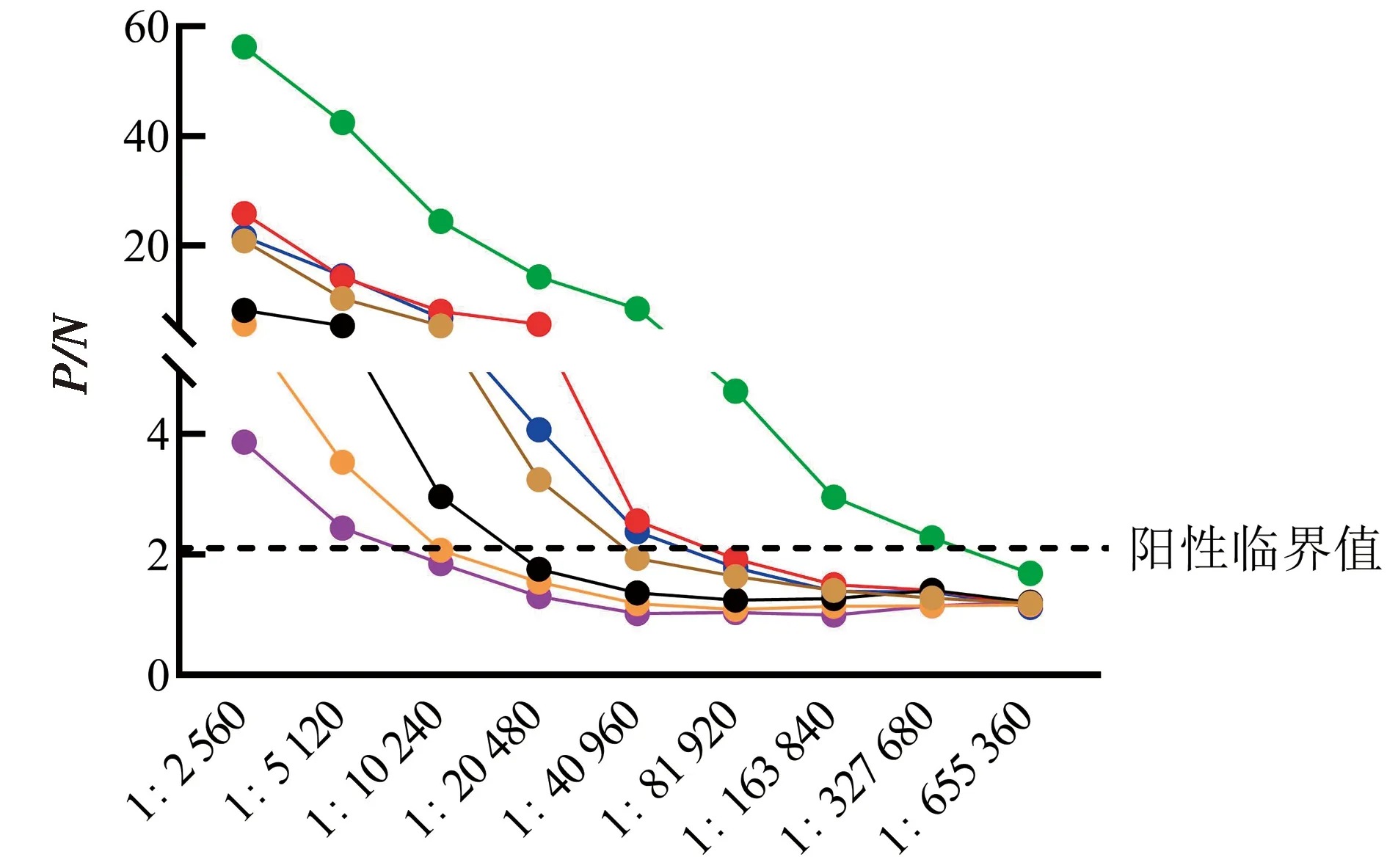
图9 TBEV抗体间接ELISA检测方法在血清TBEV IgG抗体水平检测中的应用
TBEV E蛋白作为包膜蛋白被广泛应用于蜱传脑炎的诊断和亚单位疫苗的研发,但由于黄病毒属病毒之间存在较强的抗体交叉反应,因此针对完整E蛋白的抗体检测方法容易出现假阳性。噬斑减少中和试验(PRNT)可以有效减少黄病毒间交叉反应引起的假阳性,但必须在生物安全3级(BSL-3)以上的实验室进行,极大的限制了临床检测的数量和效率[21]。E-D Ⅲ位于病毒粒子表面含有E蛋白的主要抗原表位,可诱导机体产生特异性中和抗体。HARRISON等[25]研究表明,黄病毒交叉反应性抗体大多是由E蛋白的DomainⅠ/Domain Ⅱ诱导产生。因此,E-D Ⅲ成为目前黄病毒疫苗开发和血清学检测的主要靶标。王丹等[22]建立了针对TBEV E-D Ⅲ的抗体间接ELISA方法,发现该方法可与TBEV患者阳性血清发生反应,证明TBEV E-D Ⅲ可作为TBEV特异性血清学检测的候选抗原。RIZZO等[26]研究发现,TBEV患者阳性血清既能识别原核表达的TBEV E蛋白,也能识别E-D Ⅲ蛋白,但E-D Ⅲ重组蛋白具有更高的特异性,且不与WNV阳性血清发生交叉反应,表明E-D Ⅲ能更好地识别黄病毒的特异性抗体。本试验利用纯化的TBEV E-D Ⅲ重组蛋白作为包被抗原建立的TBEV抗体间接ELISA检测方法,与JEV、WNV、ZIKV等黄病毒属病毒阳性血清均无交叉反应,进一步验证了TBEV E-D Ⅲ可作为蜱传脑炎血清学诊断的靶抗原。
大肠杆菌表达系统无法进行糖基化修饰,但成本低、易于培养、可高水平表达重组蛋白[16,22]。TBEV E蛋白唯一的糖基化位点(Asn154)位于Domain Ⅱ[14],YOSHII等[27]研究发现E蛋白糖基化缺失的TBEV能有效的诱导小鼠产生抗TBEV中和抗体,表明TBEV E蛋白糖基化的缺失不会影响抗原检测。ELISA方法具有灵敏、快速、简便和易于标准化等优点,且适合高通量检测,临床上以ELISA方法对血液样本进行抗体检测,可显著提高检测效率。在选择包被抗原时,重组蛋白比从病毒感染细胞中提取的抗原更加安全有效,且重组蛋白的来源简单,易于规模化生产[28]。本研究利用大肠杆菌表达系统表达重组蛋白TBEV E-D Ⅲ,并以不同批次纯化的重组蛋白作为包被抗原,检测了不同的TBEV阳性血清,结果显示,TBEV抗体间接ELISA检测方法具有良好的特异性、敏感性和重复性,可用于TBEV抗体的检测。
