lncRNA HULC对肝癌细胞miRNA差异表达谱及ceRNA调控网络的影响
2022-06-17关璐璐韩松峰李世朋王梦姣邵晓亚乔兵兵席守民
关璐璐, 韩松峰, 李世朋, 王梦姣, 邵晓亚, 乔兵兵, 席守民
肝细胞癌(hepatocellular carcinoma,HCC)是全球发病率排名第六,病死率排名第二的恶性肿瘤[1]。HCC细胞的侵袭、转移和复发是影响HCC治疗疗效的重要因素[2]。因此,挑选鉴定HCC侵袭和转移新靶点对于前期诊断、选择治疗方式及评估预后极为重要[3]。高通量RNA测序技术以高通量、低成本、高精确度[4]、信息量丰富等优点被广泛应用于白血病、乳腺癌[5]等疾病的临床研究,在追踪细胞谱系、揭露肿瘤细胞的异质性、探究肿瘤演变复杂机制的研究中发挥着重要作用[6]。肝癌高表达转录本(highly up-regulated in liver cancer,HULC)作为长链非编码RNA(long non-coding ribonucleic acids,lncRNAs)的一员[7],可促进肿瘤细胞生长[8]和血管的生成[9]。因此,异常表达的lncRNA HULC与HCC细胞的分化、增殖和侵袭功能相关[10]。关于lncRNA HULC对HCC细胞微小RNA(micro ribonucleic acid,miRNA)差异表达谱及竞争内源性RNA(competitive endogenous RNA,ceRNA)调控网络的影响研究较少。鉴此,本研究通过分析敲低lncRNA HULC,研究HCC的差异表达miRNA和ceRNA调控网络,探索其在HCC发生、发展过程中的作用和意义。现报道如下。
1 材料与方法
1.1材料
1.1.1 实验细胞 选择人HCC细胞株BEL-7402作为实验对象,购自丰晖生物科技有限公司。
1.1.2 主要试剂 LipofectamineTM2000转染试剂购自美国Invitrogen公司。高糖培养基DMEM购于CORNING公司。引物合成于上海生工有限公司。总RNA提取试剂盒购于上海Promega公司。cDNA逆转录试剂盒购自Novoprotein公司。miRNA反转录试剂盒购自TaKaRa生物公司。
1.2方法
1.2.1 细胞培养及转染 使用含有10%胎牛血清和1%青链霉素双抗的DMEM培养基作为完全培养基对BEL-7402细胞进行培养,培养箱条件设置为37 ℃、5% CO2。根据LipofectamineTM2000转染试剂说明书,将siRNA[si-NC(对照组)和si-HULC(模型组)]转染至BEL-7402细胞。将非靶向siRNA(si-NC)作阴性对照转染至BEL-7402细胞。培养箱中孵育6 h,转染后更换新鲜培养液继续培养48 h。收集细胞备检。
1.2.2 miRNA高通量测序 对BEL-7402细胞进行前期处理,提取RNA,反转录成cDNA,PCR扩增,经文库质检后上机测序。并对测序的质量进行评估,以得到高质量数据。上机测序由上海生工公司进行。通过DESeq2网站对有差异表达的miRNA进行基因集合(Gene Ontology,GO)分析,通过miRDeep2软件对新miRNA进行预测。
1.2.3 实时荧光定量PCR 提取BEL-7402细胞的总RNA,应用逆转录试剂盒将所得总RNA逆转录为cDNA,通过实时荧光定量PCR检测lncRNA HULC及目的miRNA的表达,引物序列见表1。实时荧光定量PCR反应体系为20 μl,其中cDNA按照1∶4稀释后取5 μl,2×SYBR预混合物10 μl,无RNA酶水5 μl,正、反向引物各0.4 μl。扩增实验条件:95 ℃ 5 min,95 ℃ 20 s,60 ℃ 40 s,扩增40个循环。以GAPDH和U6为内参,采用2-ΔΔCt法计算lncRNA HULC及miRNA的相对表达量。

表1 引物序列

2 结果
2.1细胞模型构建结果 实时荧光定量PCR结果显示,经转染si-HULC后,模型组lncRNA HULC的表达水平较对照组显著降低,提示细胞模型构建成功。见图1。

图1 两组HULC表达水平图
2.2差异表达miRNA的筛选及新miRNA预测结果 以P<0.05且|log2fold change|≥2为标准,挑选到具有显著表达差异的miRNA 9个。其中,表达水平显著升高的miRNA有4个,表达水平显著降低的miRNA有5个。见表2,图2。

表2 9个表达差异显著的miRNA

横向坐标为遗传因子在不同组样本间的差异性表达倍数fold change[log(B/A)]值,纵向坐标代表遗传因子表达量变化的统计显著性程度,P value越小,-log(P value)越大,差异越明显。图中的每个点分别代表一个遗传因子,其中红色表示遗传因子上调,绿色表示遗传因子下调,黑色表示非差异遗传因子
2.3实时荧光定量PCR验证差异miRNA表达结果 实时荧光定量PCR结果显示,所筛选得的差异miRNAs:hsa-let-7i-3p、hsa-miR-122-5p、hsa-miR-143-3p、hsa-miR-214-3p、hsa-miR-3200-5p、hsa-miR-34c-5p、hsa-miR-548q在两组间比较差异均有统计学意义(P<0.05)。见图3。

图3 实时荧光定量PCR验证差异miRNA表达图
2.4新miRNA预测结果 基于参考基因组,使用miRDeep2软件进行新miRNA预测,miRDeep2打分,分值越高结果越好。得分前15的新miRNA预测结果见表3。
2.5差异miRNA靶基因功能富集分析结果 结果显示,表达下调的miRNA的靶基因的分子功能与丝氨酸tRNA连接酶活性、蛋白激酶活性、阳离子通道活性、14-3-3蛋白结合、钙转运ATP酶活性等有关;表达上调的miRNA的靶基因与硒代半胱氨酸裂解酶活性、维生素B6结合、过氧化物酶体机制靶向信号1结合、镍阳离子结合、过氧化物酶体靶向序列结合、蛋白质N-末端结合、肿瘤坏死因子受体超家族结合等有关。见图4,5。
2.6miRNA-靶基因互作网络图 互作网络图结果显示,hsa-let-7i-3p分别与基因ENSG00000140368、ENSG00000132507、ENSG00000182606等7个基因之间存在互作关系。hsa-miR-122-5p分别与ENSG00000088876、ENSG00000137944、ENSG00000131899等7个基因之间存在互作关系。hsa-miR-143-3p与基因ENSG00000090863和ENSG00000115159之间存在互作关系。hsa-miR-214-3p分别与ENSG00000090863、ENSG00000115159、ENSG00000075340等34个基因之间存在互作关系。见图6。
2.7差异表达miRNA的靶基因功能富集关联分析结果 靶基因功能富集关联分析结果显示,GO:0021759功能富集程度高与差异miRNA的靶基因ENSG00000080815、ENSG00000139197、ENSG00000096093等关联性强。GO:0070588功能富集程度高与差异miRNA的靶基因ENSG00000196296、ENSG00000074370、ENSG00000155886等关联性强。见图7。

表3 新miRNA预测统计表
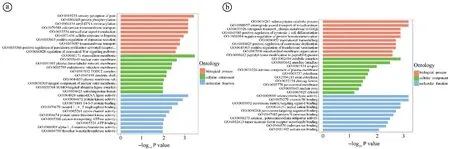
ⓐ表达下调miRNA;ⓑ表达上调miRNA。横向坐标为功能分类,纵向坐标为该分类内遗传因子数量(右)及其占被注释上遗传因子总数量的百分比(左)。不同功能分别采用颜色差异区分(蓝色:分子功能。绿色:细胞成分。红色:生物过程)。
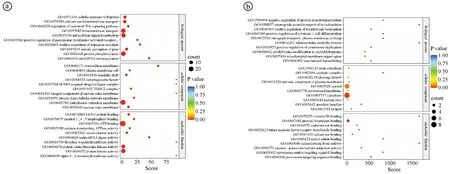
ⓐ表达下调的miRNA;ⓑ表达上调的miRNA。功能注释信息用纵向坐标表示,功能相对应的rich factor(注释到该功能的差异的遗传因子数目比注释到该功能的遗传因子数目)用横向坐标表示,用点的颜色来表示Q value的大小,颜色越接近红色表明Q value越小,用点的大小对每个功能所涵盖的差异的遗传因子的多少进行表示。
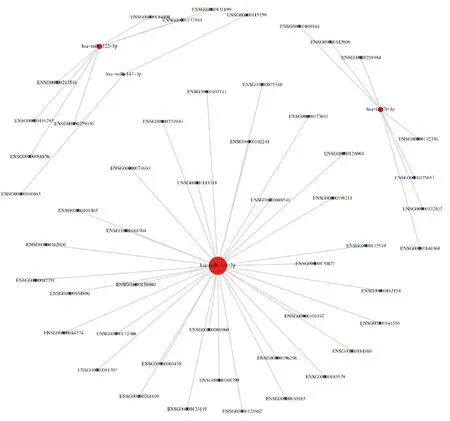
图中靶基因用方形节点表示,miRNA用圆形节点表示,靶基因与miRNA的关联性以边表示。节点的大小与该节点的度值(degree)呈正比,即节点越大,与此节点相连的边越多。

图中圆形节点为功能信息,边代表功能间的关联性。节点的颜色代表功能的富集程度即P value值,富集程度越高,P value值越低,相应颜色越深。
3 讨论
近年来研究显示,lncRNA已经成为研究生物标志物及治疗靶点的关键点[11]。有研究表明,在lncRNA、mRNA、miRNA组成的ceRNA网络中,lncRNA可充当ceRNAs网络的分子海绵[12]与miRNA互相通信,协同调节mRNA与其靶基因的表达[13]。lncRNA不仅在HCC中表达上调[14],在其他癌症如骨肉瘤[15]、鼻咽癌[16]、乳腺癌[17]和卵巢癌[18]等中也呈高表达。miRNA是内源性非编码单链小RNA[19],其与靶基因mRNA的3′端结合,导致其降解或抑制其翻译,完成对遗传因子转录后的调控[20]。本实验通过高通量测序对人HCC细胞系BEL-7402敲低lncRNA HULC后差异表达的miRNA进行分析,并预测新miRNA,对其靶基因富集进行GO分析。miRNA作为疾病生物标志物与疾病的发生具有高度关联性,hsa-let-7i-3p与结直肠癌的血清外泌体环桥粒相关蛋白(pinin,PNN)的表达呈负相关[21]。因此,提示hsa-let-7i-3p可能在肿瘤的发生、发展中发挥重要作用。在肝细胞中,hsa-miR-122-5p可以下调三酰基甘油(triacylglycerol,TAG)通路基因CTDNEP1[22]。并且,hsa-miR-122-5p/lncRNA X染色体特异性转录子(X-inactive specific transcript,XIST)路径可调节肾移植急性肾损伤中反沉默作用蛋白1A(anti-silencing function 1A,ASF1A)的表达。另外,有研究表明,hsa-miR-122-5p作为lncRNA XIST的分子海绵调节肾移植、急性肾损伤中组织ASF1A的表达[23]。有研究表明,环状RNA circCSNK1G3/hsa-miR-143-3p/同源椎基因A10(homeobox A10,HOXA10)路径可介导肺腺癌的发生发展[24]。lncRNA XIST结合hsa-miR-214-3p对上皮性卵巢癌细胞产生抗癌作用[25]。lncRNA HCP5在HCC中高表达,并通过miR-214-3p/肝癌衍生生长因子(hepatoma-derived growth factor,HDGF)路径参与吉西他滨耐药及细胞的增殖、侵袭和迁移过程[26]。因此,hsa-miR-214-3p在癌细胞的生物学功能方面发挥着重要作用。另外,miR-3200-5p在肺癌患者中高表达[27]。miR-3200-5p/乳腺癌转移抑制因子1(breast cancer metastasis suppressor 1,BRMS1)路径,在骨肉瘤的侵袭和转移方面具有重要意义[28]。hsa-miR-34a及hsa-miR-34b/c位点可被p53激活[29],在肿瘤中实现细胞周期停滞和细胞凋亡。前期这些研究进一步证实了本研究筛选的差异表达miRNA可影响肿瘤的侵袭和转移。但这些miRNA在HCC中的调控机制仍不明确,需要进一步研究。
综上所述,hsa-let-7i-3p、hsa-miR-122-5p、hsa-miR-143-3p、hsa-miR-214-3p、has-miR-3200-5p等对HCC的发生、增殖及转移可能具有调节作用,值得进一步深入探究。新预测的miRNA在今后的研究过程中更有提示意义。但由于本实验研究细胞种类有限,需进一步扩大样本量对结果进行验证。
