TNF-α对人骨髓间充质干细胞sncRNAs表达的调控研究
2022-06-17陆艳青彭建平王传东张晓玲
周 兴, 陆艳青, 彭建平, 王传东, 张晓玲
在类风湿性关节炎和强直性脊柱炎等慢性炎症性疾病中,骨破坏和骨丢失严重。近年来,不少研究表明免疫系统与骨代谢之间具有关联性[1],M2巨噬细胞、B细胞等可通过增强成骨分化或抑制破骨细胞分化成熟等方式来加强成骨[2-3]。相反,活化的T细胞可通过分泌一系列促炎性细胞因子,如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin-6,IL-6)等激活经典的破骨细胞活化通路,包括核因子-κB配体的受体激活剂(receptor activator for nuclear factor-κB ligand,RANKL)、Wnt/β-catenin等。促炎性细胞因子在炎症和骨质疏松之间起到中间介质作用,目前已经有很多研究以促炎性细胞因子TNF-α和IL-6作为靶点开发治疗骨代谢疾病的药物[2,4-6]。非编码RNA(non-coding RNAs,ncRNAs)可根据其长度分为长非编码RNA(long non-coding RNAs,lncRNAs)和非编码小RNA(small non-coding RNAs,sncRNAs)。lncRNAs的长度超过200个核苷酸,可包含数千个核苷酸。sncRNAs的长度<200个核苷酸,包括小干扰RNA(small interfering RNAs,siRNAs)、PIWI相互作用RNA(PIWI-interacting RNAs,piRNAs)、微小RNA(microRNA,miRNAs)、核仁小RNA(small nucleolar RNAs,snoRNAs)和核小RNA(small nuclear RNA,snRNAs)等[7]。目前,sncRNAs尤其是miRNAs在许多人类疾病中的作用已经得到了广泛验证。然而,目前尚未有研究报道TNF-α对人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hBMSCs)中sncRNAs的调控作用。本研究通过TNF-α刺激hBMSCs,利用高通量测序以及实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)分析TNF-α对hBMSCs中sncRNAs表达的影响。现报道如下。
1 材料与方法
1.1实验材料 DMEM高糖培养基购自Hyclone公司(#SH30081.01);胎牛血清(fetal bovine serum,FBS)购自BIOEXPLORER公司(#BN1630-149);人血小板裂解液购自以色列BI公司(# PLTGOLD050R);胰蛋白酶购自Gibco公司(#25200072);TNF-α细胞因子购自PeproTech公司(#315-01A);miRNAs加尾法试剂购自生工生物工程(上海)股份有限公司(# B532451-0020);实时荧光定量PCR相关试剂[TB Green® Premix Ex Taq(Tli RNaseH Plus)、PrimeScriptTMRT Master Mix]购自日本Takara公司(# RR420A、#RR036A)。
1.2hBMSCs分离和培养 选择2021年8月至2021年10月于上海交通大学医学院附属新华医院骨科接受手术治疗的先天性髋关节发育不良患者5例,均经骨盆正位片确诊。通过全骨髓血贴壁法分离、培养hBMSCs。从髂骨穿刺抽取骨髓血5~10 ml,立即加入肝素钠上下颠倒5次防止凝血,转移至10 cm培养皿中,加入完全培养基(含8% FBS、2%人血小板裂解物的高糖DMEM),细胞放置在培养箱(37 ℃、5% CO2)中进行培养,每3 d更换一次培养基。培养10 d左右即可获得原代hBMSCs。本项研究获得了医院伦理委员会的批准(批号:XHEC-C-2021-125-1),所取样本获得了捐赠者的知情同意。
1.3small RNAs测序 选择P2代hBMSCs,以2×105cells/孔接种于6孔板中,待细胞生长至70%融合后弃除旧的培养基。对照组继续加入完全培养基进行培养,TNF-α组加入含有10 ng/ml TNF-α的完全培养基进行培养,每组3个复孔。经干预24 h后弃去6孔板中的培养基,磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤2遍,每个孔加入1 ml TRIzol试剂裂解细胞,样品置于干冰保存,重复3次实验。所得样品送生工生物工程(上海)股份有限公司进行总RNA提取、建库和small RNAs测序。
1.4实时荧光定量PCR 应用TRIzol法提取hBMSCs总RNA,将RNA稀释至500 ng/μl。取2 μl RNA使用miRNAs加尾法试剂盒进行miRNAs和piRNAs逆转录。使用PrimeScriptTMRT Master Mix进行snoRNAs和snRNAs逆转录。使用TB Green® Premix Ex Taq(Tli RNaseH Plus)试剂在罗氏LightCycler 480仪上进行实时荧光定量PCR检测,miRNAs和piRNAs使用试剂盒中的U6作为内参,Universal R引物作为通用R引物;snoRNAs和snRNAs使用GAPDH作为内参。本实验选用的引物序列见表1。所有引物均在生工生物工程(上海)股份有限公司合成。进行3次独立实验,采用2-△△Ct法计算相对表达量。

表1 PCR所用引物序列
1.5统计学方法 应用SPSS22.0统计软件进行数据分析。使用Graphpad Prism 8.2.1软件作图。两组间计量资料比较采用成组t检验。在R软件(3.3.0)中,热图使用gplots函数绘制,MA图(M-versus-A plot)、Scatter图(Scatter plot)、火山图(Volcano plot)使用ggplot2函数绘制,主成分分析(principal component analysis,PCA)使用vegan函数绘制。P<0.05为差异有统计学意义。
2 结果
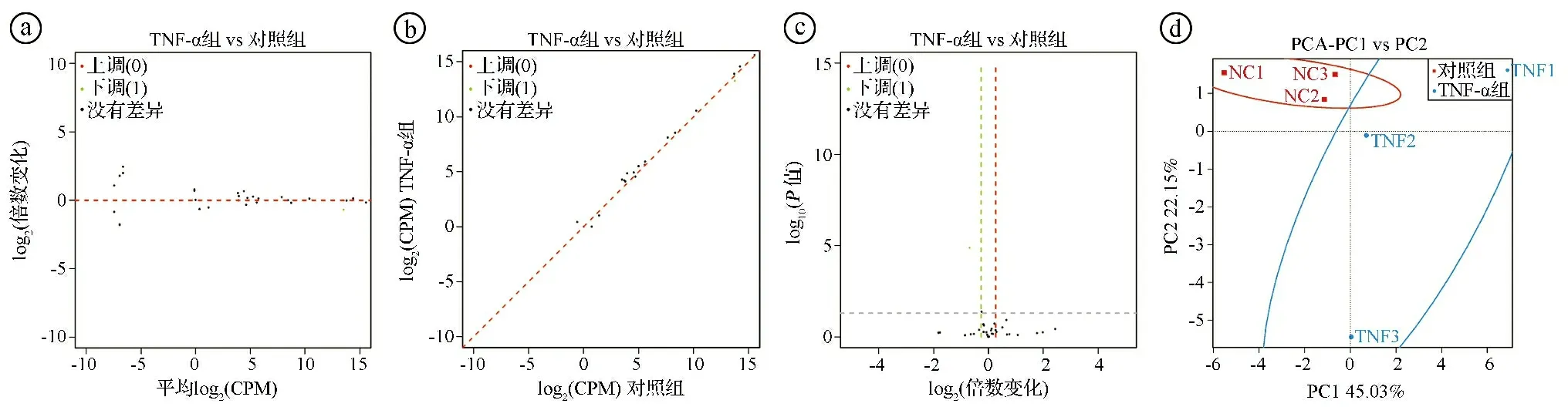
2.1TNF-α调控hBMSCs炎症状态下miRNAs的表达 small RNAs测序分析结果显示,与对照组相比,TNF-α组中miRNAs表达存在显著变化(见图1ⓐ)。MA图、Scatter图和火山图分析结果显示,与对照组相比,TNF-α组中有38个miRNAs表达显著上调,11个miRNAs表达显著下调(见图1ⓑ~ⓓ)。PCA结果显示,miRNAs的表达可以区分对照组和TNF-α组hBMSCs(见图1ⓔ)。选取测序结果有显著性差异的miRNAs进行PCR检测,结果显示,与对照组相比,在TNF-α组中hsa-miR-141-3p、hsa-miR-3065-5p、hsa-novel-155-mature、hsa-miR-27a-5p表达显著下降(P<0.05),而hsa-novel-170-mature、hsa-miR-155-5p、hsa-miR-1260a、hsa-novel-202-mature、hsa-novel-116-mature表达显著上升(P<0.05)(见图1ⓕ)。
2.2TNF-α调控hBMSCs炎症状态下piRNAs的表达 small RNAs测序分析结果显示,与对照组相比,TNF-α组中piRNAs表达存在显著变化(见图2ⓐ)。MA图、Scatter图和火山图分析结果显示,与对照组相比,TNF-α组中有25个piRNAs表达显著上调,有24个piRNAs表达显著下调(见图2ⓑ~ⓓ)。PCA结果显示,piRNAs的表达可以区分对照组和TNF-α组hBMSCs(见图2ⓔ)。选取有显著性差异的piRNAs进行PCR验证,结果显示,与对照组相比,TNF-α组DQ592932、DQ570992、DQ593325、DQ582827表达显著上升(见图2ⓕ)。
2.3TNF-α调控hBMSCs炎症状态下snoRNAs的表达 small RNAs测序分析结果显示,与对照组相比,TNF-α组中snoRNAs表达存在显著变化(见图3ⓐ)。MA图、Scatter图和火山图分析结果显示,与对照组相比,TNF-α组中有40个snoRNAs表达显著上调,有24个snoRNAs表达显著下调(见图3ⓑ~ⓓ)。PCA结果显示,snoRNAs的表达可以区分对照组和TNF-α组hBMSCs(见图3ⓔ)。选取有显著性差异的snoRNAs进行PCR验证,结果显示,与对照组相比,TNF-α组中SNORD14D、SNORD116-3、SNORA21、SNORD60、SNORD81、SNORD32A、SNORD117、SNORD2、SNORD1C、SNORD36B、SNORD4B、SNORA58、SNORA64表达显著下降(见图3ⓕ)。
2.4TNF-α调控hBMSCs炎症状态下snRNAs的表达 small RNAs测序分析结果显示,与对照组相比,TNF-α组中snRNAs表达存在显著变化(见图4ⓐ)。MA图、Scatter图和火山图分析结果显示,与对照组相比,TNF-α组中有5个snRNAs表达显著上调,有8个snRNAs表达显著下调(见图4ⓑ~ⓓ)。PCA结果显示,snRNAs的表达可以区分对照组和TNF-α组hBMSCs(见图4ⓔ)。选取有显著性差异的snRNAs进行PCR验证,结果显示,与对照组相比,TNF-α组NR_003137.2表达显著下降(见图4ⓕ)。

ⓐ热图分析结果;ⓑMA图分析结果;ⓒScatter图分析结果;ⓓ火山图分析结果;ⓔPCA结果;ⓕ实时荧光定量PCR检测结果,*P<0.05,***P<0.001。CPM:每百万计数(count-per-millon)

ⓐ热图分析结果;ⓑMA图分析结果;ⓒScatter图分析结果;ⓓ火山图分析结果;ⓔPCA结果;ⓕ实时荧光定量PCR检测结果,*P<0.05,**P<0.01,***P<0.001

ⓐ热图分析结果;ⓑMA图分析结果;ⓒScatter图分析结果;ⓓ火山图分析结果;ⓔPCA结果;ⓕ实时荧光定量PCR检测结果,*P<0.05,**P<0.01

ⓐ热图分析结果;ⓑMA图分析结果;ⓒScatter图分析结果;ⓓ火山图分析结果;ⓔPCA结果;ⓕ实时荧光定量PCR检测结果,**P<0.01
2.5TNF-α调控hBMSCs炎症状态下repeat RNAs的表达 根据small RNAs测序分析结果,MA图、Scatter图和火山图分析结果显示,与对照组相比,TNF-α组中有1个repeat RNA表达显著下调(见图5ⓐ~ⓒ)。PCA结果显示repeat RNAs的表达可以区分对照组和TNF-α组hBMSCs(见图5ⓓ)。
ⓐMA图分析结果;ⓑScatter图分析结果;ⓒ火山图分析结果;ⓓPCA结果
3 讨论
3.1在类风湿性关节炎、骨质疏松症等多种骨关节退行性疾病中,局部微环境中的炎症因子通过抑制成骨分化、促进破骨形成等多种途径加剧骨侵蚀破坏,进一步加重关节损伤程度[1,8]。炎症与骨重塑相关细胞如间充质干细胞、成骨细胞、破骨细胞等之间的相互作用和调控关系对于退行性骨病治疗策略的开发意义重大[9-10]。本研究主要关注了炎症刺激对于间充质干细胞的表观遗传学改变,尤其是sncRNAs表达水平的变化。间充质干细胞具有多项分化潜能并且是成骨的主要来源[11]。
3.2本研究应用高通量small RNAs测序技术分析4类sncRNAs表达水平的改变情况,并应用实时荧光定量PCR进行了验证。miRNAs是一类长度约为22个核苷酸片段的sncRNAs,主要通过和靶基因mRNA 3′-UTR区结合[12-13],导致mRNA降解或抑制mRNA转录后翻译,进而影响靶基因的蛋白表达水平。本研究结果显示,TNF-α可以抑制hsa-miR-27a-5p的表达,既往研究报道也显示骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)分泌的外泌体中富含hsa-miR-27a-5p,其可通过靶向自噬相关蛋白4同源物B(autophagy-related protein 4 homolog B,Atg4B)介导BMSCs自噬,促进BMSCs的成骨分化[14]。因此,认为TNF-α可能通过抑制BMSCs中hsa-miR-27a-5p的表达而抑制其成骨分化。miR-155-5p可通过抑制E26转录因子-1(E26 transformation specific-1,ETS-1)表达而降低牙周韧带干细胞的成骨分化[15-16]。本研究发现TNF-α可以促进miR-155-5p的表达,因此miR-155-5p可能参与了TNF-α对BMSCs成骨分化的调控。本研究也发现了TNF-α可以调控多个miRNAs的表达,并且测序结果预测了4个新的miRNAs:hsa-novel-170-mature、hsa-novel-155-mature、hsa-novel-202-mature、hsa-novel-116-mature。对于这些新的miRNAs目前尚未有研究报道其生物学功能,炎症刺激如何调控这些miRNAs而影响hBMSCs成骨分化需要通过后续的生物学实验进一步验证。
3.3piRNAs最早是从哺乳动物精子细胞中分离出来的一类长度为26~32个核苷酸片段的ncRNAs[17],可以与PIWI家族蛋白相互作用。随后的研究表明,piRNAs不只存在于生殖细胞中,在体细胞中也有广泛的表达[18-19]。然而,对于piRNAs的起源和功能目前还没有完全阐明,随着对piRNAs研究的深入,目前已有多个可用的数据库[20]。本研究结果显示TNF-α可以调控DQ592932、DQ570992、DQ593325、DQ582827的表达,其中DQ582827的表达显著性升高。由于目前还没有可靠的piRNAs功能预测软件,难以预测这些piRNAs的靶基因,对于炎症刺激后piRNAs的改变是否会影响hBMSCs成骨分化,以及其具体的作用机制还需要进一步研究。
3.4snoRNAs是一类主要分布在核仁的长度为60~300个核苷酸片段的sncRNAs,其主要的功能是调控核糖体RNA的修饰[21]。目前尚未有研究报道snoRNAs对hBMSCs成骨分化有直接调控作用。有研究报道snoRNAs宿主基因如SNHG16可通过调控骨形成蛋白7(bone morphogenetic protein 7,BMP7)的表达介导hBMSCs成骨分化[22],SNHG14通过调控miR-185-5p/WISP2信号通路促进hBMSCs成骨分化[23]。本研究结果显示,TNF-α刺激后hBMSCs中SNORD14D、SNORD116-3、SNORA21、SNORD60、SNORD81、SNORD32A、SNORD117、SNORD2、SNORD1C、SNORD36B、SNORD4B、SNORA58、SNORA64的表达显著下降,然而这些snoRNAs对BMSCs的表观遗传学修饰作用机制仍需进一步研究。此外,本研究还发现TNF-α参与调控多个snRNAs和repeat RNAs。但局限于目前piRNAs、snoRNAs、snRNAs、repeat RNAs等ncRNAs功能预测工具较少、数据库分类不统一,以及相应的生物学方法如过表达或敲低等还不成熟,其作用机制仍有待进一步验证,该领域的研究进展值得我们继续关注。
综上所述,本研究通过高通量small RNAs转录组学测序揭示了炎症因子TNF-α影响hBMSCs表观遗传学修饰中sncRNAs的表达。对于这些sncRNAs的研究将有助于更加深入地理解炎症因子动态调控hBMSCs分化的机制,为开发疾病治疗的新方法提供参考。
