用铁锰泥从废水中吸附去除Sb(Ⅲ)试验研究
2022-06-16袁雅姝张丽伟曹鹏宇
袁雅姝,张丽伟,曹鹏宇,王 薇,何 欢,王 东
(1.沈阳建筑大学 市政与环境工程学院,辽宁 沈阳 110168;2.沈阳水务集团,辽宁 沈阳 110000;3.海城市自来水有限公司,辽宁 海城 114200)
锑(Sb)具有剧毒性和致癌性,是全球公认的重金属污染物质。锑的存在形式受pH影响较大,毒性由价态决定,零价锑毒性最大,三价锑的毒性是五价锑的10倍多[1]。饮用水中锑的限定质量浓度为5 μg/L,工业废水排放限值为1.0 mg/L(《锡、锑、汞工业污染物排放标准》(GB 30770—2014))[2]。去除水中锑的方法有多种,吸附法因价格低、简单、快速、低能耗、高效和吸附剂可再生等优点而得到广泛应用[3-5]。以水热法制备的一种类似菊花的介孔α-FeOOH可用于从废水中吸附去除Sb(Ⅴ),其适用pH范围4.0~9.0,最大吸附量为102.67 mg/g,表面存在羟基结构与Sb(Ⅴ)配合,而且6次再生循环利用后Sb(Ⅴ)去除率约为80%[6]。Fe-Mn二元氧化物(FMBO)、氢氧化铁(FeOOH)和二氧化锰(MnO2)对Sb(Ⅲ)也有吸附去除性能[7],pH=3.0条件下,FMBO对Sb(Ⅲ)的最大吸附量可达1.76 mmol/g。氧化石墨烯(GO)及磁性四氧化三铁与氧化石墨烯的复合物(Fe3O4/GO)也可用于从废水中吸附去除Sb(Ⅲ),在pH为3.0~9.0范围内吸附效果较好,且Fe3O4/GO可用EDTA再生[8]。
含铁锰地下水在处理过程中会产生大量铁锰泥(IMP),其中富含大量铁锰氧化物,是一种铁基吸附材料,经过热处理后可用作重金属吸附材料。试验研究了用取自某水厂的铁锰泥作吸附剂从废水中吸附去除Sb(Ⅲ)。
1 试验部分
1.1 主要仪器与试剂
主要仪器:EL-104电子分析天平,BGZ-246电热鼓风干燥箱,马弗炉,BJ-260 pH计,Z-5000火焰原子吸收分光光度计,ASAP2020比表面积和微孔分析仪,Zeiss Sigma 300扫描电子显微镜,Thermo Scientific Nicolet iS20傅里叶红外光谱仪(FT-IR)。
试剂:Sb(Ⅲ)标准溶液(Sb(NO3)3·3H2O);盐酸,氢氧化钠,均为分析纯。
模拟水样:实验室配制。
1.2 IMP的预处理
IMP含水率40%~44%,于100 ℃电热鼓风干燥箱中烘干5 h,研磨过100目筛,置于马弗炉中于200 ℃下焙烧2 h,自然冷却后放入密封袋中保存。
1.3 Sb(Ⅲ)的吸附去除
1.3.1 IMP吸附去除Sb(Ⅲ)
模拟废水体积100 mL,Sb(Ⅲ)质量浓度20 mg/L,调节废水pH,加入适量IMP,在振荡速度100 r/min的恒温振荡箱中振荡吸附12 h,然后用0.45 μm微孔滤膜过滤,测定吸附后滤液中Sb(Ⅲ)质量浓度,计算Sb(Ⅲ)去除率。
1.3.2 吸附动力学
模拟废水体积50 mL,置于系列150 mL锥形瓶中,调pH=3.00,IMP投加量0.3 g/L,反应总时间48 h,恒温25 ℃,振荡速度100 r/min,反应不同时间时取样测定废水中Sb(Ⅲ)质量浓度,用动力学模型拟合试验数据。
1.3.3 吸附等温线
模拟废水体积50 mL,置于系列150 mL锥形瓶中,调Sb(Ⅲ)质量浓度,pH=3.00,IMP投加量0.3 g/L,不同温度下恒温振荡12 h,测定吸附后废水中Sb(Ⅲ)质量浓度,绘制吸附等温曲线。
1.3.4 IMP的表征
采用扫描电镜(SEM)、傅里叶红外光谱(FT-IR)和比表面积(BET)分析仪对吸附前、后的IMP进行表征,并分析吸附机制。
2 试验结果与讨论
2.1 IMP吸附去除Sb(Ⅲ)
2.1.1 IMP投加量对吸附去除Sb(Ⅲ)的影响
IMP投加量对吸附去除Sb(Ⅲ)的影响试验结果如图1所示。
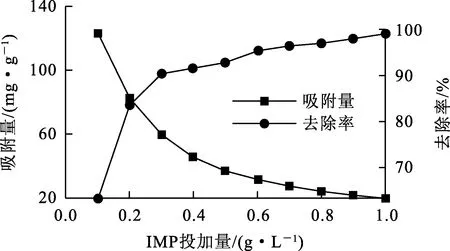
图1 IMP投加量对除Sb(Ⅲ)吸附去除的影响
由图1看出:随IMP投加量增大,Sb(Ⅲ)吸附去除率迅速升高。IMP投加量加大,吸附表面积增大,表面吸附活性位点增多,从而有利于提高吸附率;但IMP用量过大,会在瓶底积聚,致使其与溶液中的Sb(Ⅲ)接触面积减小,表面活性位点减少,对Sb(Ⅲ)的吸附去除率下降;吸附量逐渐变小是因为随IMP投加量增多,表面活性吸附位点过多,而Sb(Ⅲ)数量有限,所以IMP利用率相对降低,吸附量变小。综合考虑,确定IMP适宜投加量为0.3 g/L。
2.1.2 废水pH对IMP吸附去除Sb(Ⅲ)的影响
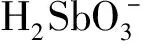
图2 废水pH对IMP吸附去除Sb(Ⅲ)的影响
IMP吸附Sb(Ⅲ)的适宜pH较低,为酸性条件,但此条件下铁、锰可能会溶出。表1是吸附前后废水pH的变化和铁、锰在不同pH下的溶出浓度。可以看出:吸附后溶液pH多为中性或弱碱性;pH>4条件下,几乎检测不到溶出的铁;pH>3,溶液中锰的量较少,因为氧化锰在酸性条件下溶出Mn2+,而随溶液pH升高溶出率下降[9]。试验针对的废水,铁、锰浓度均很低,综合考虑,确定IMP吸附去除Sb(Ⅲ)的适宜pH以3.0为宜。
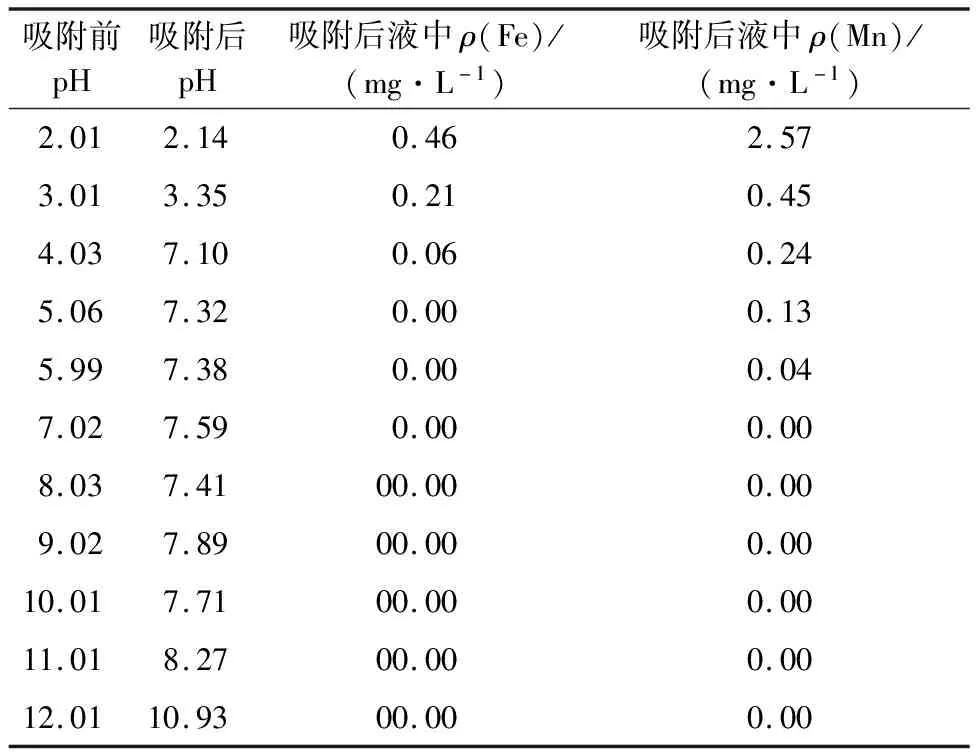
表1 不同pH条件下反应后液中的铁、锰质量浓度
2.1.3 温度对IMP吸附Sb(Ⅲ)的影响
温度对IMP吸附去除Sb(Ⅲ)的影响试验结果如图3所示。
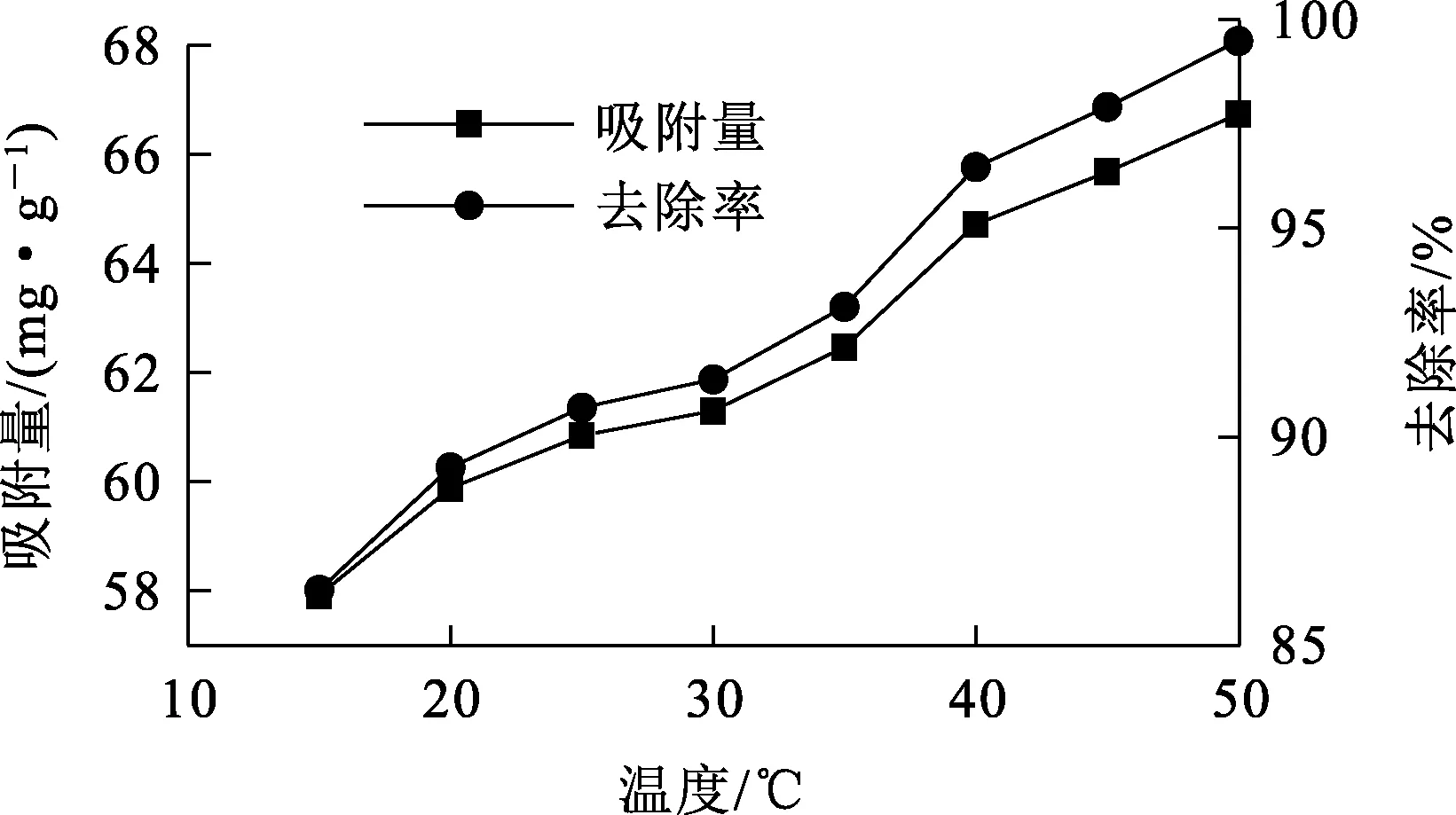
图3 温度对IMP吸附去除Sb(Ⅲ)的影响
由图3看出:温度低于25 ℃,Sb(Ⅲ)去除率在90%以下;随温度升至25 ℃以上,Sb(Ⅲ)去除率快速升高。温度升高,分子运动加剧,运动速率增大,传质推动力提高,Sb(Ⅲ)与IMP的活性位点接触更充分,吸附效果更好;也可判定,吸附反应为吸热反应。综合考虑,确定适宜温度为25~30 ℃。
2.2 吸附动力学
准一级、准二级动力学及颗粒扩散模型[10]可以根据吸附量和吸附时间的关系估算反应速率,进而推测反应机制。准一级动力学模型表明吸附是通过物理反应发生,准二级动力学模型表明吸附是通过共价键和离子交换等化学反应发生[11],颗粒内扩散模型用来分析吸附速率。模型的线性表达式分别为:
准一级动力学模型,
ln(qe-qt)=lnqe-k1t;
(1)
准二级动力学模型,
(2)
颗粒内扩散模型,
qt=kit1/2+a。
(3)
式中:qt—吸附t时间时的吸附量,mg/g;qe—吸附平衡后吸附量,mg/g;k1—准一级动力学吸附速率常数,min-1;k2—准二级动力学吸附速率常数,mg/(g·min);ki—颗粒内扩散模型吸附速率常数,mg/(g·min0.5);a—边界层厚度,a越大,边界层的影响越大。
以ln(qe-qt)与t/qt为纵坐标,t为横坐标,用origin2018软件绘图得到准一级和准二级动力学线性拟合曲线,如图4、5所示,拟合参数见表2。
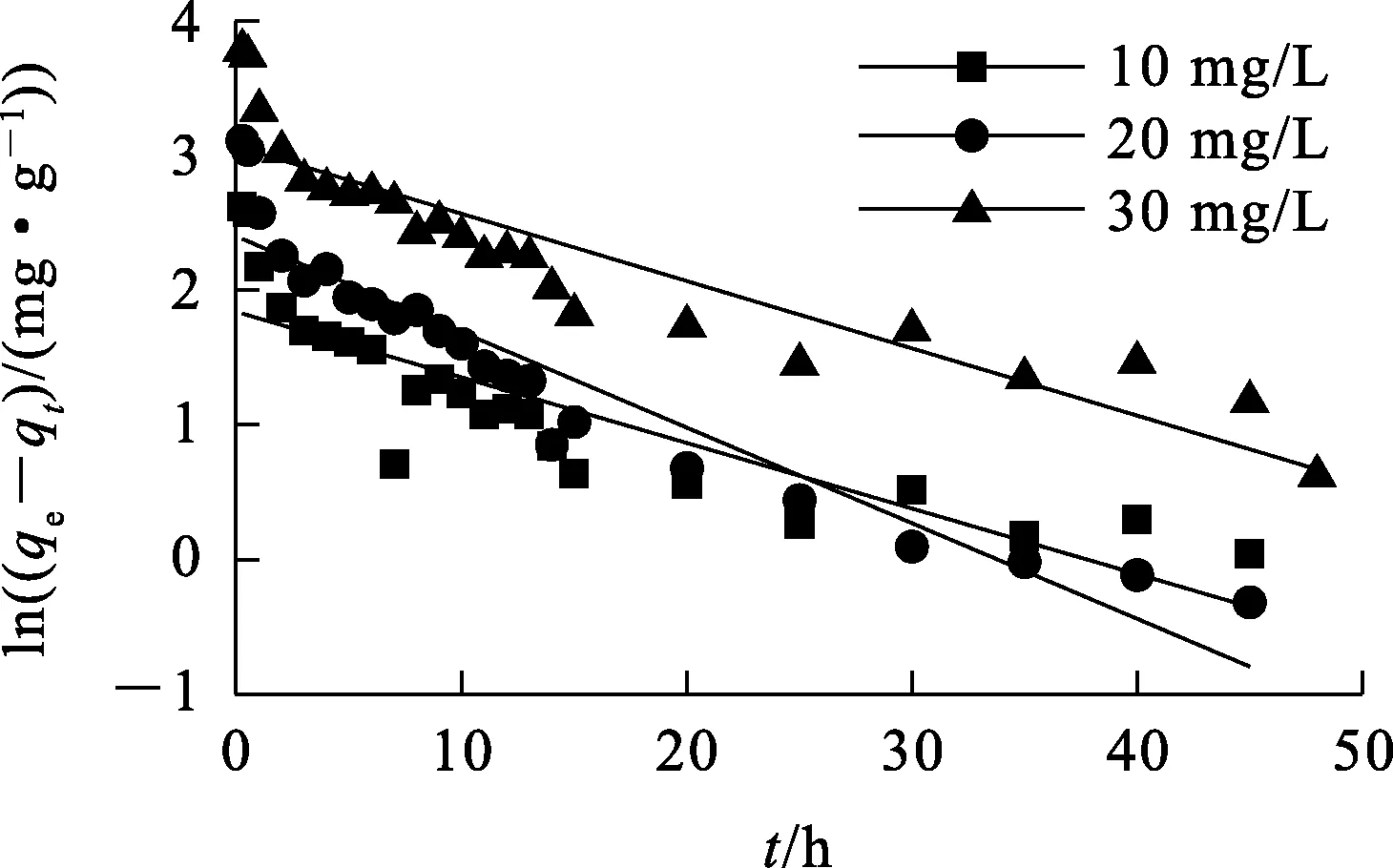
图4 准一级动力学模型拟合曲线
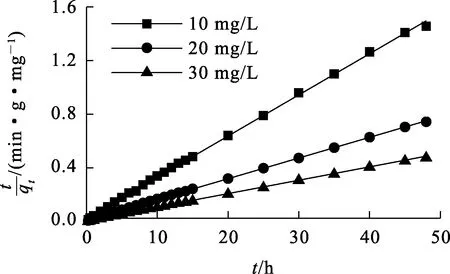
图5 准二级动力学模型拟合曲线
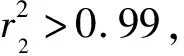

表2 动力学模型拟合参数

图6 颗粒内扩散模型拟合曲线
由图6看出:对于不同的Sb(Ⅲ)初始质量浓度,拟合曲线都没有经过原点,表明吸附速率不仅仅是由颗粒内扩散控制。一般而言,吸附过程分为3个阶段:快速吸附、慢速吸附和缓慢吸附至平衡。由表3看出,每个阶段的颗粒内扩散速率常数均遵循k1d>k2d>k3d;第1阶段,ki较大,溶液中的Sb(Ⅲ)通过膜扩散进入活性位点,浓度越高,传质推动力越大,扩散速度就越快;第2阶段,ki逐渐变小,曲线上升缓慢,整个吸附过程由内扩散控制,而且浓度越高,ki越大;第3阶段,慢速吸附逐渐到达吸附平衡。吸附是一个复杂且逐渐的过程,内扩散速率常数k2d比k1d要小得多,表明粒子的内部扩散速率很慢,因此,颗粒内扩散过程(物理吸附)虽为吸附速率控制步骤,但不是唯一的控制因素。根据准二级动力学和内扩散模型,推测化学吸附和物理吸附共同控制铁锰泥吸附Sb(Ⅲ)过程,化学吸附起主导作用。

表3 颗粒内扩散模型拟合参数
2.3 吸附等温线
采用Langmuir、Freundlich和Temkin 3种等温吸附模型对不同温度下的吸附数据进行线性拟合。
Langmuir模型,
(4)
Freundlich模型,
(5)
Temkin模型,
qe=BlnA+Blnρe。
(6)
式中:qe—吸附平衡时的吸附量,mg/g;qm—理论最大吸附量,mg/g;ρe—吸附平衡时溶液中Sb(Ⅲ)质量浓度,mg/L;kL—Langmuir常数,L/mg;kF—Freundlich常数,mg1-1/n·g-1;n—Freundlich等温吸附强度相关常数;A,B—Temkin等温常数,L/g,J/mol。分别以ρe、lgρe和lnρe为横坐标,ρe/qe、lgqe和qe为纵坐标,用origin 2018软件绘图,得到Langmuir、Freundlich和Temkin模型线性拟合曲线,如图7~9所示,拟合参数见表4。可以看出:3种等温模型对25、35、45 ℃下的等温吸附均有较好的相关性,相关系数分别为0.976 4~0.983 2、0.964 6~0.993 3和0.946 8~0.966 6。Langmuir模型的相关系数最大,说明其能更好地描述IMP对Sb(Ⅲ)的吸附过程,而且随温度升高吸附量不断增大,推测吸附过程为单分子层吸附,IMP官能团在其表面分布较为均匀。不同温度下,Freundlich等温模型的1/n均在0.5~1范围内,说明吸附反应较容易发生。

表4 等温吸附模型拟合参数
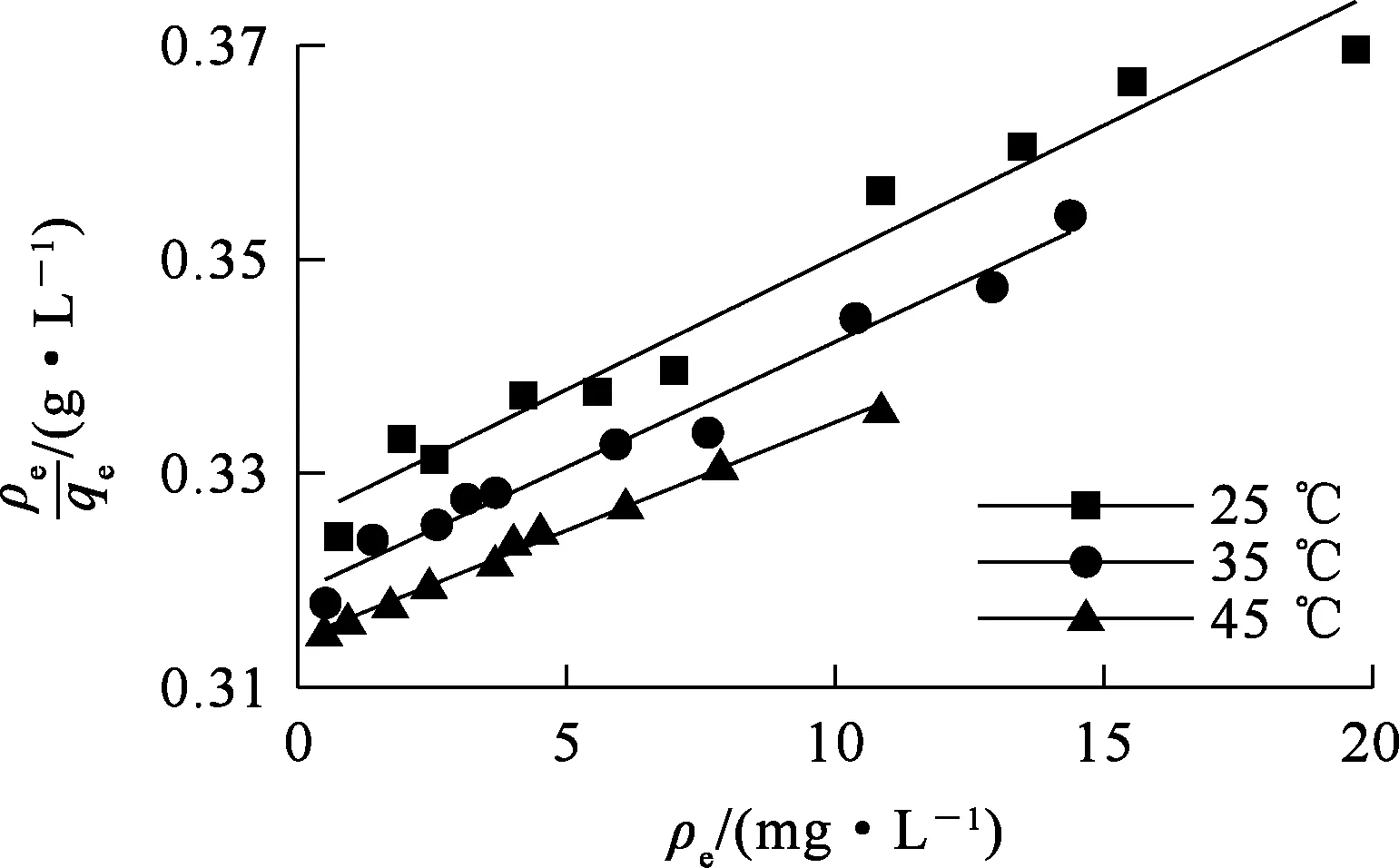
图7 Langmuir等温吸附模型拟合曲线
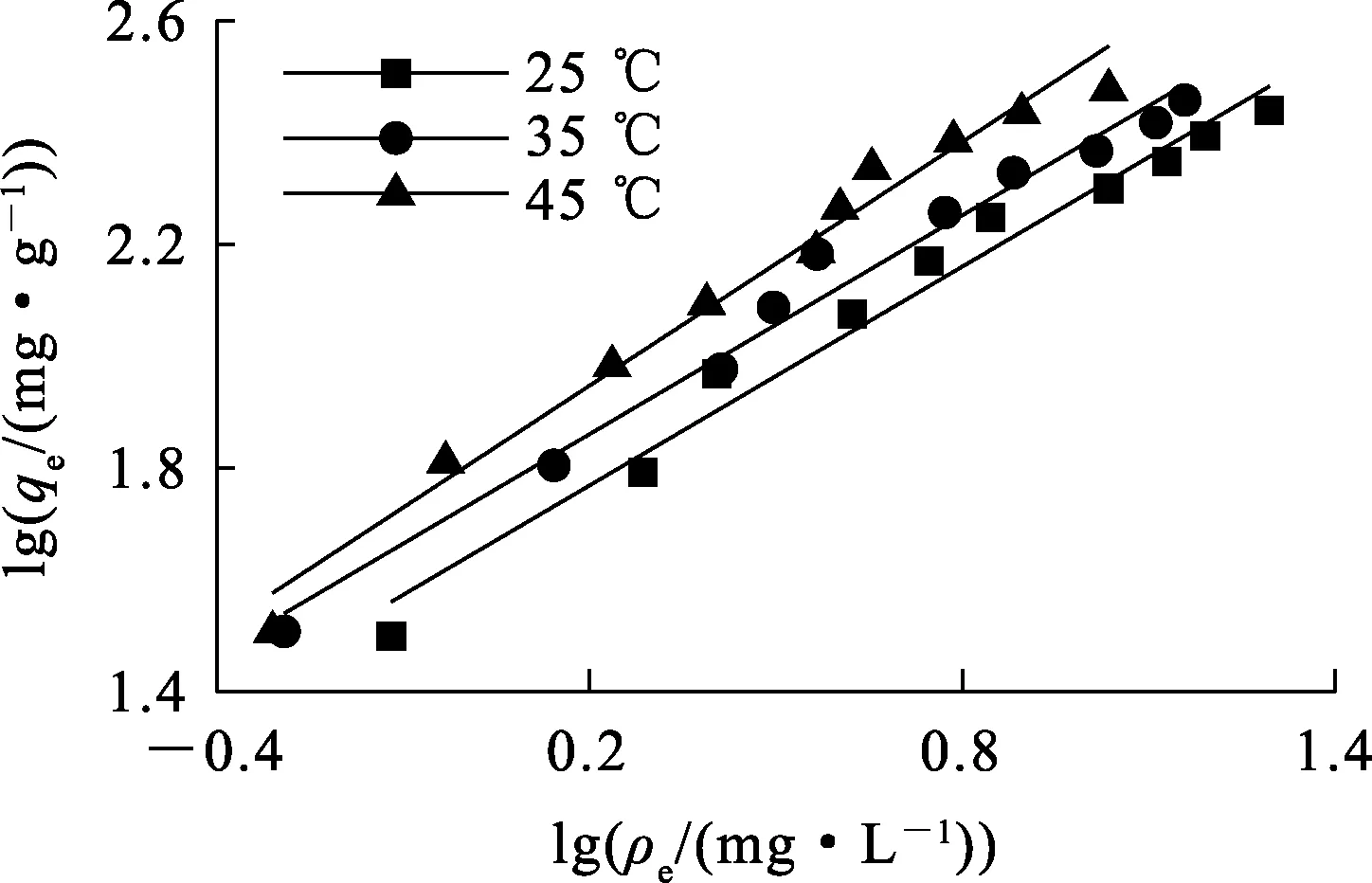
图8 Freundlich等温吸附模型拟合曲线
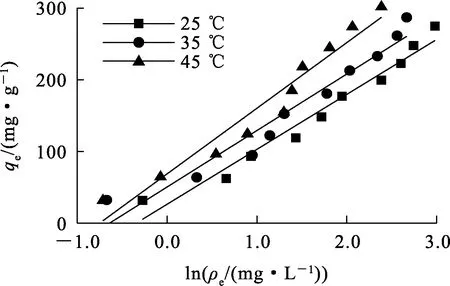
图9 Temkin等温吸附模型拟合曲线
吸附反应的热力学参数ΔH、ΔS、ΔG见表5。可以看出:25、35、45 ℃下,吸附反应的ΔH=17.878 4 kJ/mol>0,说明IMP对Sb(Ⅲ)的吸附过程中吸热,升温有助于反应进行,同时也说明化学吸附起主导作用;不同温度下的ΔG均小于零,说明吸附反应可自发进行;同时ΔG的绝对值随温度升高而增大,表明升温有利于吸附反应进行;吸附过程中,ΔS=92.468 kJ/(mol·K)>0,说明吸附过程中熵值增大,即反应向混乱度增大方向进行,是可持续的。总体来说,IMP吸附Sb(Ⅲ)的反应属于吸热、自发、可持续进行的过程。

表5 IMP吸附Sb(Ⅲ)的热力学参数
2.4 吸附前后的IMP表征
对吸附前后的IMP分别进行SEM、FT-IR、BET表征,结果如图10~12所示。
由图10看出:吸附前(a,b)的铁锰泥结构比较分散,颗粒分布较为散乱,且相互聚集,粒径大小不均匀,有丰富的表面孔隙,比表面积较大;吸附后(c,d),铁锰泥内部孔隙大部分被Sb(Ⅲ)填充,颗粒形成了连接在一起的骨架结构。

a—吸附前;b—吸附前局部放大5倍;c—吸附后;d—吸附后局部放大5倍。
由图11看出,吸附前后IMP的FT-IR光谱有相似的峰:在3 397.84 cm-1处,有较宽且强的特征吸收峰,在1 630.07 cm-1处的强峰为羟基官能团(—OH)的振动峰,分别为伸缩振动峰和弯曲振动峰,说明IMP中存在大量—OH官能团;在1 392 cm-1有典型的羧基(—COOH)伸缩振动吸收峰[13];在1 002.43 cm-1处的较宽峰可能是由醇和酚基团的C—O伸缩振动和O—H键面内弯曲振动形成[14-15];在472.83 cm-1处的峰为Fe—O键,推测为针铁矿的特征吸收峰。
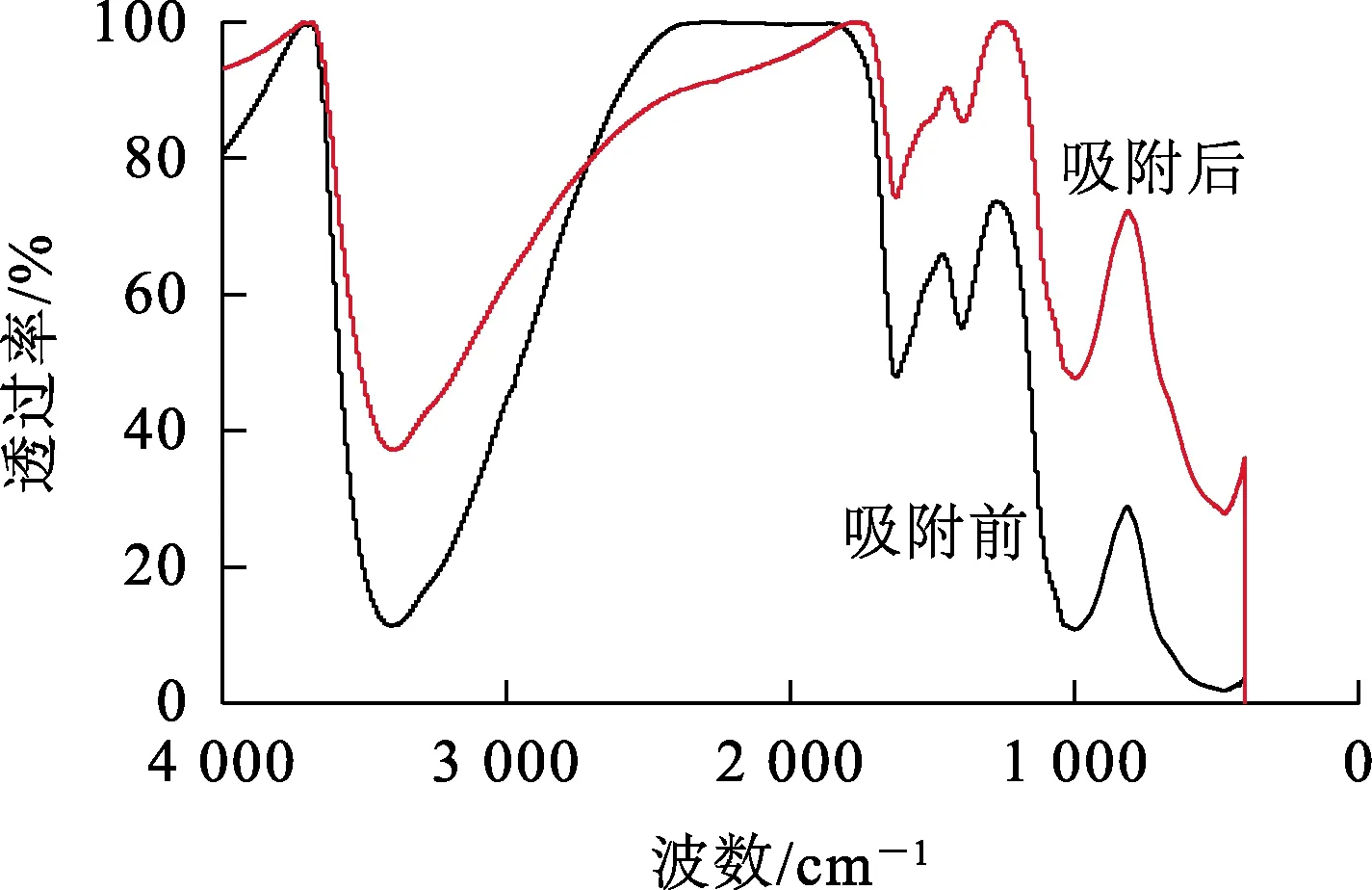
图11 吸附前、后IMP的FT-IR分析结果
吸附Sb(Ⅲ)之后,上述所有特征峰的宽度明显变窄且振动减弱,部分特征峰向低波数方向移动,-OH特征峰没有发生明显偏差,说明IMP与其他金属氧化物一样,表面的—OH被Sb(Ⅲ)形成的盐类化合物取代而发生离子交换反应,—OH 与Sb(Ⅲ)形成了Sb—O;吸附之后,部分特征峰发生位移,在1 500.00 cm-1处出现了微弱的Sb—O键面内弯曲振动峰,这是由于吸附过程中羟基与Sb(Ⅲ)结合形成了锑酸盐类化合物;Fe—O键的吸收峰从472.83 cm-1移动到473.18 cm-1,这可能与Fe—O—Sb的形成有关。根据上述分析,判断IMP与其他金属氧化物一样,是利用表面的—OH2、—OH官能团与Sb(Ⅲ)发生交换反应生成Fe—O—Sb实现对Sb(Ⅲ)的吸附去除的,且吸附后溶液pH升高也是与羟基被锑酸盐取代有关。
根据图12计算得出:IMP的比表面积为198.362 7 m2/g;氮气吸附—脱附曲线属于Ⅳ型,介孔回滞环属于H3型,回滞环在P/P0=0.4处闭合,说明其存在较小的介孔[16]。孔容大小是由孔径决定的,根据图13,IMP的孔径主要分布在0~6 nm 范围内,平均5.555 7 nm,属于微孔和中孔,孔隙体积在0.125~0.30 cm3/g范围内,说明基本不会发生多层分子吸附;部分孔径在20~40 nm 范围内,孔隙体积为0.10 cm3/g左右,比微孔体积小很多,说明孔隙结构很不规整,总孔隙体积为0.275 5 cm3/g。
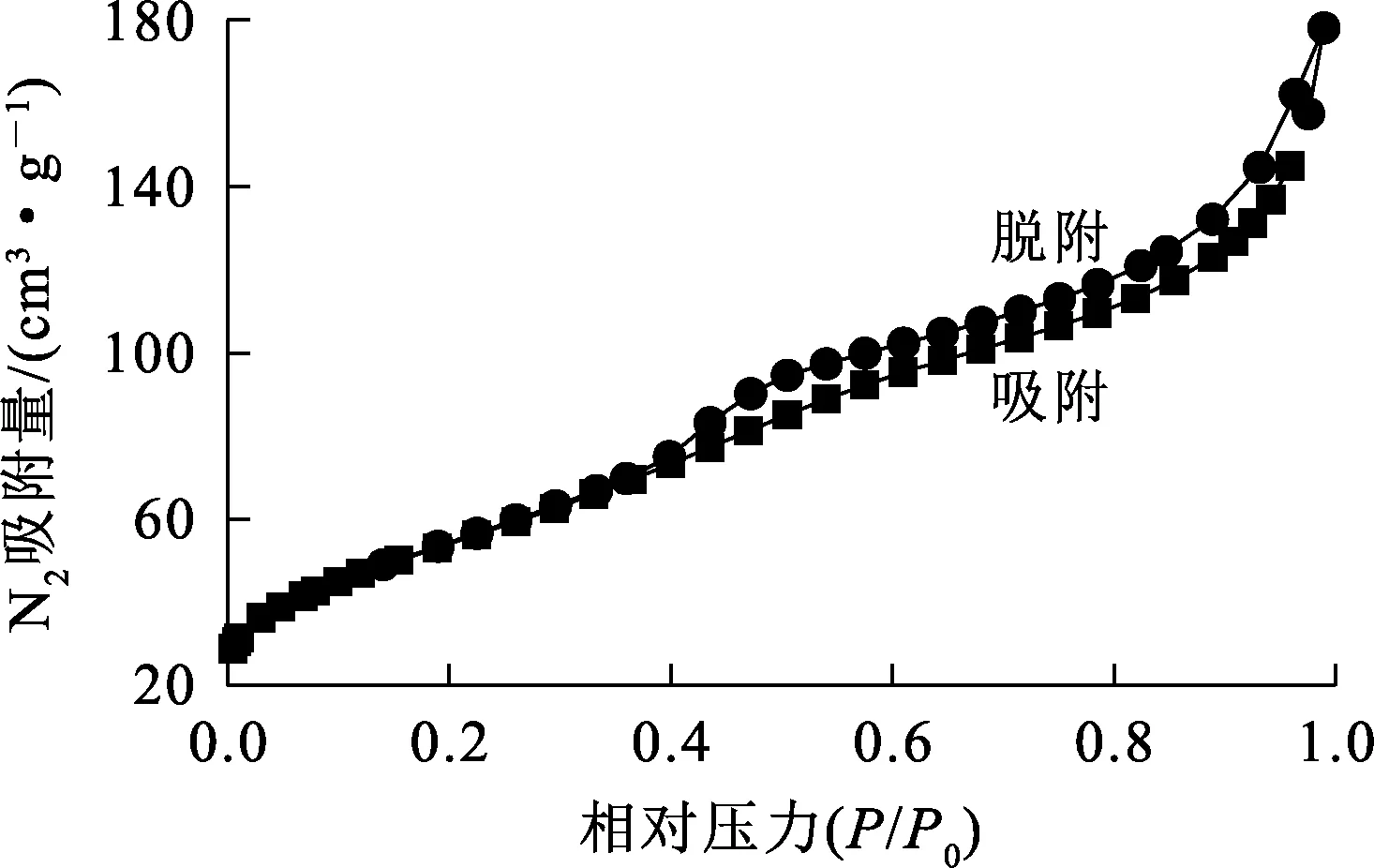
图12 IMP的氮气吸附—脱附曲线
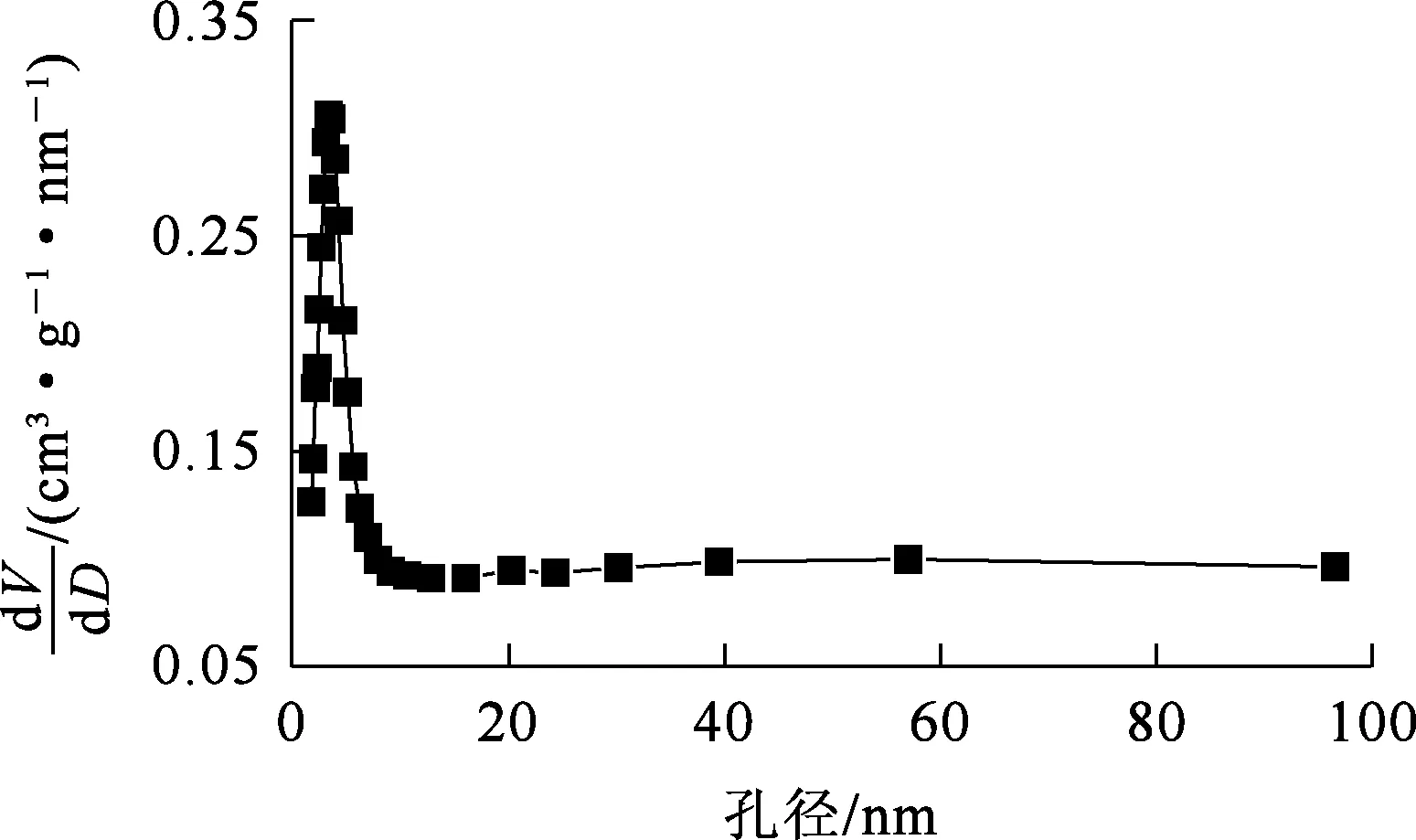
图13 IMP的孔径分布曲线
3 结论
用铁锰泥废料从废水中吸附去除Sb(Ⅲ)是可行的,废水pH对吸附去除率影响较大,pH为2~3的酸性条件下吸附效果最好,适宜温度为25~30 ℃,适宜条件下,Sb(Ⅲ)吸附去除率在91%以上。
IMP的比表面积较大,有较为松散且粒径不均匀状态,对Sb(Ⅲ)有较好的吸附能力,吸附过程由IMP中的—OH与Sb(Ⅲ)结合在表面形成锑酸盐类化合物,吸附过程以化学吸附为主导,且吸附后废水pH升高。
