负性调节细胞CD4+CD25+T及其相关细胞因子在COPD患者外周血中的表达与合并细菌感染的相关性研究
2022-06-16侯聪霞梁亚林
侯聪霞 孙 芳 梁亚林
1 河南省胸科医院呼吸与危重症一病区 (郑州 450000) 2 郑州市第七人民医院肾移植肾病诊疗中心(郑州 450016)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)具有较高的发病率和病死率,给患者及社会带来沉重负担,目前尚没有阻止或逆转COPD疾病进程的有效治疗方法[1],因此探讨其发病及进展机制对诊治有重要的临床意义。COPD发病机制复杂,既往研究证实,免疫失衡是其中重要一环,而作为机体免疫重要的组成部分,细胞免疫是以T淋巴细胞为主导的[2]。CD4+CD25+调节性T细胞是一类特殊的T细胞亚群,具有免疫抑制性和免疫无反应性,在维持自身耐受、免疫稳态和抑制抗肿瘤免疫反应中发挥重要作用[3]。因此,评估COPD患者外周血中的CD4+CD25+调节性T细胞及其相关细胞因子的表达,有助于判断患者的免疫状况,为了解免疫系统参与COPD发生进展机制提供信息。基于此,本研究纳入66例COPD患者作为研究对象,以探讨CD4+CD25+调节性T细胞在COPD患者外周血中的表达,及与合并细菌感染的相关性。
1 资料与方法
1.1 一般资料
纳入2018年1月—2019年12月间收治的66例COPD患者作为研究对象。纳入标准:符合COPD诊断标准[4]者;年龄>18岁者;未合并其他严重全身性疾病、脏器功能不全者。排除标准:合并其他免疫系统疾病者;合并其他慢性感染性疾病者;合并其他呼吸系统疾病者。本研究对照组纳入的均为体检健康者。66例COPD患者中急性加重期COPD(acute exacerbation COPD,AECOPD)者36例,男26例、女10例,年龄49~74岁,平均年龄(64.83±7.68)岁;稳定期COPD者30例,男23例、女7例,年龄51~74岁,平均年龄(65.41±7.54)岁。对照组:男22例、女8例,年龄51~69岁,平均年龄(64.99±7.18)岁。各组一般资料比较,差异无统计学意义(P>0.05)。
1.2 研究方法
所有研究对象均于入组时采集外周静脉血标本,使用淋巴分离液常规分离获得单个核细胞,加入RPMI-1640完全培养液重悬细胞,调整细胞浓度至1×107个/mL,取100 μL悬浮细胞分别加入20 μL CD4-FITC、CD25-APC,混匀后室温孵育,加入PBS缓冲液混匀、离心后弃去上清液,再次加入0.5 mL PBS缓冲液混匀,采用FACSCalibur型流式细胞仪(美国Bectond-Dickinson公司生产)检测CD4+、CD4+CD25+水平。采用ELISA法测定白介素-4(interleukin-4,IL-4)、白介素-10(interleukin-10,IL-10)、干扰素-γ(interferon-γ,IFN-γ)水平,试剂均来自上海晶抗生物工程有限公司。
1.3 观察指标
对所有纳入的研究对象外周血标本中的CD4+CD25+调节性T细胞及其相关细胞因子(IL-4、IL-10、IFN-γ)表达水平进行检测,分析相关指标水平与COPD是否合并细菌感染的关系,及预测细胞感染的效能。
1.4 数据分析

2 结 果
2.1 外周血T淋巴细胞表达水平
AECOPD和稳定期COPD患者CD4+、CD4+CD25+水平均低于对照组(P<0.05),AECOPD患者CD4+、CD4+CD25+水平低于稳定期COPD患者(P<0.05),见表1。
表1 外周血T淋巴细胞表达水平

续表
2.2 外周血血清细胞因子表达水平
AECOPD和稳定期COPD患者IL-4、IL-10水均高于对照组(P<0.05),IFN-γ/IL-4水平低于对照组(P<0.05),AECOPD患者IFN-γ水平高于对照组(P<0.05);AECOPD患者IL-4、IL-10、IFN-γ均高于稳定期COPD患者(P<0.05),见表2。

表2 外周血血清细胞因子表达水平
2.3 COPD患者外周血T淋巴细胞表达与血清细胞因子的相关性
Pearson相关分析法显示:COPD患者外周血CD4+、CD4+CD25+水平均与IL-4、IFN-γ呈负相关关系(P<0.05),CD4+水平与IL-10呈负相关关系(P<0.05),见表3。

表3 COPD患者外周血T淋巴细胞表达与血清细胞因子的相关性
2.4 COPD合并感染者T淋巴细胞及其相关细胞因子的水平
36例AECOPD患者中合并细菌感染者27例,其中革兰氏阴性菌感染者19例、革兰氏阳性菌感染者8例,无真菌感染病例。COPD合并感染者CD4+水平低于未合并感染者(P<0.05),IL-4、IFN-γ水平均高于未合并感染者(P<0.05);COPD合并革兰氏阴性菌感染者CD4+CD25+水平低于未合并感染者(P<0.05),IL-10水平均高于未合并感染者(P<0.05),见表4。

表4 COPD合并感染者T淋巴细胞及其相关细胞因子的水平
2.5 T淋巴细胞及其相关细胞因子预测细菌感染的效能
ROC曲线显示:CD4+、IL-4、IL-10、IFN-γ均是预测COPD患者合并细菌感染的有效指标(P<0.05),其中IL-4和IFN-γ效能较高(P<0.05),见表5。
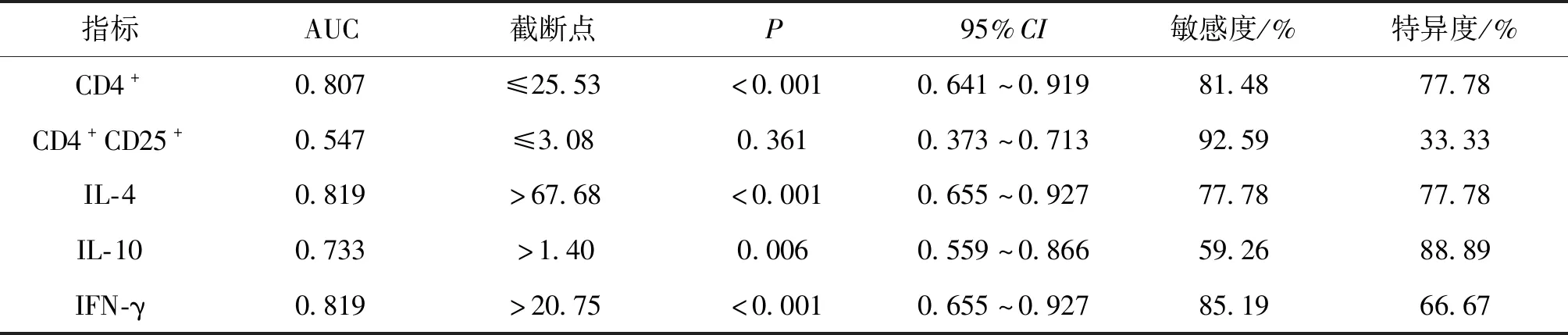
表5 T淋巴细胞及其相关细胞因子预测细菌感染的效能
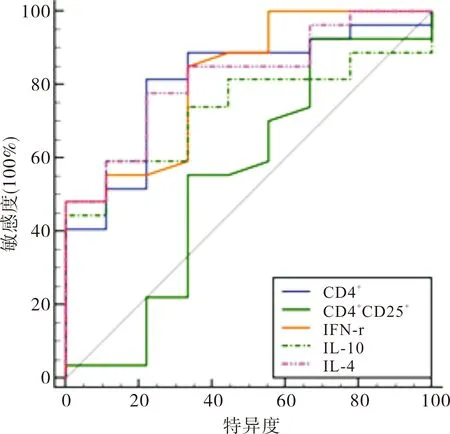
图1 T淋巴细胞及相关细胞因子的ROC曲线
3 讨 论
既往文献证实,COPD的发病机制不仅在于肺部出现炎症反应,还在于全身免疫系统的变化,T淋巴细胞除了参与COPD的炎症过程,还参与调整COPD的免疫功能[5]。且有研究显示,T淋巴细胞相关血清细胞因子在COPD发病进展中会发生显著变化[6]。有学者发现,在COPD并发肺部感染患者中炎性因子和Th17均呈高表达,Treg呈低表达,Th17/Treg失衡及其介导的炎症反应可影响患者的肺功能[7]。但在COPD疾病状态下,有关免疫细胞与其血清细胞因子间相互作用机制变化的报道仍少见。这不利于了解细胞免疫在COPD病程中的具体机制,为改善COPD免疫辅助治疗及预测患者细菌感染等病情变化,本研究展开相关探讨。
本研究结果显示,不同病情COPD患者CD4+、CD4+CD25+水平均显著低于健康人群,病情严重者调节性T细胞表达更低。CD4+CD25+调节性T细胞主要通过细胞间接、直接接触或分泌抑制性细胞因子来抑制自身效应性细胞活化,参与免疫负调节,维持自身免疫耐受[8]。因此,COPD患者调节性T细胞数量减少,一是表明AECOPD可能由于CD4+CD25+水平减少,而使患者更易发生病理性免疫应答,呼吸系统出现急性炎症反应;二是考虑COPD稳定期患者也存在调节性T细胞变化,这可能是引起COPD疾病慢性化和反复发作的机制之一。不同T细胞具有不同细胞因子产生模式,其中IFN-γ以Th1细胞产生为主,IL-4、IL-10以Th2细胞产生为主[9],因此观察IFN-γ、IL-4水平及其比值有助于判断T细胞因子水平的平衡。在细胞因子层面,本研究数据显示,AECOPD和稳定期患者血清细胞因子表达水平均显著升高,但呈现病情越重、IFN-γ/IL-4比值水平越低的状况。这说明在COPD患病人群中均出现免疫反应,IFN-γ、IL-4水平均升高,但IFN-γ升高幅度不及IL-4,致使患者免疫失衡,与CD4+CD25+Treg细胞降低的趋势保持一致。IL-4能激活B淋巴细胞合成IgE和IgG1,引起喘息症状的发作和加剧;且能促进黏液糖蛋白合成,杯状细胞增生及气道黏液分泌等,导致了气道炎症和重构[10]。进一步通过评估Treg细胞与血清细胞因子的关系发现,AECOPD疾病状态下,两者呈现显著负相关关系,CD4+CD25+Treg表达水平变化是COPD患者免疫平衡的重要机制,也会影响机体炎性反应和病情进展。
感染是AECOPD患者的常见影响因素[11],符梦楠等[12]学者发现病原菌感染以革兰氏阴性菌为主,与本研究结果一致。原因是,AECOPD患者以老年人为主,多数伴有其他基础疾病,免疫功能低下,易出现肠道内革兰氏阴性菌过度增殖并发生肺部转移,且革兰阴性菌对呼吸道黏膜上皮黏附性较强[13]。COPD合并细菌感染会影响病情严重程度,干扰患者治疗效果,延长其住院时间。本研究结果显示,AECOPD患者中合并细菌感染者Treg细胞与相关细胞因子均和未合并感染者存在差异,尤其是革兰氏阴性菌感染者,提示上述指标在预测细菌感染中的可行的。既往文献证实,在合并有细菌等病原体感染的COPD中,细菌体裂解分解产物能够促进巨噬细胞、肥大细胞分泌细胞因子,促使炎症反应加重[14-15]。革兰阴性菌主要通过产生内毒素致病[11],可能与内毒素诱导血清细胞因子水平较强有关。其中,IL-4和IFN-γ是预测COPD患者合并细菌感染的良好效能指标。与病原菌培养相比,血清学指标检测更便捷,具有一定实际应用价值,但也需更多研究进行验证。
综上所述,CD4+、CD4+CD25+Treg细胞表达与COPD发病、病情进展、细菌感染均存在关联,不同病情严重程度COPD患者均有免疫功能失衡且会影响相关细胞因子水平,CD4+CD25+Treg相关细胞因子水平预测患者是否合并细胞感染效能良好。
