不同改良措施对黄瓜连作土壤细菌群落结构组成和多样性的影响
2022-06-16薛国萍白红梅杜金伟朱春侠宋庆成季淑丽王黎胜
姜 伟,薛国萍,白红梅,杜金伟,朱春侠,李 杰,宋庆成,季淑丽,王黎胜
(1.内蒙古自治区农牧业科学院,内蒙古呼和浩特 010031;2.赤峰市农牧科学研究院,内蒙古赤峰 024031;3.宁城县农牧业局,内蒙古宁城 024200;4.呼伦贝尔市农畜产品质量安全中心,内蒙古海拉尔 021000)
黄瓜(Cucumis sativusL.)是我国设施农业生产中主要的蔬菜作物之一,然而随着设施农业产业化和规模化进一步发展,许多地方出现了种植模式单一、黄瓜连作障碍严重的问题,造成土壤微生物多样性下降、养分失衡、土传病害严重、土壤微环境恶化,导致黄瓜产量和品质下降[1-4]。连作障碍已成为制约设施农业可持续发展的瓶颈问题,因此,通过改变种植模式,创新种植技术,改善连作土壤环境,已成为设施黄瓜可持续发展亟待解决的问题。克服连作障碍的措施较多,高温闷棚、季节填闲、秸秆还田、使用微生物菌肥、石灰氮土壤熏蒸消毒等均是促进农业可持续发展的主要管理措施。高温闷棚可改善土壤养分含量,显著提高细菌和放线菌的含量,降低土传病害病原菌,增加作物产量[5]。以小麦作为填闲作物是目前蔬菜研究中最优的填闲方式,能够减缓土壤中氮和钾的富集且具有溶磷作用,可以有效缓解土壤次生盐渍化[6];玉米秸秆还田通过改善土壤团聚体结构,不仅能够提高土壤有机质含量、丰富土壤中微生物数量、增加微生物活性与多样性,还可以提高作物产量[7];微生物菌肥能够增加土壤微生物多样性,降低病原菌和真菌数量,提高植物的抗逆抗病能力[8];石灰氮是一种高效的土壤消毒剂,对土传病害防治效果显著[9],对枯萎病的防治也具有一定效果[10]。土壤微生物是土壤生态系统中最为活跃的部分,在维持生态系统结构和功能稳定性中发挥着重要作用[11-12],土壤中的微生物数量、多样性和群落结构与土壤质量密切相关,均能作为判断土壤健康状况的重要指标[13-14]。细菌是土壤中数量最丰富、分布最广泛的微生物类群,参与土壤养分循环等生物化学过程,对于保持土壤健康具有重要的作用。
本试验以黄瓜连作12年的土壤为研究对象,在夏季休闲期进行高温闷棚的基础上,分别进行秸秆还田、小麦填闲、添加有益微生物菌肥、石灰氮消毒的4 种土壤处理,研究不同处理对黄瓜连作土壤微生物群落结构组成和多样性的影响,从而评价不同处理措施对黄瓜连作的改良效果,为设施土壤健康保持和可持续利用提供理论依据和技术支撑。
1 材料和方法
1.1 试验区概况
试验于2020年在内蒙古自治区赤峰市宁城县大双庙镇巴里营子村(N:41°16′17″~41°57′53″,E:118°21′26″~119°55′25″)进行,该地区平均海拔920 m,年平均气温7 ℃,年平均日照时数2 700 h,全年无霜期130~145 d,年平均降水量350~450 mm。试验地种植黄瓜的年限为2008—2020年,采用一年一大茬栽培方式,每年9月中旬至10月初定植,次年6月初拉秧清棚。
1.2 试验材料
供试材料为黄瓜连作12年的日光温室0~15 cm土层土壤,有机质含量25.00 g/kg、全氮含量1.47 g/kg、全磷含量1.10 g/kg、全钾含量2.39%、水解性氮含量96.00 mg/kg、速效磷含量170.50 mg/kg、速效钾含量199.00 mg/kg、pH 值8.36、电导率14.30 mS/m。
1.3 试验设计和样品采集
1.3.1 试验设计
在夏季休闲季节,前茬黄瓜清理后,2020年7月20日—8月20日高温闷棚。试验设置4 个处理,每个处理30 m2,重复3 次。处理1:玉米秸秆还田(C1),高温闷棚时,将已经腐熟好的玉米秸秆撒入试验区,施腐熟秸秆7 500 kg/hm2;处理2:小麦填闲(C2),高温闷棚结束后,撒播小麦种子75~150 kg/hm2,当小麦幼苗生长至15~20 cm 时,随着翻地一起翻入土壤;处理3:添加抗重茬生物菌肥(C3),高温闷棚结束后,起垄定植时,随着有机肥一起施入,施用量为30 kg/hm2,施用方法为拌细砂均匀撒施;处理4:石灰氮消毒(C4),高温闷棚时,地面均匀撒施石灰氮,用量1 200~1 500 kg/hm2,浇透水,覆盖薄膜,进行熏蒸消毒;对照(CK)为黄瓜连作12年土壤。
1.3.2 土样采集
在前茬黄瓜拉秧前(2020年4月22日)以及不同处理后(2020年9月11日)取土样。各处理随机收集黄瓜根际土壤,土壤样品的采集采用抖根法[15]。
每个处理随机取5 个样点进行混合,3 次重复。土样保存在-80 ℃冰箱中,用于土壤细菌的测定。
1.4 土壤细菌群落结构和生物信息学分析
1.4.1 基因组DNA 提取
采用试剂盒提取土样的基因组DNA,之后利用1%琼脂糖凝胶电泳和NanoDrop2000 超微量分光光度计检测DNA 的质量和纯度。
1.4.2 PCR 扩增及建库
提取样品总DNA 后,以基因组DNA 为模板,使用带barcode 的特异引物343F(TACGGRAGGCAGCAG)和798R(AGGGTACTAATCCT)对细菌V3~V4 可变区进行PCR 扩增。扩增程序为预变性:94 ℃5 min;26 个循环(变性:94 ℃30 s,退火:56 ℃30 s,延伸:72 ℃20 s);72 ℃稳定延伸5 min,最后在4 ℃条件下保存。对PCR 扩增产物进行电泳检测、磁珠纯化,二轮扩增后,纯化的PCR 产物进行Qubit 定量,混样并上机测序。建库测序及数据分析由上海市欧易生物医学科技有限公司完成。
1.4.3 生物信息分析及数据处理
高通量测序分析步骤如下:双端序列采用Trimmomatic 软件进行去杂质[16];使用FLASH 软件拼接去杂后的双端系列[17];利用UCHIME 检测并去除序列中的嵌合体序列;得到的优质序列,采用Vsearch软件[15],根据序列的相似性,将序列归为多个OTU;使用QIIME 软件包[18],以Silva(version132)数据库比对进行数据注释,物种对比注释使用RDPclassifier 软件[19]。在QIIME(multiple_rarefactions.py)中计算细菌α 多样性和β 多样性;使用R 3.5.1 软件包进行PCoA、Adonis 和LEfSe 分析;使用SPSS 19.0 统计软件进行单因素方差分析,使用Duncan 新复极差法进行差异显著性分析(One-way ANOVA,P<0.05)。
2 结果与分析
2.1 不同处理对黄瓜连作土壤微生物的测序结果分析
由图1 可知,各处理稀释曲线接近平缓,表明土壤微生物细菌群落测序数据量充足,能够最大限度地反映各处理样品信息,测序可信度较高,可以用来研究细菌的群落结构。

图1 不同处理样本中OTU 数的稀释曲线
2.2 不同处理对黄瓜根际土壤细菌群落丰富度和多样性的影响
2.2.1 不同处理对黄瓜根际土壤OTU 数的影响
由图2 可知,各处理共享的OTU 数量为1 157,C1~C4 处理特有的OTU 数目分别为1 069、769、830、1 045。与CK 相比,分别降低了55.05%、67.66%、65.10%、56.06%,表明不同处理均降低特有微生物种类。
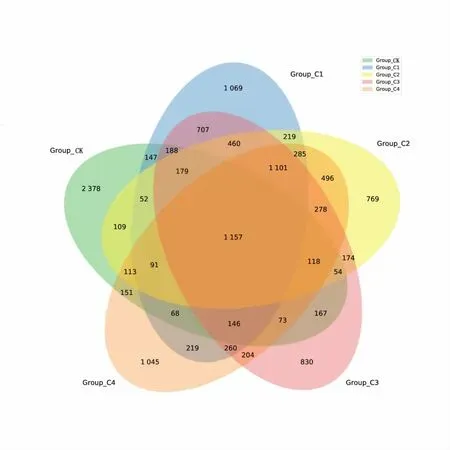
图2 不同处理下黄瓜连作土壤共有和特有的OUT 数目Venn 图
2.2.2 不同处理对黄瓜连作土壤细菌群落α 多样性的影响
由表1 可知,不同处理改变了微生物群落物种丰富度指数(Chao1)及多样性指数(Simpson、Shannon-Wiener)。与CK 相比,不同处理均增加丰富度指数(Chao1),C1 ~C4 处理,分别增加了29.60%、16.18%、25.43%、10.51%,C1、C3 处理显著高于CK(P<0.05),不同处理物种丰富度指数(Chao1)依次为C1>C3>C2>C4。不同处理均增加Simpson 多样性指数,与CK 相比,C1、C3 处理分别增加了3.90%、3.75%,差异显著(P<0.05);C2、C4 处理分别增加了2.59%、2.83%,差异不显著(P>0.05)。不同处理对Shannon-Wiener 多样性指数的影响为C1、C3 处理较CK 分别增加了8.90%、8.54%,差异不显著(P>0.05);C2、C4 分别降低了3.37%、5.05%,差异不显著(P>0.05)。上述结果表明,不同处理改变了黄瓜连作土壤根际微生物α 多样性。
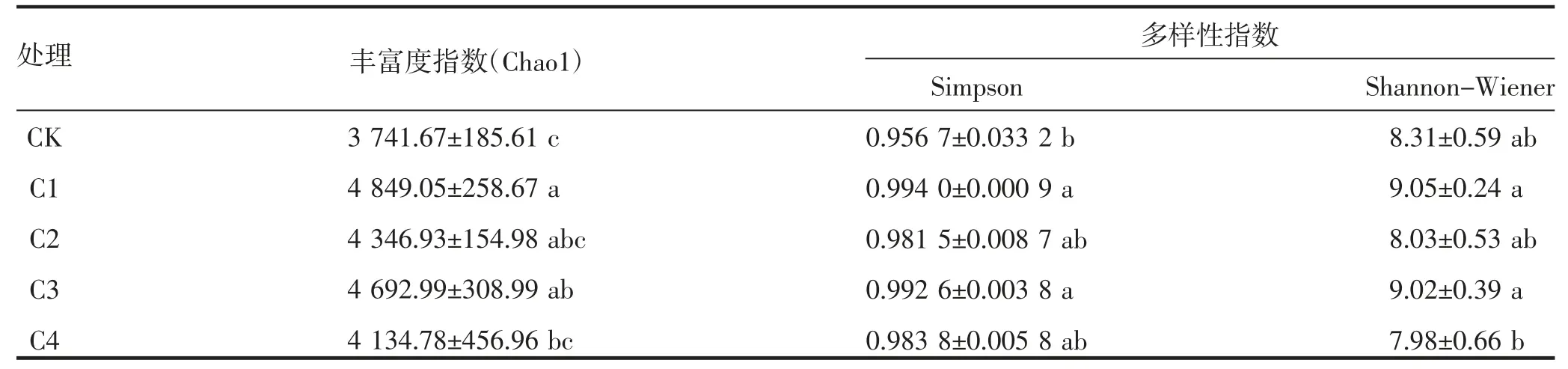
表1 不同处理条件下黄瓜连作土壤细菌α 多样性指数的变化
2.2.3 不同处理对黄瓜连作土壤细菌群落β 多样性的影响
主坐标轴分析(principal co-ordinates analysis),可以反映不同处理间群落组成相似性和差异性。处理间距离越近,群落组成越相似,相反,群落结构差异越大[20]。对土壤处理前后不同土壤细菌进行主坐标轴分析(PCoA),使用Bray-Crrtis 距离算法,同时经Adonis 统计学软件分析处理间的差异显著性。由图3 可知,不同处理间的黄瓜连作土壤微生物群落差异极显著(P<0.01)。不同处理主成分PC1 为27.62%,主成分PC2 为21.72%,主成分PC3 为9.12%,累积贡献率为58.46%。各处理均与CK 相距较远,表明不同处理对黄瓜连作土壤细菌群落结构造成的影响较大。
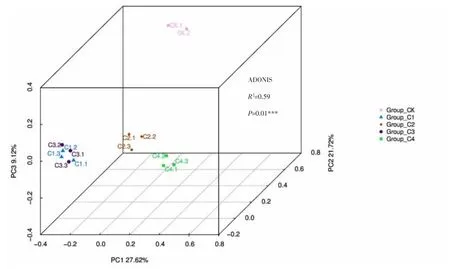
图3 不同处理对黄瓜连作土壤细菌群落结构主坐标(PCoA)分析
2.3 不同处理对黄瓜连作土壤细菌群落结构的影响
2.3.1 不同处理对黄瓜连作土壤细菌门水平群落结构的影响
在不同处理及CK 的土壤细菌群落中观察到36 个门,各处理相对丰度排序前15 的细菌门分布见图4。各处理中,相对丰度大于1.00%的细菌菌门为变形菌门(Proteobacteria)、 拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria),相对丰度分别为36.10%~55.53%、10.59%~35.41%、4.68%~8.15%、3.56%~22.45%、3.12%~13.58%、0.81%~2.90%,变形菌门相对丰度最高。不同处理没有改变门水平多样性,但不同处理细菌门所占比例存在差异。与CK 相比,4 种处理均增加了放线菌门、拟杆菌门、芽单胞菌门的相对丰度,降低了变形菌门、酸杆菌门的相对丰度。C1、C2、C3 处理与CK 相比,拟杆菌门相对丰度分别增加了23.5、19.60、23.30 个百分点;C2、C4处理显著增加了放线菌门、芽单孢菌门的相对丰度,放线菌门分别增加了9.46、8.95 个百分点,芽单胞菌门分别增加了5.2,18.89 个百分点。对于其他菌门,C3 处理显著增加了疣微菌门和硝化螺旋菌门的相对丰度,不同处理均增加了梭杆菌门的相对丰度。C2、C4 处理显著降低变形菌门和酸杆菌门的相对丰度,变形菌门分别降低了19.43、16.59 个百分点,酸杆菌门分别降低了1.84、2.09 个百分点。
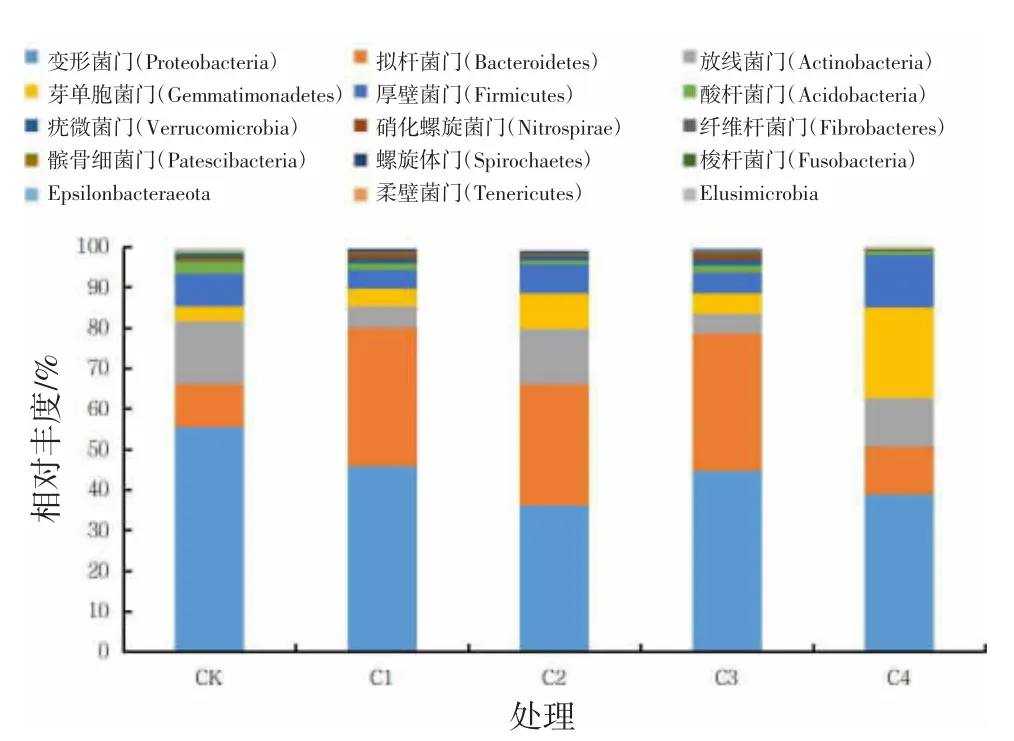
图4 不同处理对黄瓜连作土壤细菌在门水平上的优势物种相对丰度
2.3.2 不同处理对黄瓜根际土壤细菌属水平群落结构的影响
在细菌群落中观察到1 158 个属,各处理相对丰度排序前15 的细菌属分布见图5。细菌群落中平均相对丰度超过1.00%的细菌属分别为类固醇杆菌属(Steroidobacter)、Chryseolinea、双歧杆菌属(Bifidobacterium)、纤维弧菌属(Cellvibrio)、热多孢菌属(Thermopolyspora)、热单孢菌属(Thermomon ospora)、黄异杆菌属(Flavisolibacter)、假单胞菌属(Pseudomonas)。与CK 相比,热多孢菌属、热单孢菌属为新增菌属,C2 处理显著增加了热单孢菌属相对丰度,增加了1.97 个百分点;C4 处理显著增加了热多孢菌属相对丰度,增加了2.22 个百分点。不同处理不同程度地改变了优势菌属的相对丰度,与CK相比,C2 处理显著增加了类固醇杆菌属相对丰度,增加了5.57 个百分点;C1、C3 处理显著增加了Chryseolinea、纤维弧菌属、黄异杆菌属相对丰度,分别增加了3.57、2.67、2.70 个百分点和2.77、1.83、2.32 个百分点;各处理均显著降低了双歧杆菌属(Bifidobacterium)相对丰度,分别降低了2.58、2.54、2.57、2.52 个百分点。其他菌属,与CK 相比,C1 处理显著增加了农研丝杆菌属(Niastella)相对丰度;C3处理显著增加了黄杆菌属相对丰度;C4 处理显著增加了不动杆菌属(Acidibacter)相对丰度,降低了芽单胞菌属(Gemmatimonas)相对丰度。
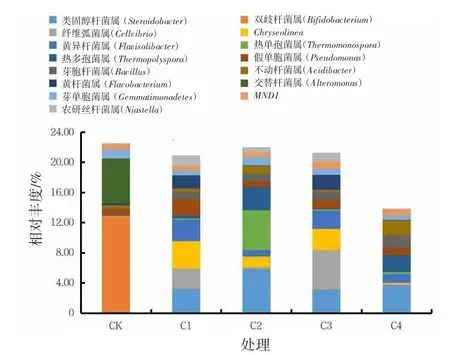
图5 不同处理对黄瓜连作土壤细菌在属水平上的优势物种相对丰度
2.3.3 不同处理对黄瓜连作土壤优势菌群门水平和属水平组间差异性的影响
基于LEfSe 分析,不同处理中共得到46 个差异物种。其中,C4 处理差异物种最多,有16 个差异物种,其次是C2、C1、C3、CK 处理,分别有10、9、6、5 个。各处理均在LDA≥4 水平下差异显著,在C1 处理,拟杆菌门(Bacteroidetes)、Chyseolinea差异显著;C2 处理,热单胞菌属(Thermomonospora)差异显著;C3 处理,纤维弧菌属(Cellvibrio)差异显著;C4 处理,芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)差异显著(图6)。
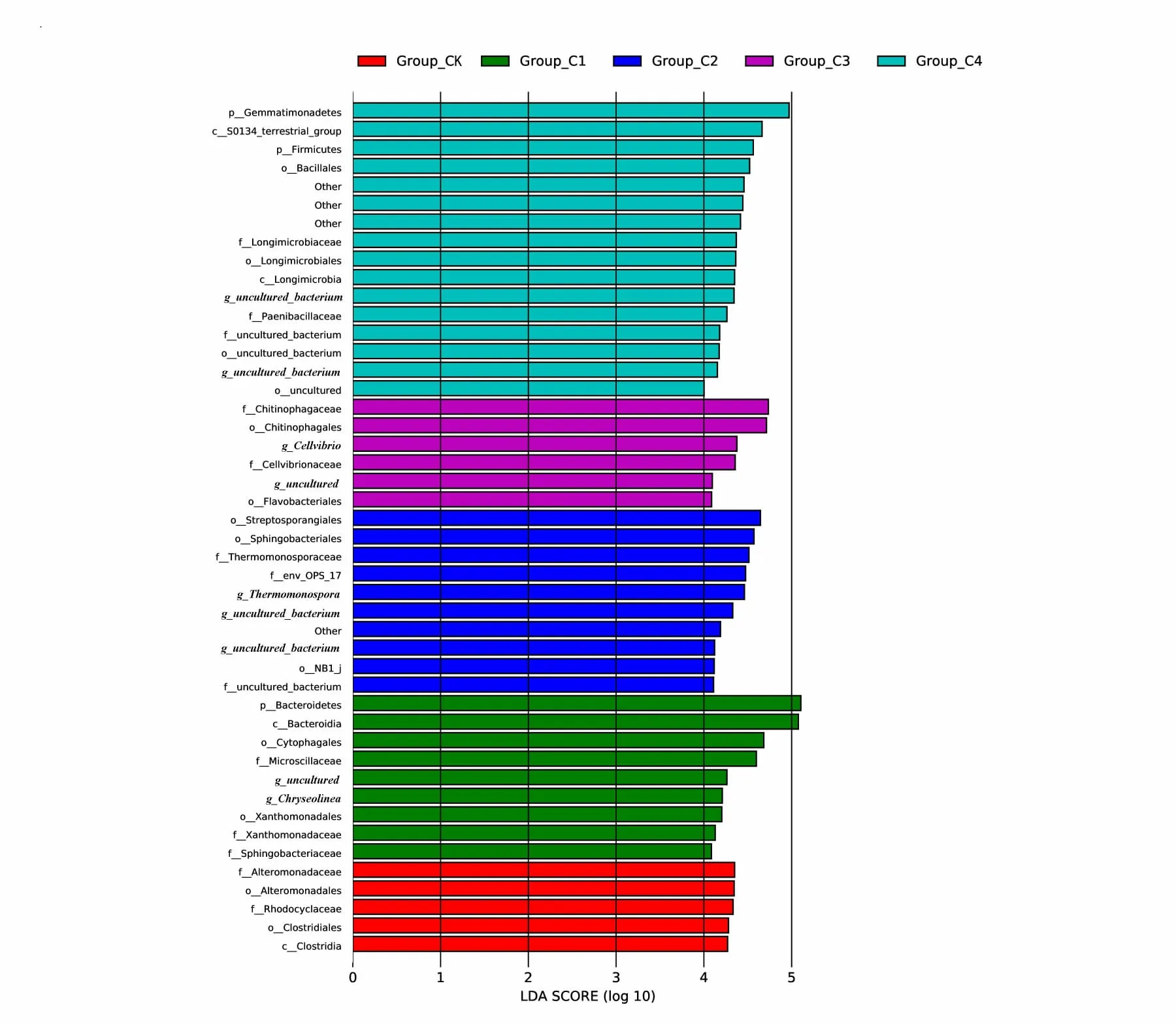
图6 不同处理对黄瓜连作土壤细菌的LEfSe 分析
3 结论与讨论
不同的土壤改良措施对土壤细菌多样性及群落组成有不同的影响[21-23]。Chao1 指数、Simpson 指数、Shannon-Wiener 指数用于评价细菌群落的丰富度和多样性,多样性指数越高表明细菌群落的丰富度和多样性越高[24]。本试验中,与CK 相比,秸秆还田(C1)、小麦填闲(C2)、添加抗重茬生物菌肥(C3)及石灰氮消毒土壤(C4)处理均显著影响细菌群落多样性,以秸秆还田、添加抗重茬生物菌肥处理的多样性指数最高。主坐标(PCoA)分析和线性判别(LEfSe)分析均表明,不同处理改变了黄瓜连作土壤微生物群落结构及其组成。
本试验中,不同处理没有改变细菌门水平的群落组成,但改变了属水平的群落组成。在门水平,不同处理显著增加或降低了菌群的相对丰度;不同处理均增加了拟杆菌门、放线菌门、芽单胞菌门的相对丰度,秸秆还田、小麦填闲、添加抗重茬生物菌肥处理显著增加拟杆菌门相对丰度,小麦填闲、石灰氮消毒土壤处理显著增加放线菌门和芽单胞菌门的相对丰度。不同处理均降低变形菌门、酸杆菌门的相对丰度,与罗俊等[25]在不同改良措施甘蔗土地上的应用结果相似。本试验中,小麦填闲、石灰氮消毒土壤处理显著降低变形菌门的相对丰度,添加抗重茬生物菌肥、石灰氮消毒土壤处理显著降低酸杆菌门的相对丰度。有研究表明,拟杆菌门为富营养菌,相对丰度与有机质含量呈正相关[26-27]。放线菌门细菌多为腐生菌,有利于土壤中动物和植物(纤维素和木质素)残体的分解[28]。芽单胞菌门是植物促生菌,对植物生长具有促进作用[29]。酸杆菌门常作为贫瘠土壤环境指标,相对丰度与土壤质量呈负相关[30-31]。本试验中,酸杆菌门的降低,拟杆菌门、放线菌门、芽单胞菌门的增加表明不同处理均改善了土壤质量。变形菌门作为优势菌门显著降低,其原因可能是当地施肥习惯所致,当地黄瓜栽培以磷肥作为底肥及追肥使用过量,使得土壤积累磷肥含量多,磷肥以难以被利用的无机磷和大分子有机磷形式存在,不同处理可能增加了可吸收利用的磷素形态,导致土壤pH 值增加。已有研究得出,小麦填闲显著提高了土壤pH 值[32],石灰氮消毒土壤处理后,非根际土壤pH 值提高[33]。
在属分类水平上,不同处理下,热多孢菌属(Thermopolyspora)、热单孢菌属(Thermomonospora)为新增菌属。小麦填闲处理显著增加了类固醇杆菌属相对丰度,添加抗重茬生物菌肥显著增加了黄杆菌属相对丰度,秸秆还田、添加抗重茬生物菌肥处理显著增加了Chryseolinea、纤维弧菌属、热单孢菌属、黄异杆菌属相对丰度。已有研究表明,黄杆菌属、黄异杆菌属在纤维素降解过程中发挥着重要作用。
综上所述,秸秆还田、小麦填闲、添加抗重茬生物菌肥、石灰氮消毒土壤处理均能改变黄瓜连作土壤细菌群落结构组成、丰富度和多样性,并改善土壤健康状况。秸秆还田处理、添加抗重茬生物菌肥处理菌群变化相似,小麦填闲、石灰氮消毒土壤处理菌群变化相似。添加抗重茬生物菌肥、秸秆还田处理显著增加微生物群落结构多样性及有益菌门、菌属种类和相对丰度;小麦填闲显著增加微生物群落结构有益菌门相对丰度、菌属相对丰度;石灰氮消毒土壤处理显著增加微生物菌门的相对丰度。可以说明4 个处理均改变了黄瓜连作土壤细菌群落,改变效果为添加抗重茬生物菌肥处理>秸秆还田处理>小麦填闲处理>石灰氮消毒处理。
