黄酒中菌落总数测定不确定度评定
2022-06-16相露婷傅华靖王佳丽
相露婷,傅华靖,王佳丽,刘 镇
(绍兴市食品药品检验研究院,浙江绍兴 312000)
菌落总数是食品检验较为常见的检测项目。在实际检测中,样品中菌种总数的检测结果往往发散较大,而影响检测结果的因素也很复杂。因此,每个实验室都会对本实验室的菌落总数计数的能力进行考核验证。黄酒作为地理标志产品,其检测过程中对菌落总数并没有作出明确的规定,但微生物污染对于黄酒的生产和保存是非常关键的因素,在生产加工过程中对菌落总数的监测是必不可少的项目。因此,对菌落总数的检测不确定度评定是必不可少的。由于黄酒本身的特殊性质,其中含有的乙醇可能对菌落产生一定的抑制作用,从而影响菌落计数结果,所以此次对黄酒中菌落计数的不确定度进行评定非常重要且具有实际参考意义。
本次研究应用平板菌落计数法测量黄酒中的菌落总数,通过对影响测量结果的不确定度分量的分析和量化,求出被测定菌落总数的标准不确定度和扩展不确定度,并对测量结果进行表述。鉴于检测过程中黄酒本身含菌量较少,在实际实验样品中加入少于100 CFU 标准菌株作为污染菌,以便统计和分析研究。因此,在测定不确定度之前,还需测定该黄酒对不同菌种的抑制情况,从中选择影响较小的菌种进行不确定度评定。
1 材料与方法
1.1 材料与试剂
本次研究采用样品为市面上较为常见的传统型黄酒,酒精度为11.0%vol,酒龄3 年。菌种为大肠埃希氏菌ATCC25922、金黄色葡萄球菌ATCC6538、鼠伤寒沙门氏菌ATCC14028。营养肉汤培养基,生产厂家为青岛海博,批号20190531;平板计数琼脂,生产厂家为青岛海博,批号20200504;氯化钠,生产厂家为国药化工,批号20191106。
1.2 仪器与设备
JJ2000B 型电子天平,常熟市双杰测试仪器厂;ESCO class Ⅱ型生物安全柜,新加坡艺思高科技有限公司;MLS-3780 型高压蒸气灭菌器,日本三洋公司;HPP260 型生化培养箱,德国memmert 公司;BGZ-240 型电热鼓风干燥箱,上海博迅。
1.3 实验方法
1.3.1 菌液计数
取标准菌株大肠埃希氏菌、金黄色葡萄球菌、鼠伤寒沙门氏菌于营养肉汤培养基36 ℃培养24 h,将菌液制成10 倍系列稀释液,吸取1 mL 稀释液,每个稀释度做两个平皿。同时,分别吸取1 mL 稀释液加入2 个无菌平皿中,作为空白对照。使用平板计数(Plate Count Agar,PCA)培养基注皿。于36 ℃培养48 h,计数。上述菌液2 ℃冰箱冷藏保存,以保证菌液浓度维持在此水平。
1.3.2 回收率测定
选取菌落数量在500 ~1 000 CFU/mL 稀释度菌液,分别加入10 mL 黄酒中,混匀后按照《食品安全国家标准 食品微生物学检验菌落总数测定》(GB 4789.2—2016)[1]方法计数。同时以加入10 mL生理盐水作为对照组进行计数。培养基为平板计数琼脂,36 ℃培养48 h。
1.3.3 黄酒中菌落总数测定
根据回收率测定结果,选择回收率较高的菌液来污染黄酒菌株。将同一份黄酒样品分成11 份,每份50 mL,取稀释度适宜的菌液1 mL 加入每份样品中作为污染的黄酒样品。按照标准GB 4789.2—2016[1]方法,无菌环境下量取样品25 mL,置于盛有225 mL 无菌生理盐水的灭菌杯内,混匀,制成1 ∶10供试液。取上述供试液1 mL,沿管壁缓慢注于9 mL无菌生理盐水的试管中,混匀,制成1 ∶100 供试液。选择1 ∶10、1 ∶100 两个稀释度进行计数。取1 mL 样品匀液于无菌平皿中,每个稀释度做2 个平皿。同时,分别吸取1 mL 稀释液加入2 个无菌平皿中,作为空白对照。使用平板计数(Plate Count Agar,PCA)培养基注皿。于36 ℃培养48 h,计数,11 组菌落总数计数取稀释度为100的计数结果。
2 结果与分析
2.1 菌液计数结果
结果得到3 种菌液的浓度分别为大肠埃希氏8.3×108CFU/mL、金黄色葡萄球菌7.1×107CFU/mL、鼠伤寒沙门氏菌5.5×108CFU/mL,详见表1。

表1 菌液计数结果(单位:CFU/mL)
2.2 回收率测定结果
根据表2 的结果,可以看出,该黄酒样品对本次实验使用的3 种菌的抑菌作用基本都不大,但相较于金黄色葡萄球菌和鼠伤寒沙门氏菌,对大肠埃希氏菌的回收率影响更小,所以在之后的不确定度评定实验中选择大肠埃希氏菌作为本次评定的污染菌株进行研究。

表2 回收率测定结果(单位:CFU/mL)
2.3 黄酒菌落总数计数结果
11 份大肠埃希菌污染黄酒样品分析数据见表3。
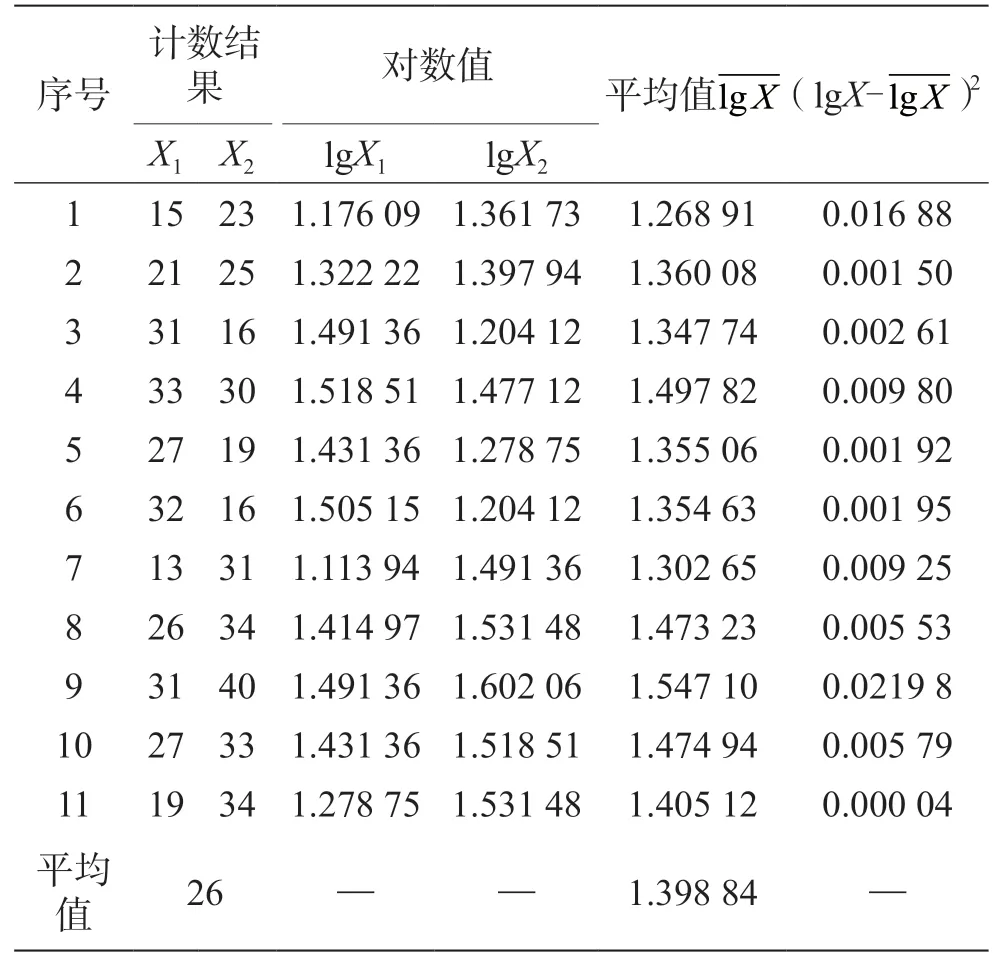
表3 11 组平行样测定结果(单位:CFU/mL)
3 不确定度评定
3.1 不确定度来源分析
在日常检验过程中影响菌落总数的检测结果的因素有很多,如检验人员、环境、时间、操作等都能对检验结果构成不同程度的影响。根据实际情况进行分析,将不确定度的来源分成系统误差(A 类)和随机误差(B 类)。A 类主要包括样品处理(稀释、称量、均匀度等)和仪器设备(移液器、培养箱、电子天平等),B 类主要包括重复测定过程中的测试环境、操作人员、培养条件(包括培养基、培养温度)等。而微生物学科属于非严格性、非度量学一类,A 类不确定度对合成不确定度贡献较小,重复测量带来的不确定度占主要部分[2]。因此,本次不确定度评定只考虑其重复性产生的不确定度,即对B 类误差的不确定度进行评定。
3.2 不确定度计算
3.2.1 实验重复性引入的不确定度
对11 份黄酒样品按照《食品安全国家标准 食品微生物学检验菌落总数测定》 (GB 4789.2—2016)进行检测,得到数据见表3。由于实际数据相差较大,按照取对数值的方式进行数据处理后再进行统计,结果见表3。
根据表3 数据,再利用贝塞尔公式,计算出样品标准差[3-5]:
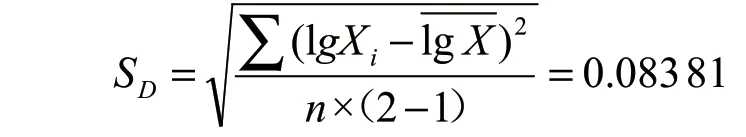
得到不确定度为:

3.2.2 扩展不确定度
取 置 信 水 平95%,v=11, 查t分 布 表,得k=t95(11)=2.201。故扩展不确定度U=kUc=2.201×0.059 3=0.130。
4 结论与讨论
当检验记录以11 次检验对数值的平均值表示时,其取值区间分布于-0.130 ~0.130,其对数值再取反对数,得取值区间分布。样品菌落总数lgx=lgX±0.130)。11 个样品检验结果平均值为26 CFU/mL,为1.398 84,该样品的菌落总数的lgx值为1.399±0.130,分布于1.269 ~1.529,取反对数,其结果分布于18.578 ~33.806 CFU/mL,即第11 个样品菌落总数的检验结果可估算为18 ~34 CFU/mL。
本次实验是按照食品微生物学检验标准来设计完成,符合国家标准要求对黄酒的检验方法。此次研究根据不同菌种在黄酒中的回收率选出受黄酒影响较小的菌株加入本身含菌量较少的黄酒中,从而模拟最可能的实际生产情况,提高了本次不确定度评定的可靠性。黄酒产品的日常检验中虽然没有特别针对菌落总数的限量要求,但是其生产过程有大量微生物繁殖,所以菌落总数是其出厂检验的常规项目。很多酒厂都有自己的微生物分析实验室,在进行菌落总数的不确定度评定时可以参考此法。此法也可用于对其他不同品类的样品进行不确定度评定,从而确保实验室检测结果的准确性和可靠性。
