小个头有大能量:微生物开启固定CO2新篇章
2022-06-16刘开放刘立明
刘开放 刘立明
CO是地球上最主要的温室气体,但同时也是自然界最为丰富的碳一资源(如CO、甲酸、甲醇等含有一个碳原子的物质,可当作资源被利用)。因此,若能发展高效的CO捕集和转化技术,将其转化成酯、醇、醚、酸等具有高应用价值和高经济效益的化学产品,温室效应等问题或将随之得到改善。
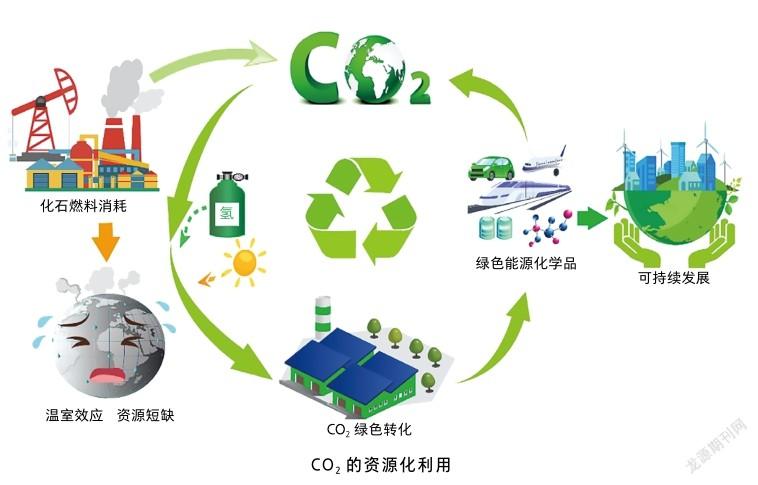
CO捕集和转化技术可分为物理、化学和生物3种。物理固定技术是对CO进行分离、收集和浓缩,再将其输送至地下或深海中实现储存,但很容易受地壳运动的影响,继而发生CO泄漏,造成新的生态问题。化学固定方法则是以CO为底物生产化工产品,或将其插入化学键中制备有机物,然而该过程会消耗大量的试剂,并产生多种新的副产物。而通过模拟植物光合作用开发的微生物细胞捕集和转化CO的技术体系,具有运行成本低、安全性高等特点,为CO高效封存提供了一种可持续发展的新方法。但要实现这一目标,核心在于改造微生物,进而直接利用CO和光能合成高值化学品,为此需要解决两个关键的科学问题:如何设计高效的CO固定途径,如何为CO固定提供充足的能量。
自然界存在着两大类固定CO的微生物,一类是自养型,另一类是异养型。
自养型固碳微生物具有完善的能量捕获系统,能利用CO为唯一碳源生长。根据能量捕获途径的不同,自养型微生物又可分为光能自养型和化能自养型。
光能自养型主要是微藻类、光合细菌和蓝藻等。其中,微藻的光能利用率可达10%~15%,每年可固定全球40%以上的CO,在碳循环中发挥重要作用;光合细菌能将CO转化为多种化合物,模式菌株包括类球红细菌、荚膜红菌和沼泽红假单胞菌等,每克菌体在单位小时内的固碳量可达12.4 毫克;蓝细菌具有较强的光合系统,能吸收广泛的太阳光波长,光能利用率可达10%以上,是陆生植物的10倍,模式菌株包括聚球藻、鱼腥藻和集胞藻等。
化能自养型微生物,如铁细菌、一氧化碳细菌、硫氧化细菌和硝化细菌等,则是通过氧化亚铁化合物、硫化氢、亚硝酸盐等有机物产生电子,再经过电子传递链产生三磷酸腺苷和还原态辅酶Ⅰ,驱动CO固定。
异养型固碳微生物主要利用自身的固碳酶来固定CO,具有生长速度快、易放大和遗传背景清晰等优点。科学家们在20世纪初就发现了戊糖丙酸杆菌中存在固碳途径,随后发现大肠杆菌、酿酒酵母和谷氨酸棒状杆菌等都具有一定的固碳能力。但是,天然异养微生物存在固碳效率低、能量供应不足等缺点,导致难以大规模应用。因此,通过合成生物学的技术手段改造异氧微生物,能显著提升其固碳能力,如工程化改造大肠杆菌BL21(DE3),可使其固碳效率与蓝藻相当;通过代谢工程改造酿酒酵母YSX4C222,可将固碳效率提高75倍。由此可见,微生物展现出强大的固碳潜力,在CO利用方面大有可为。
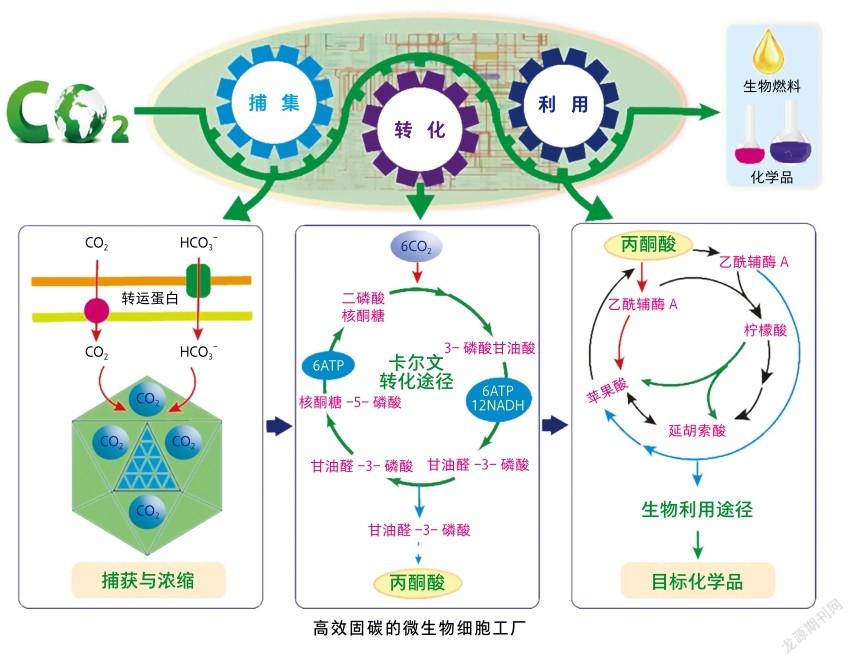
科学家们已经发现微生物中存在7条天然固碳途径,根据代谢特点和固碳种类可分为三大类。
第一类是磷酸戊糖途径相关的卡尔文循环。CO进入该循环,在酶和能量的催化驱动下形成糖。虽然它是最普遍的固碳途径,但关键酶二磷酸核酮糖羧化酶(Rubisco)存在效率低和易发生副反应等缺点。近几年来,随着关键酶Rubisco晶体结构被解析,结合计算机模拟和蛋白质改造策略,能显著提高其催化性能。2019年,这一途径被引入大肠杆菌中,获得了能同时利用CO和木糖的工程菌,随后利用适应性进化的方法,逐步消除工程菌对木糖的依赖,得到了仅利用CO为唯一碳源就能生长的自养菌[3]。
第二类是直接还原CO的还原乙酰辅酶A途径和还原性甘氨酸途径。它们都是首先将一部分CO还原为甲酸,然后再同化另一部分CO生成碳二化合物(如乙醇、乙醛和乙酸等含有两个碳原子的化合物)。但还原乙酰辅酶A途径是厌氧途径,限速酶分别是甲酸脱氢酶、一氧化碳脱氢酶和呋喃脱氢酶;而还原性甘氨酸途径则是耐氧途径,限速酶是甘氨酸裂解酶复合体。
第三类是靠近碳中心代谢的4条固碳循环途径:①能同时固定CO和HCO3?的二羧酸/4-羟基丁酸循环。它们先通过丙酮酸合酶固定1摩尔CO,再通过磷酸烯醇式丙酮酸羧化酶固定1摩尔HCO3?。由于其限速酶4-羥基丁酰辅酶A脱水酶中含有氧不稳定的铁硫中心,所以为厌氧途径;②仅固定HCO3?的3-羟基丙酸/4-羟基丁酸循环 和3-羟基丙酸循环。它们具有高耗能、长路径的特点,可通过乙酰辅酶A和丙酰辅酶A羧化酶固定HCO3?;③仅固定CO的还原三羧酸循环。含有3种不可逆的酶:富马酸还原酶、2-酮戊二酸合成酶和柠檬酸合成酶,其中,2-酮戊二酸合成酶是重要的固碳元件。该途径为低耗能的耐氧途径,能利用光能使每个循环固定CO。
上述7条天然路径由于反应复杂、效率较低等原因,难以满足实际需求。因此科学家们开始设计和构建人工固碳途径:①理论设计。借助生物信息学和基因组网络模型,通过计算路径反应的自由能、热力学和动力学等,评估路径可行性。②固碳元件选取。从BRENDA、KEGG和UNIPORT等数据库挖掘固碳路径中的固碳羧化酶和固碳还原酶,并进行生物化学和酶动力学测定。③固碳元件改造。通过体外和体内实验,确定固碳路径的限速酶,并对其进行蛋白质工程改造,提高固碳效率。④固碳路径构建。将最优固碳元件进行体内组装和优化,提高固碳途径的效率。
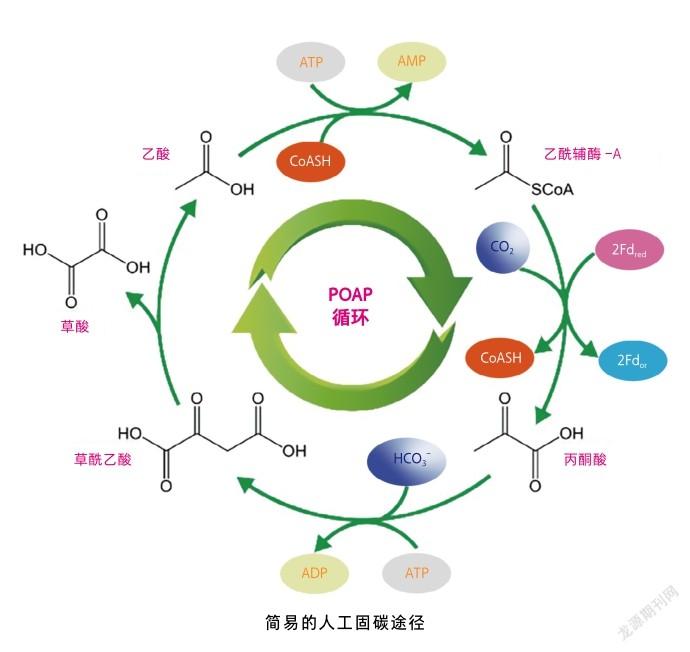
根据这些原则,国外科学家们以羧化酶为起点,筛选了17个固碳元件,构建了能量消耗减少40%而CO转化速率可提高两倍的循环途径。另有国内学者设计了一个可以在厌氧和50℃条件下固定CO的简易人工固碳循环(POAP循环),其反应过程仅需4种酶,实现了高效固碳。此外,还有研究者借助计算机辅助挖掘,设计了新型固碳途径,用于改善大肠杆菌的生长。为了将人工途径与微生物生产相偶联,笔者团队在大肠杆菌中设计和构建了一条产生ATP的苹果酸合成途径(PCK途径),通过耦合耗能的CO固定途径和产能的PCK途径,开发了能量平衡的苹果酸合成系统,使CO固定率提高了870%,苹果酸产量达到387毫摩尔每升[4]。
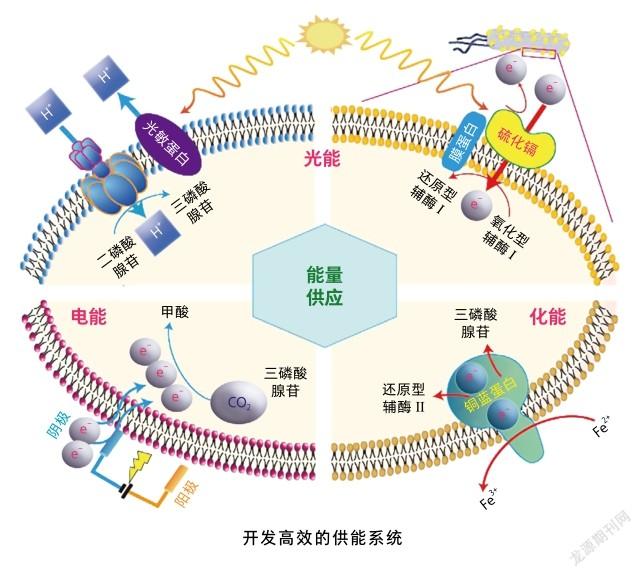
除了构建人工固碳途径外,给予充足的能量供应也是提高微生物固碳效率的關键瓶颈。为此,科学家们借助合成生物学的技术策略,分别针对自养和异养微生物发明了多种供能方法,以此提升CO的固定效率[6]。
对于光能自养型微生物,可通过改造捕光天线核心蛋白和构建新型纳米材料组成的捕光系统,增强光合作用的半饱和强度和光子捕获能力,提高光子转换为质子和电子的能力,促进能量产生。而对于化能自养微生物,主要通过改造膜相关氧化还原蛋白,如MtrB和CymA,以及过表达铜蓝蛋白等无机氧化酶,来提高电子产生和转移的效率,获得能量供应。对于电自养微生物(利用电能驱动碳固定,满足自身生长需要的微生物),则主要通过优化阴极电极的结构或开发钴磷合金或者铟箔等无机阴极催化剂,促进电子捕获并介导电子转移到微生物细胞中,强化能量产生。
异养微生物的能量主要来自有机物的分解代谢,因此,“开源节流”是提高能量供应的有效方法。研究者可通过提高底物水平磷酸化、增加胞内还原态辅酶Ⅰ供应和提高电子传递链产能效率等强化本源供能系统的策略,或者引入异源代谢途径、开发电化学系统和构建生物—杂合系统等外源能量供应系统来进行“开源”。笔者团队设计了自组装硫化镉捕光系统并应用于大肠杆菌中,在蓝光照射下,胞内还原态辅酶Ⅰ的含量提高62%,进而显著提升了CO的固定效率[7]。此外,“节流”能最大限度地减少非必需反应的能量消耗,包括用能耗少的代谢途径替代耗能高的代谢途径、抑制或者阻断耗能副产物的形成、删除非必需基因等,减少不必要的能量消耗,为异养微生物固定CO提供足够的能量供应。也有研究通过删除调控大肠杆菌鞭毛运动的62个基因,减少了大约20%的能量消耗,提高了CO的固定效率[8]。
微生物生产具有占地少、易控制和单位面积产能高等显著优势。借助合成生物学方法在微生物中构建的高效固定CO细胞“工厂”,可将CO转化为淀粉、蛋白质、燃料和材料单体等高价值产品,正所谓是小个头、多功能、大产业。
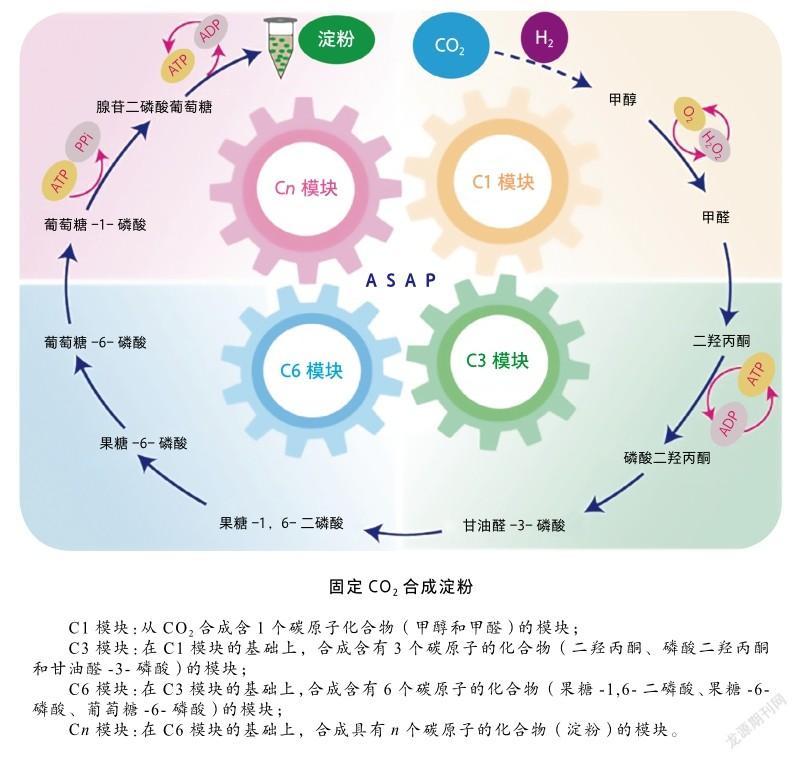
合成淀粉
植物通过光合作用固定CO生产淀粉的路径涉及60余步代谢反应,理论转化率仅为2%左右。我国科学家们从头设计,构建了由四大模块涉及11步反应的人工淀粉合成代谢途径(artificial starch anabolic pathway, ASAP),首次实现了从CO到淀粉分子的全合成。检测发现,人工合成的淀粉分子与天然淀粉分子的结构组成一致。实验室结果显示,人工合成淀粉的效率约为传统农业生产淀粉的8.5倍。在充足能量供给的条件下,按照目前技术参数,理论上1吨发酵罐年生产淀粉总量相当于我国5亩(1亩=666.7平方米)玉米地的年产淀粉量[9]。
合成蛋白质
当前,利用微生物固定CO合成蛋白质领域已有了长足进展。有研究院校同企业合作,突破了自然光合固碳的限制,以钢铁厂、电厂含CO和CO的尾气及氨水为原料,经乙醇梭菌发酵、离心、干燥后获得了一种新型乙醇梭菌蛋白质。其粗蛋白含量超过80%,必需氨基酸含量及其结构比例接近鱼粉蛋白,优于豆粕蛋白。目前,这一技术已实现万吨级蛋白产能,开辟了一条“低成本、非传统动植物资源生产优质蛋白质”的新途径。如果能在我国更多的钢铁企业、石化企业和煤炭加工厂推广应用,将是一场有效促进碳循环、碳利用和碳捕集的碳革命。
合成燃料
为了供应充足的燃料,科学家们已开发出利用微生物固定CO生产乙醇和生物柴油等燃料的技术。如在利用酿酒酵母发酵生产乙醇的过程中,每生成1分子乙醇就会释放1分子CO,造成大量碳损失。为此,科学家们将异源的磷酸核酮糖激酶和二磷酸核酮糖羧化酶导入酿酒酵母中构建卡尔文循环来固定CO,使乙醇产量提高了25%以上[10]。此外,研究者还将微藻置于生物反应器中,其吸收阳光和CO后可生成微藻生物质,经过加工转化成的生物柴油,热值是木材和农作物秸秆的1.5倍。
合成生物可降解塑料单体
通过代谢工程改造微生物,能替代石油路径合成生物可降解材料单体[11]。如琥珀酸是生物可降解塑料聚丁二酸丁二醇酯(PBS)的重要组成成分,年需求量超过300万吨。笔者团队借助合成生物学的方法,在高产琥珀酸的大肠杆菌中引入高效的CO捕集元件、CO转化路径和光能驱动系统,构建了高效利用CO生产琥珀酸的碳负性细胞,实现了从化学工艺每生产1吨琥珀酸释放1.66 吨CO,到每生产1吨琥珀酸吸收1.63吨CO的转变,开辟了温室气体利用的新途径。
综上所述,通过解析微生物浓缩和捕集CO的分子机理,理性设计高效的CO固定途径,构建新型能量供应系统,创制捕获CO转化生产有规模化市场需求的燃料、化工产品或建筑材料的“碳负性”人工细胞,是建立以CO为原料的工业生物转化新路线,减少对石油资源和耕地需求,缩短工艺流程,降低生产成本,有助于我國在新一轮国际竞争中赢得先机的重要策略,为实现“碳达峰”“碳中和”的目标提供微生物解决方案。
[本文相关研究受江苏省前沿引领技术基础研究专项(BK20212013)资助。]
[1]Liu Z, Wang K, Chen Y, et al. Third-generation biorefineries as the means to produce fuels and chemicals from CO. Nature Catalysis, 2020, 3(3): 274-288.
[2]Liang B, Zhao Y, Yang J. Recent advances in developing artificial autotrophic microorganism for reinforcing CO fixation. Frontiers in Microbiology, 2020, 11(6): 542-556.
[3]Gleizer S, Ben-Nissan R, Bar-On Y M, et al. Conversion of Escherichia coli to generate all biomass carbon from CO. Cell, 2019, 179(6): 1255-1263.
[4]Hu G, Zhou J, Chen X, et al. Engineering synergetic CO-fixing pathways for malate production. Metabolic engineering, 2018, 47: 496-504.
[5]Schwander T, von Borzyskowski L S, Burgener S, et al. A synthetic pathway for the fixation of carbon dioxide in vitro. Science, 2016, 354(6314): 900-904.
[6]Wu H, Li Y, Ma Q, et al. Metabolic engineering of Escherichia coli for high-yield uridine production. Metabolic engineering, 2018, 49: 248-256.
[7]Hu G, Li Z, Ma D, et al. Light-driven CO sequestration in Escherichia coli to achieve theoretical yield of chemicals. Nature Catalysis, 2021, 4(5): 395-406.
[8]Qiao J, Tan X, Huang D, et al. Construction and application of an Escherichia coli strain lacking 62 genes responsible for the biosynthesis of enterobacterial common antigen and flagella. Journal of Agricultural and Food Chemistry, 2021, 69(14): 4153-4163.
[9]Cai T, Sun H, Qiao J, et al. Cell-free chemoenzymatic starch synthesis from carbon dioxide. Science, 2021, 373(6562): 1523-1526.
[10]Li Y J, Wang M M, Chen Y W, et al. Engineered yeast with a CO-fixation pathway to improve the bio-ethanol production from xylose-mixed sugars. Scientific Reports, 2017, 7(5): 384-396.
[11]Meng J, Wang B, Liu D, et al. High-yield anaerobic succinate production by strategically regulating multiple metabolic pathways based on stoichiometric maximum in Escherichia coli. Microbial Cell Factories, 2016, 15(1): 141-148.
关键词:微生物 固碳 温室气体 碳中和 ■
