胰蛋白酶催化罗丹明110双酰胺衍生物荧光酶联免疫吸附方法检测桔青霉素
2022-06-15邹回聂丽娟熊勇华李响敏
邹回,聂丽娟,熊勇华,李响敏*
1(南昌大学 食品科学与技术国家重点实验室,江西 南昌,330047)2(南昌大学 中德联合研究院,江西 南昌,330047)
桔青霉素(citrinin,CIT)是一种由青霉属(Penicillium)、曲霉属(Aspergillus)和红曲霉属(Monascus)中的部分菌株产生的聚酮类真菌毒素,其主要存在于储存的谷物中[1]。特别在气候较炎热的国家生产的谷物,CIT的污染是一个严重问题[2]。谷物产品和其他具有药用价值的植物在生长、收获、运输和储存过程中可能会被产生CIT的真菌污染[3-4]。当处理和储存条件没有得到严格控制时,水果也易被CIT污染而造成重大损失。根据调查,工业化国家的作物收获后损失约为25%,其他国家超过50%[5]。而且CIT被证明对动物具有较强的肾毒性以及潜在的遗传毒性、胚胎毒性[6]和致畸性[7]。鉴于其对人类健康及经济发展的危害,开发一种灵敏、快速的CIT检测方法显得非常重要。日本厚生省在2000年版的“日本食品添加剂标准”中率先制定出红曲色素中CIT限量标准为0.2 mg/kg,这一标准是当时能够检出的CIT的最低剂量[8],欧盟规定CIT在红曲霉发酵的大米补充剂中的限量标准为2 mg/kg,中国台湾省制定的《食品中真菌毒素限量标准》规定了食品中CIT的限量,其中红曲色素中CIT的限量为0.2 mg/kg、原料用红曲米的限量为5 mg/kg以下,使用红曲原料制成的食品为2 mg/kg以下[8]。目前在中国大陆地区,还没有建立不同农产品中CIT含量的控制指标。
目前,CIT检测可用的分析方法有薄层色谱法[9]、高效液相色谱法(HPLC)[10]、液相色谱串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)[11]、超高效液相色谱和荧光检测法[12]、气相色谱质谱法[13]和酶联免疫分析法(enzyme-linked immunosorbent assay,ELISA)[14]。薄层色谱法虽然操作简单,但是准确性和特异性较差;HPLC等仪器检测方法虽然灵敏度和稳定性较高,但样品前处理操作较为复杂,且需要专业的大型仪器和检测场所,不能满足食品安全快速检测要求。ELISA作为一种灵敏度高、高通量、设备简单、成本低的样品筛查和定量方法,近年来得到了迅速发展和广泛应用。基于辣根过氧化物酶(horse radish peroxidase,HRP)催化底物的比色ELISA法存在灵敏度低、抗基质干扰能力差的局限性。荧光酶联免疫分析法(fluorescein-linked immunosorbent assay,FELISA)与现有的分析平台兼容性良好,被认为是目前有害食源性物质筛选最敏感的方法之一[15-16]。在过去的几十年里,已开发出多种具有高灵敏度的FELISA用于检测目标分子,包括基于碱性磷酸酶的化学发光免疫检测[17]、基于HRP的化学发光免疫检测[18]、基于过氧化氢酶的荧光免疫检测[19]、基于人α凝血酶的荧光免疫检测[20]等,具有更广泛的应用前景。因此,建立一种具有高灵敏度的FELISA方法用于谷物中CIT的定量检测具有较大的应用前景。
胰蛋白酶(trypsin)是一种高特异性的丝氨酸蛋白水解酶,对于含精氨酸(Arg)位点的肽段表现出非常高的水解催化性能[21]。基于trypsin的这个特性,研究人员设计并合成了含氨基保护基的三肽Cbz-Ile-Pro-Arg-OH,再通过酰化反应将Arg的羧基与罗丹明110分子中的2个氨基缩合形成双酰胺底物(Cbz-Ile-Pro-Arg)2-R110,用于trypsin的催化能力测定[22]。在trypsin的催化下,连接在罗丹明110分子两端的酰胺键迅速发生水解断裂,具有微弱荧光的罗丹明110双酰胺底物转变为具有强荧光的罗丹明110分子,荧光信号强度可以得到极强的提高[23]。本研究通过将trypsin和罗丹明110双酰胺底物引入到FELISA中,克服实际样本的基质干扰,以实现检测灵敏度提高的目的。
本研究通过甲醛加成法[24]合成了trypsin-CIT,并将其引入到FELISA信号生成系统实现CIT的快速检测。其原理如图1所示,trypsin-CIT可通过抗原-抗体相互作用被固定在酶标孔中,选择trypsin替代常用的HRP作为标记酶,并且选用仅存在极低荧光的罗丹明110双酰胺衍生物作为trypsin的催化底物。通过CIT与trypsin-CIT对其抗体的竞争关系,被固定下来的trypsin催化罗丹明110双酰胺衍生物裂解而触发荧光信号的产生,实现对CIT的快速检测。本研究与传统ELISA的HRP-TMB显色体系进行了对比,显示出较高的分析灵敏度,并将其应用于检测玉米样本,验证了本方法的检测性能和稳定性。

图1 Trypsin催化的罗丹明110双酰胺荧光底物 ELISA方法检测CITFig.1 Trypsin-catalyzed rhodamine 110 bis-amide fluorescent substrate ELISA method for the detection of CIT
1 材料与方法
1.1 材料与仪器
胰蛋白酶、链球菌蛋白G, 美国Sigma-Aldrich公司;(Cbz-Ile-Pro-Arg)2-R110赛默飞世尔科技公司; CIT, Fermentek公司;抗CIT腹水, 南昌大学中德联合研究院;脱脂乳, 广东赛国生物科技有限公司;甲醇(色谱纯、分析纯)及常见试剂(分析纯),西陇科学分有限公司;96孔酶标板, Costar公司。
Waters H CLASS/XEVD TQD, 美国沃特世公司;桔青霉素免疫亲和柱, 北京华安麦克生物技术有限公司;Varioskan LUX多功能酶标仪, 赛默飞世尔公司;超纯水仪, 美国密里博公司。
1.2 trypsin-CIT与HRP-CIT的制备
将5.7 mg trypsin溶解于2 mL浓度为1 mmol/L的HCl(pH 3)中,随后向其中逐滴加入10 mg/mL的CIT甲醇溶液100 μL,混合均匀后加入200 μL体积分数为37%甲醛溶液,37 ℃搅拌反应24 h,即得到trypsin-CIT,同样CIT与HRP反应得到HRP-CIT,反应结束后,置0.01 mol/L PBS中4 ℃透析72 h。
1.3 trypsin催化的荧光底物浓度
罗丹明110双酰胺荧光底物的浓度对于trypsin催化的FELISA信号强度有着较大影响,因此本研究测定了在相同trypsin质量浓度(400 ng/mL)条件下,荧光底物浓度与trypsin浓度的变化规律,获得最佳目标底物浓度。
1.4 trypsin催化的FELISA检测流程
将链球菌蛋白G(proteinG)用PBS(pH 8.6)稀释至25 μg/mL,每孔100 mL,4 ℃过夜包被,去除孔内液体,用含0.05%吐温-20的磷酸缓冲液进行洗板,重复3次,用PBS(pH 7.4)将抗CIT腹水稀释至20 μg/mL,每孔100 μL,37 ℃孵育1 h后洗板,加入300 μL 1%脱脂乳溶液,37 ℃孵育1 h,加入50 μL质量浓度为5.5 μg/mL的trypsin-CIT和50 μL的待测液,37 ℃孵育30 min后洗板,加入浓度为0.312 5 μmol/L的罗丹明双酰胺底物,37 ℃孵育30 min后测定激发波长为498 nm,发射波长为521 nm时的荧光强度。
1.5 trypsin催化的FELISA的精密度与准确性评价
分别通过LC-MS/MS和FELISA的方法对加标的阴性玉米样本进行分析,随后根据GB 5009.222—2016《桔青霉素测定》中的样本提取方法:称取10.0 g加有CIT的玉米样本于锥形瓶中,加入50 mL体积分数70%的甲醇水溶液,在涡旋振荡2 min,5 000 r/min离心,取上清液用快速定性滤纸过滤后待检测。取上清液用0.01 mol/L PBS稀释7倍后,进行FELISA检测;另取1 mL上清液加入49 mL 0.01 mol/L磷酸溶液(pH 7.5)混匀,用微纤维滤纸过滤后取20 mL上述溶液过免疫亲和柱净化,将其以1~2滴/s的流速全部通过亲和柱,再将5 mL 0.01 mol/L磷酸溶液(pH 7.5)也以1~2滴/s的流速通过亲和柱,待液体排干后,用2 mL甲醇以1滴/s的流速进行洗脱,洗脱液收集至样品瓶中用于LC-MS/MS分析。
2 结果与讨论
2.1 trypsin催化的荧光底物浓度
根据图2-a可得,在trypsin质量浓度固定于400 ng/mL条件下,随着底物浓度升高,trypsin催化底物产生的荧光信号也逐渐升高。结合荧光信号强度,底物浓度为0.156 μmol/L时具有明显的荧光信号,故选择了0.156 μmol/L为本实验的最终底物浓度。
2.2 trypsin-CIT与trypsin催化性能对比
在0.156 μmol/L底物浓度下,绘制trypsin、trypsin-CIT浓度与荧光强度关系曲线,如图2-b所示,trypsin和trypsin-CIT质量浓度为25 ng/mL时,trypsin-CIT催化产生的荧光强度为35.42,trypsin催化产生的荧光强度为16.68,可推得酶活损失52.91%。
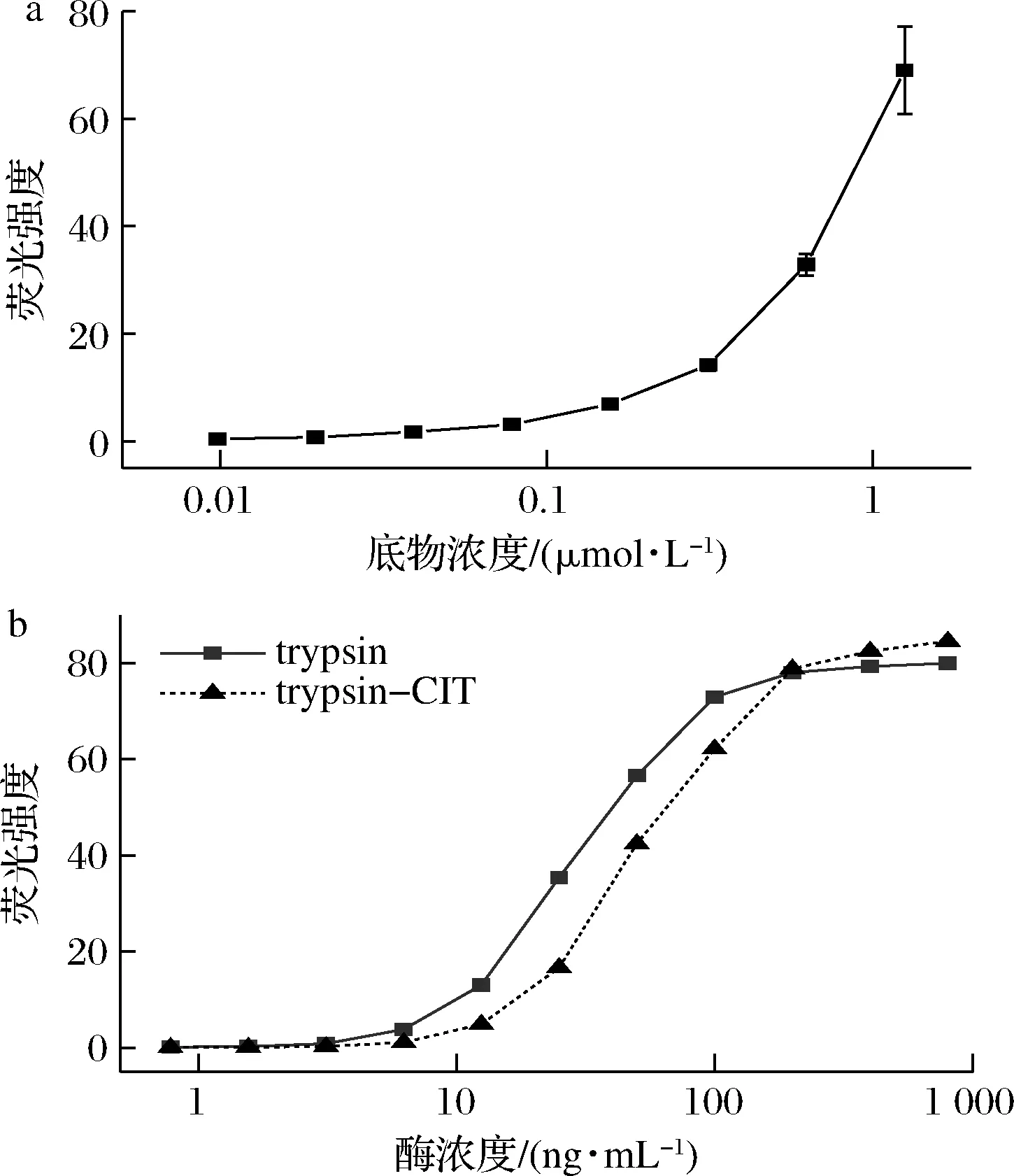
a-trypsin(400 ng/mL)条件下底物浓度与荧光强度关系; b-trypsin、trypsin-CIT浓度与荧光强度关系图2 底物浓度及不同酶浓度对荧光强度的影响Fig.2 Effect of substrate concentration, trypsin and trypsin-CIT concentration on fluorescence intensity
2.3 trypsin催化的荧光ELISA的检测条件优化
实验优化了包被腹水浓度、trypsin-CIT浓度、pH、甲醇浓度、NaCl浓度、免疫孵育时间和酶催化时间等影响FELISA的几个关键参数,以获得高灵敏度和强荧光信号。
包被抗体和trypsin-CIT的浓度被认为是影响直接竞争ELISA检测灵敏度的最重要因素。为了提高CIT抗体的生物活性,本实验预先将proteinG包被在酶标板上,定向捕获CIT抗体的Fc片段,从而提高CIT抗体的生物活性。因此本实验设置腹水质量浓度为80、40、20、10 μg/mL和trypsin-CIT质量浓度为22、11、5.5、2.75 μg/mL进行正交实验,结果如表1,通过(F为阴性条件下的荧光值,F0为50 ng/mL加标条件下的荧光值)反映本方法对CIT的检测灵敏度,并基于F与F0的最大差值与B0的最高值原则选择最佳腹水浓度与trypsin-CIT浓度,根据最佳信号显示,包被腹水质量浓度为20 μg/mL、trypsin-CIT质量浓度为5.5 μg/mL是最佳条件。

表1 棋盘滴定法优化包被腹水浓度和trypsin-CIT浓度Table 1 Optimized coated ascites concentration and trypsin-CIT concentration by a checkboard titration method
pH、甲醇浓度、NaCl浓度能够通过改变抗原抗体结合位点的活性来影响抗原抗体反应,本实验通过B0=(1-F/F0)×100(F为阴性条件下的荧光值,F0为50 ng/mL加标条件下的荧光值)反映加入标准品后的抑制结果,当B0值越大时,表示本方法对于CIT的检测灵敏度越高。如图3-a所示,在pH 6.5时,B0达到最大值,为最佳pH条件。由于CIT分子具有很强的疏水性,为实现对样本中CIT的高回收率提取,需要用含有一定体积分数甲醇的样本提取液,但是待检测溶液中的甲醇体积分数过高时,抗原抗体的反应会受到极大干扰,因此,研究了含不同体积分数甲醇的待检测溶液进行反应的检测结果,如图3-b所示,当甲醇体积分数升高时,B0会逐渐下降,且在甲醇体积分数>10%时B0从34.09%降至15.55%,基于这一结果,本实验选择甲醇体积分数为10%为免疫检测最佳条件。在免疫反应过程中,一定浓度的NaCl有利于抗原抗体的相互作用,如图3-c所示,随着NaCl浓度的升高,B0也逐渐升高,且当NaCl浓度达到80 mmol/L时,B0达到最高值。为了评价免疫孵育时间和酶催化时间对B0的影响,设置了不同免疫孵育时间(15~75 min)和不同酶催化时间(10~60 min)作为反应条件,30 min是免疫孵育时间最佳条件(图3-d),酶催化时间达到30 min后,B0进入平台期(图3-e),因此最佳酶催化时间为30 min。
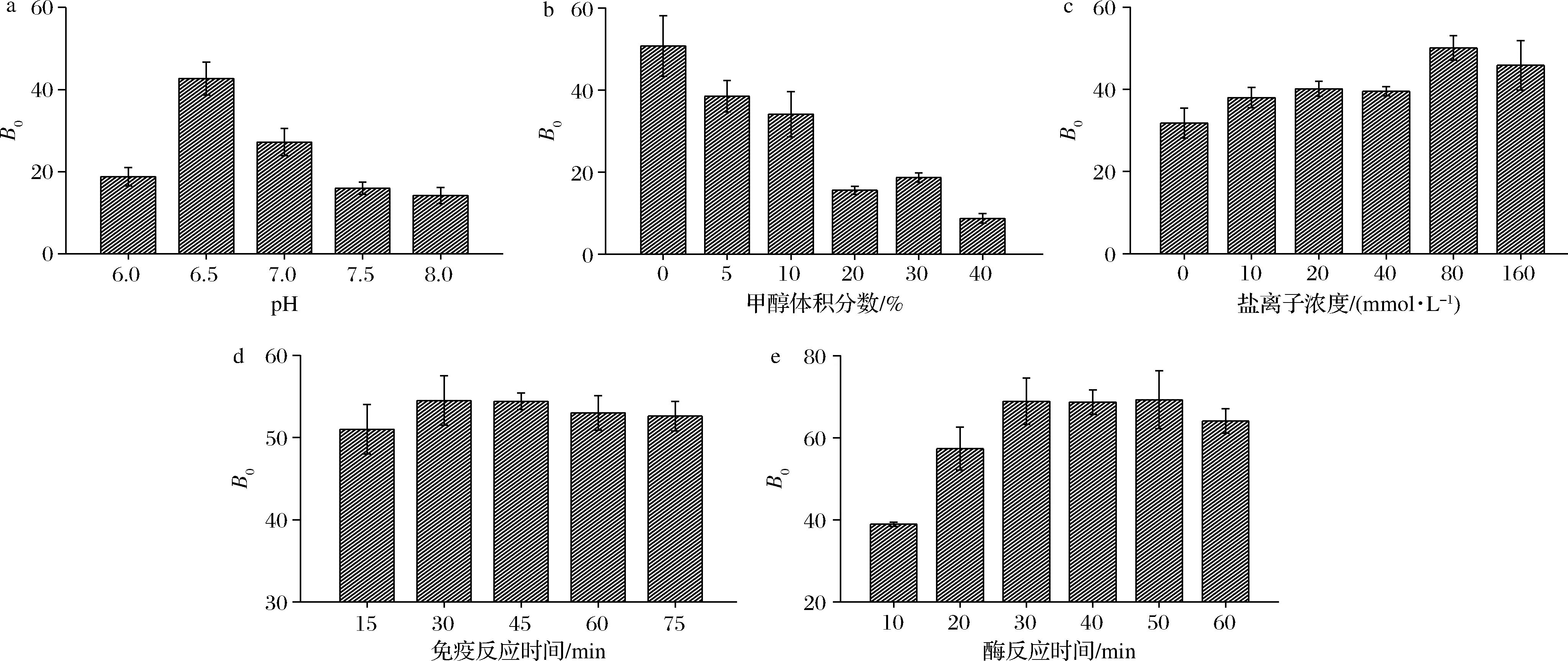
a-pH;b-甲醇体积分数;c-NaCl浓度;d-免疫孵育时间;e-酶催化时间图3 Trypsin催化的FELISA检测条件优化Fig.3 Optimization of FELISA detection conditions catalyzed by Trypsin
2.4 trypsin催化的FELISA检测性能评价
以CIT浓度为横坐标,B0为横坐标绘制定量曲线(图4-a),随着溶液中的CIT质量浓度从1.56~6 400 ng/mL,B0逐渐增加,且在CIT质量浓度为12.5~400 ng/mL时,B0随CIT浓度增加呈线性增加关系,其定量可用方程y=18.606 lnx-18.713(R2=0.992),检测灵敏度IC20为8.01 ng/mL,IC50为40.16 ng/mL,为了与基于HRP-CIT的传统比色ELISA检测性能对比,设置腹水质量浓度为80、40、20、10 μg/mL,HRP-CIT质量浓度为80、40、20、10 μg/mL进行正交实验同样优化了二者浓度,结果如表2,根据竞争抑制率B0=(1-OD阴性/OD阳性)×100(OD阴性为阴性条件下的吸光度,OD阳性为加标200 ng/mL条件下的吸光度),由最高竞争抑制率所对应的条件得出最佳腹水质量浓度为40 μg/mL,HRP-CIT质量浓度为40 μg/mL,同时基于此条件构建了基于HRP-CIT的传统比色ELISA,并绘制了其定量曲线(图4-b),其定量可用方程y=13.476 lnx-11.975(R2=0.971 2),检测灵敏度IC20为10.73 ng/mL,IC50为110.08 ng/mL,对比可得,本实验构建的FELISA检测灵敏度是传统比色ELISA的1.34倍,IC50是传统比色ELISA的2.741倍。
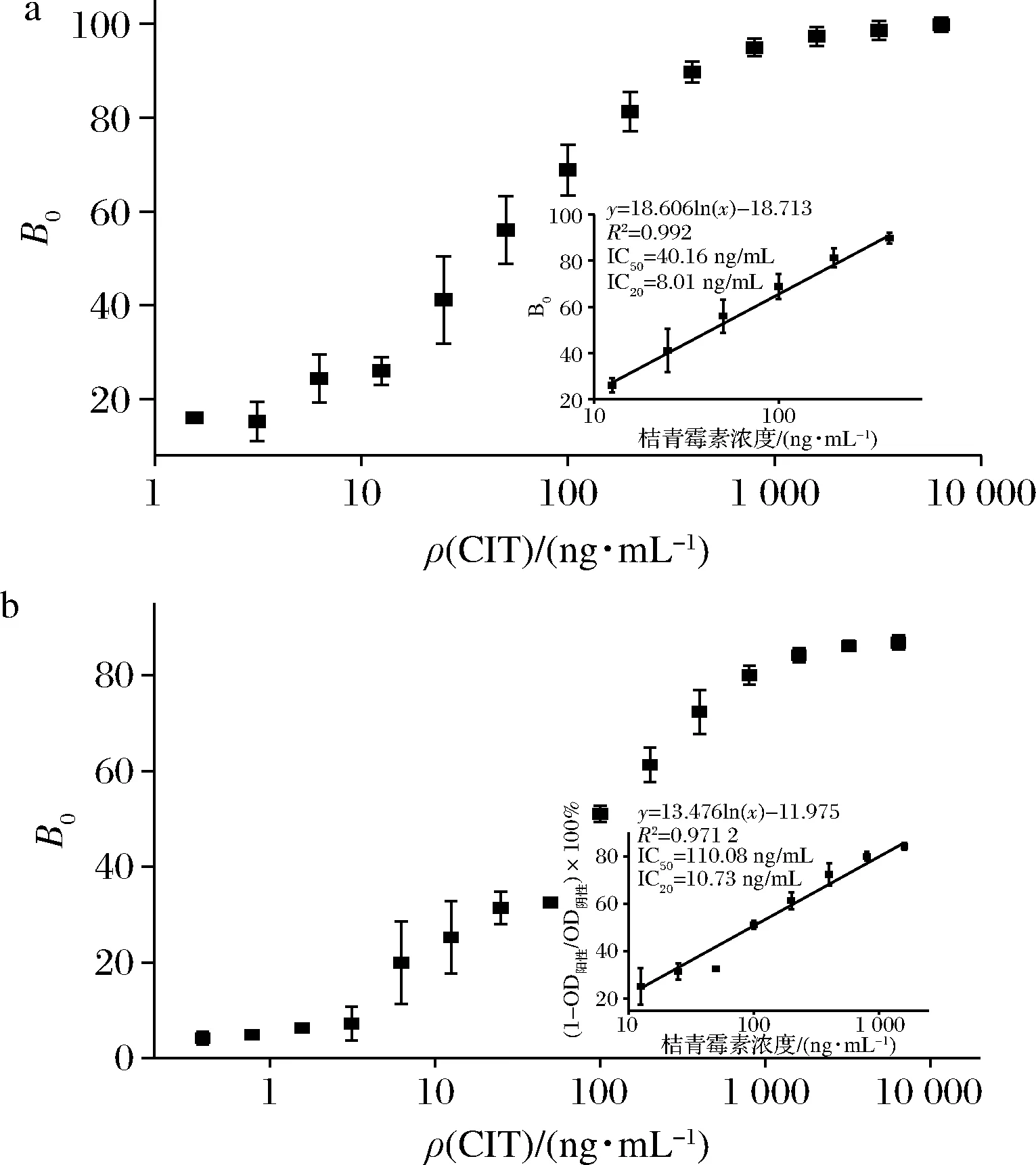
a-trypsin催化的FELISA检测CIT定量曲线; b-HRP催化的比色ELISA检测CIT定量曲线图4 Trypsin催化的FELISA与HRP催化的比色 ELISA检测性能比较Fig.4 Detection efficacy of FELISA catalyzed by trypsin and colorimetric ELISA catalyzed by HRP

表2 棋盘滴定法优化包被腹水浓度和HRP-CIT浓度Table 2 Optimized coated ascites concentration and HRP-CIT concentration by a checkboard titration method
用本方法进一步检测质量浓度为1 μg/mL的常见真菌毒素CIT、脱氧雪腐镰刀菌烯酮(deoxynivalenone,DON)、玉米赤霉烯酮(zearalenone,ZEN)、黄曲霉毒素B1(aflatoxin B1,AFB1)、黄曲霉毒素B2(aflatoxin B2,AFB2)、黄曲霉毒素G1(aflatoxin AFG1,AFG1)和伏马毒素B1(fumonisin B1,FB1),结果如图5所示,与常见真菌毒素无明显的交叉反应,表明本方法检测CIT具有较好的特异性。
为了评价该方法检测实际样本的可行性,将不同质量浓度的CIT添加至玉米样本中,加标量分别为3.5、1.75、0.88、0.22 mg/kg,结果如表3,FELISA批内回收率分别为97.05%、98.97%、110.58%、90.94%,批间回收率分别为90.10%、109.11%、101.63%、93.46%,且批内、批间测定的标准偏差值均小于15%。检测结果与液相色谱串联质谱法作为参考方法进行对比,表4结果显示trypsin催化的FELISA检测结果与LC-MS/MS结果具有良好的一致性。以上结果表明,trypsin催化的FELISA具有良好的回收率和准确性,可对玉米样本中的CIT进行定量检测。

图5 Trypsin催化的FELISA特异性分析Fig.5 FELISA specific analysis catalyzed by trypsin
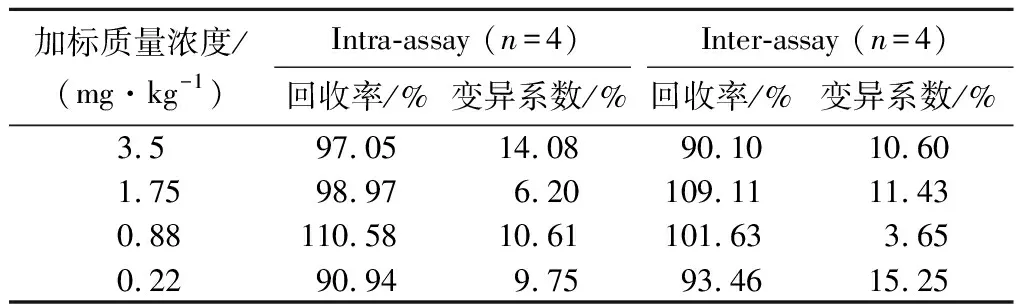
表3 Trypsin催化的FELISA检测不同浓度CIT的 重现性与精密度Table 3 Reproducibility and precision of FELSA catalyzed by Trypsin in detecting CIT at different concentrations
3 结论
本研究基于trypsin催化罗丹明110双酰胺荧光底物的特性,结合CIT和CIT标记的trypsin与CIT抗体的相互竞争作用关系,建立了一种FELISA方法用于检测玉米中的CIT。在最佳条件下:抗CIT腹水质量浓度20 μg/mL、trypsin-CIT质量浓度为5.5 μg/mL、pH 6.5、甲醇体积分数10%、NaCl浓度80 mmol/L、免疫反应时间30 min、酶催化时间30 min,该方法检测CIT的最低灵敏度可达8.01 ng/mL,IC50可达40 ng/mL,是HRP催化的比色ELISA检测灵敏度的1.34倍,IC50的2.741倍,此外,该方法具有良好的特异性、重现性和精密度。如果使用CIT的单克隆抗体,检测灵敏度还可以更高,为更快速、灵敏定量检测CIT提供了新的选择。
