生姜细胞外囊泡样纳米粒载吴茱萸碱的处方工艺及体外释药研究
2022-06-15赵梦刘卓雅于嘉敏王芮范铭婕乔宏志
赵梦,刘卓雅,于嘉敏,王芮, 范铭婕,乔宏志,3
(1.南京中医药大学药学院,江苏 南京 210023;2.江苏省中药功效物质重点实验室,江苏 南京 210023;3.江苏省中药高效给药系统工程技术研究中心,江苏 南京 210023)
吴茱萸碱(Evodiamine,EVO)是芸香科植物吴茱萸、石虎和疏毛吴茱萸的干燥近成熟果实中的主要生物碱成分,具有抗肿瘤、抗胃溃疡、抗炎、抗肥胖等多种药理活性[1],但存在水溶性差、生物利用度低等弊端。为了克服上述问题,研究人员制备了脂质体[2-4]、脂质纳米粒[5]等脂基新制剂,均显示出对EVO成药性的改善作用。
近年来,从多种植物鲜榨汁中分离到一种以脂质双层为基本骨架,包含蛋白、核酸等活性成分的泡状纳米结构,被命名为细胞外囊泡样纳米粒(Extracellular vesicle-like nanoparticles,EVNs)[6]。EVNs保留了原植物的组成和活性功能,在肿瘤、肠炎、酒精肝、肺纤维化等疾病的治疗方面有明显疗效[7]。此外,从EVNs提取的脂质还可用于装载亲疏水小分子药物及核酸药物等[8-10],发挥载体作用。例如将6-姜烯酚载入生姜EVNs来源脂质后,可减缓释药速度,提高生物利用度,用于治疗结肠炎[11]。有报道显示EVNs来源的脂质还具有特定的转运趋向性,可以引导药物到达特定的部位。例如生姜EVNs脂质中含有的磷脂酸与EVNs在肠道的积累相关,磷脂酰胆碱促进EVNs从肠道向肝脏转移[12];用葡萄柚EVNs脂质制备的纳米粒能携带JSI-124靶向抑制肿瘤生长[9]。
生姜是常见的药食同源中药,生姜来源的EVNs对结肠炎[13]、牙周炎[14]、酒精性肝损伤[15]等多种疾病有效。目前已有研究通过脂质谱学分析,证明生姜来源EVNs中含有多种脂质成分,例如磷脂酸(PA)、双半乳糖甘油二酯(DGDG)、单半乳糖甘油二酯(MGDG)、磷脂酰胆碱(PC)、磷脂酰肌醇(PI)等[16]。本文以生姜来源EVNs为对象,提取其脂质用于EVO的装载,将考察脂质提取条件、载EVO脂质体(EVO@Lipo)的工艺影响因素及体外释药行为,以期改善EVO成药性,考察生姜EVNs来源脂质的载释药性能。
1 材料与方法
1.1 仪器
美的MJ-WJE2802D榨汁机(美的集团有限公司);Optima XP1超速离心机(美国Beckman Coulter公司);Regulus 8100扫描电子显微镜(日本日立公司);Eppendorf低温台式离心机(德国Eppendorf公司);NanoSight NS300纳米颗粒跟踪分析仪(英国Malvern公司);Zetasizer Nano-ZS90(英国 Malvern公司);BT 25S十万分之一天平、Waters E2695 HPLC(美国Waters公司);THZ-C恒温震荡箱(苏州培英公司);JY96-ⅡN超声波细胞粉碎机(宁波新芝生物科技股份有限公司);PB-10标准型pH计(德国Sartorius公司);DSC 214差示扫描量热仪(德国耐驰);红外分光光度计(美国Thermo公司);Milli-Q纯水系统(美国Millipore公司)。
1.2 试剂
鲜生姜购于山东潍坊,经南京中医药大学中药资源教研室胡杨老师鉴定为姜科植物姜ZingiberofficinaleRosc.的新鲜根茎;甲醇、乙醇、丙酮、三氯甲烷、乙腈、二氯甲烷(分析纯,国药集团化学试剂有限公司);8 000~14 000 Da透析袋、吴茱萸碱(上海源叶生物科技有限公司,吴茱萸碱分子量:303.36,批号:X26A8P34704,纯度>98%);乙腈(色谱纯,美国默克公司);10×PBS缓冲液干粉(pH 7.4,南京迈博生物科技有限公司);0.45 μm微孔滤膜(南京迈博生物科技有限公司);ODS-2 C18柱(江苏汉邦科技有限公司)。
1.3 EVNs分离和表征
采用差速离心法提取EVNs,将生姜清洗干净,榨汁,汁液加入相同体积的1×PBS缓冲液(pH 7.4),置于离心管中4 000×g离心1 h,去除大块组织,取上清,10 000×g离心1 h,离心后取上清,120 000×g超高速离心2 h,将下层沉淀用适量PBS分散得到EVNs,用浓度为8%、30%、45%、60%的蔗糖进行密度梯度离心,120 000×g超高速离心2 h,收集条带,置于4 ℃保存备用。
取EVNs稀释后采用纳米颗粒跟踪分析仪(NTA)测定粒径,动态光散射仪(DLS)测定多分散系数(PDI)及Zeta电位,并将EVNs烘干,喷金镀膜后,使用扫描电子显微镜(SEM)观察EVNs的形貌。
1.4 脂质提取和溶剂筛选
取1 mL EVNs(1×1010mL-1),加入有机溶剂3.75 mL,涡旋混匀后再加入有机溶剂和水各1 mL,混匀,22 ℃下2 000 r·min-1离心10 min[16],取有机层旋转蒸发溶剂得到干燥脂膜,称质量。以脂质与EVNs干质量的比值计算脂质提取率。
以脂质提取率、脂质体粒径和浓度为指标,筛选脂质提取的最适溶剂。选取的有机溶剂分别为:三氯甲烷、乙醇-三氯甲烷、丙酮-三氯甲烷、甲醇-三氯甲烷、二氯甲烷、甲醇-二氯甲烷、乙醇-二氯甲烷-乙醇、乙腈-二氯甲烷、乙腈-三氯甲烷、二氯甲烷-三氯甲烷,丙酮-二氯甲烷共11组,其中混合溶剂的比例均为2∶1。
1.5 EVO体外分析方法建立
1.5.1 色谱条件 色谱柱:ODS-2 C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈-水(55∶45,v/v);检测波长:225 nm;柱温:25 ℃;流速:1.0 mL·min-1;进样量:20 μL。
1.5.2 专属性考察 称取处方量的脂质,制备空白脂质体(Lipo)及EVO@Lipo,取1 mL至10 mL容量瓶中,加入三氯甲烷-甲醇(1∶1,v/v)超声破乳,并稀释定容至10 mL,15 000 r·min-1离心15 min,取上清及EVO对照品溶液各20 μL进样分析。
1.5.3 标准曲线 以甲醇为溶剂,制备浓度为1、5、10、20、100 μg·mL-1的EVO对照品溶液,15 000 r·min-1离心15 min,取上清按色谱条件测定,以药物浓度为横坐标,峰面积为纵坐标,制作标准曲线。
1.6 EVO@Lipo的制备与包封率测定
取0.2 mg EVO及脂质溶于甲醇-三氯甲烷中,超声溶解,于37 ℃真空旋转蒸发至溶剂挥干,形成干燥薄膜,向烧瓶中加入1 mL超纯水,超声水化,探头超声(工作1 s,间歇1 s),空白脂质体的制备方法除不加入EVO外,其余步骤与条件相同。
取1 mL EVO@Lipo溶液,过0.45 μm滤膜,取过膜后的液体1 mL,加入1 mL三氯甲烷-甲醇(1∶1,v/v)超声破乳,置于10 mL容量瓶中,用甲醇稀释定容,随后15 000 r·min-1离心15 min,取上清测定含量,得到其质量记为WLipo。取脂质体1 mL,加入1 mL三氯甲烷超声破乳,置于10 mL容量瓶中,用甲醇稀释定容,15 000 r·min-1离心15 min,取上清测定含量,得到其质量记为WTotal。包封率(Encapsulation efficiency,EE%)按下式计算:
1.7 处方及制备工艺优化
1.7.1 影响因素考察 由于本实验脂质的组成由提取溶剂决定,故提取溶剂是本实验重要的影响因素,除此之外,在脂质体的制备过程中,药载比也是常见且重要的影响因素。经过前期的因素筛选,我们发现脂质体的制备过程中探头超声的条件会造成粒径及粒子浓度的变化,因此我们对超声过程的时间及功率进行单因素筛选,并对脂质体的粒径及粒子浓度进行测定,观察其变化。
1.7.2 正交试验 为确定脂质体载药的最优条件,以提取溶剂、药脂比、超声条件3个因素设计L9(33)正交试验,通过包封率进行筛选。
1.8 EVO@Lipo的表征
1.8.1 形貌 取EVO@Lipo稀释后将其烘干,喷金镀膜后,使用SEM观察形貌。
1.8.2 粒径、PDI、电位 取EVO@Lipo稀释后采用NTA测定粒径,DLS测定PDI及Zeta电位。
1.8.3 差示扫描量热(DSC)分析 取EVO、Lipo、物理混合物及EVO@Lipo的冻干样品置于坩埚内,测定0~300 ℃的DSC曲线。
1.8.4 傅里叶变换红外光谱(FTIR) 取EVO、Lipo、物理混合物及EVO@Lipo的冻干样品,KBr压片后,在400~4 000 cm-1波数范围内进行扫描分析。
1.9 体外释放度测定
选择膜透析法测定脂质体的体外释放度[3]。释放介质为30%乙醇的PBS溶液(pH 1.2、pH 6.8),精密吸取EVO及EVO@Lipo溶液各3份,置于处理好的透析袋中(Mw=8 000~14 000 Da),密封后置于100 mL释放介质中,在37 ℃,100 r·min-1条件下恒温震荡。分别在0.25、0.5、1、2、4、6、8、12、24 h吸取透析液2 mL,并立即补充等量同温度的释放介质,保持药物释放处于漏槽状态。随后将样品过0.45 μm的滤膜,取续滤液进行含量测定,计算累计释放量Qn和释放百分率F。
式中Cn为第n次取样时的EVO浓度,Ci为第i次取样时的EVO浓度,V0为释放介质体积,Vi为每次取样的体积,W为样品中EVO总量。
1.10 数据分析
2 结果
2.1 EVNs的表征
2.1.1 形貌 如图1所示,提取得到的EVNs形貌为不规则圆球状,粒子大小为200 nm左右。

图1 EVNs的SEM图像
2.1.2 粒径、PDI、Zeta电位 如表1所示,提取的EVNs平均粒径为(230.4±3.3)nm,与SEM图像中的结果一致。
表1 EVNs的粒径、PDI及Zeta电位
2.2 EVO体外分析方法建立
2.2.1 专属性 如图2所示,EVO的HPLC图谱中,脂质体在EVO出峰的位置没有杂峰干扰,表明专属性符合测试要求。
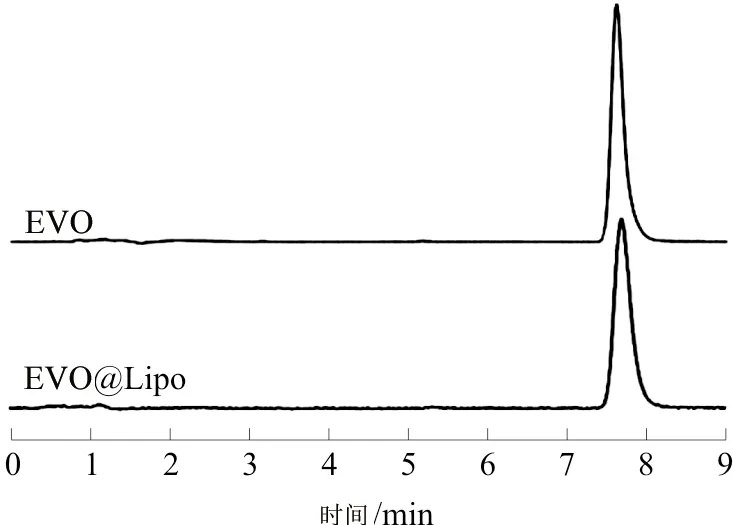
图2 EVO及EVO@Lipo溶液的HPLC图
2.2.2 标准曲线 标准曲线方程为Y=301 768X+81 082,R2=1,EVO在1~100 μg·mL-1峰面积与浓度呈现良好的线性关系。该测定方法及条件下,EVO的精密度重复性、回收率、稳定性均符合要求。在液相条件下未检出EVO,表明其在水中的溶解度极低。
2.3 EVO@Lipo处方工艺筛选
2.3.1 脂质提取溶剂筛选 如表2所示,三氯甲烷、甲醇-三氯甲烷、乙醇-二氯甲烷、二氯甲烷-三氯甲烷组脂质提取率大于5%,其中乙醇-二氯甲烷组提取率接近10%,其余各组脂质提取率均较低。制备得到的空白脂质体粒径均处于100~200 nm,其粒子浓度也处于同一数量级1010。三氯甲烷、乙醇-三氯甲烷、甲醇-三氯甲烷、二氯甲烷、乙醇-二氯甲烷、丙酮-二氯甲烷组粒度RSD值小于0.02。
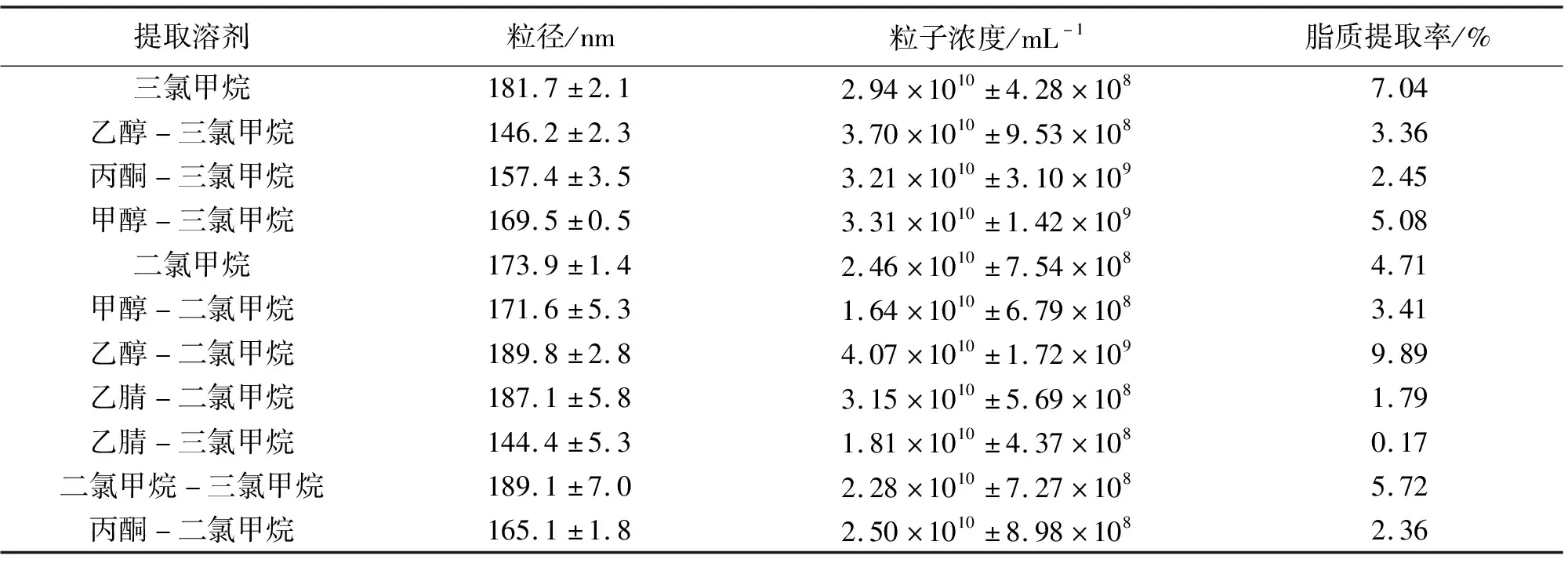
表2 不同提取溶剂下脂质提取率及空白脂质体粒径
综合以上指标的分析,可以优先选用三氯甲烷、甲醇-三氯甲烷、乙醇-二氯甲烷3组进行后续实验,乙醇-三氯甲烷、二氯甲烷、丙酮-二氯甲烷3组作为备选。
2.3.2 超声因素考察 结果见表3~4,当超声时间改变时粒径及粒子浓度变化较大,故选择超声时间为影响因素进行正交试验,超声功率选用60 W。
表3 超声时间对粒径的影响
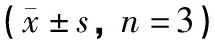
表4 超声功率对粒径的影响
2.3.3 正交试验 以A(脂质提取溶剂),B(药脂比),C(超声时间)为3个因素,进行L9(33)正交试验,见表5。

表5 正交试验因素
从表6中数据可得,极差分析证明,各因素对包封率的影响程度为:B>A>C,最佳实验组合为A2B3C3,即以甲醇-三氯甲烷为脂质提取溶剂,药脂比为1∶50,超声总时长为15 min,经验证,该处方的包封率为88.21%,药物浓度为16.7 μg·mL-1。方差分析结果显示3种因素对包封率的影响不显著(表7)。
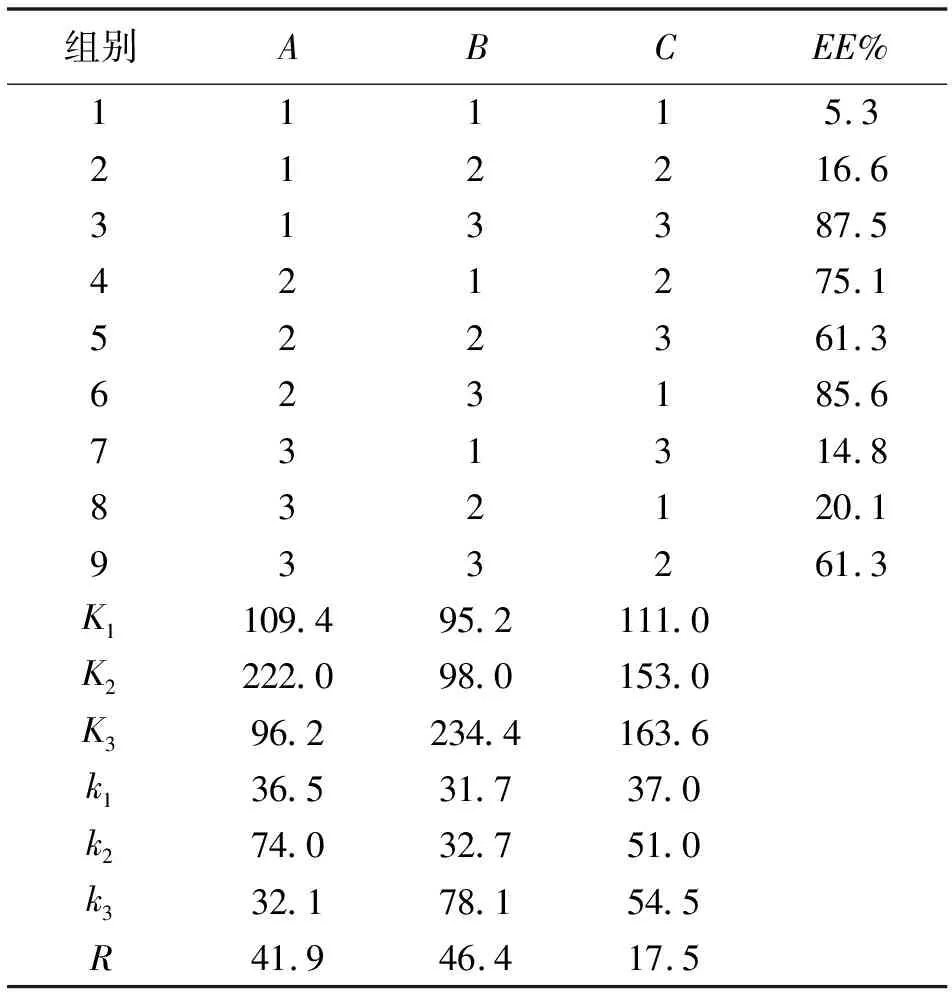
表6 正交试验分组及结果
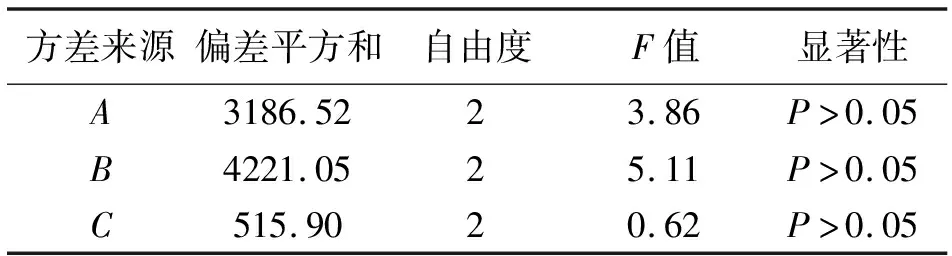
表7 正交试验方差分析
2.4 EVO@Lipo表征
2.4.1 形貌 SEM观察显示,EVO@Lipo的外观呈球形,分散较均匀,无明显聚集现象,粒径约150 nm。见图3。

图3 EVO@Lipo的SEM图像
2.4.2 粒径、PDI、Zeta电位 制备得到的EVO@Lipo平均粒径为(194.9±2.4)nm,PDI为0.22±0.01,证明其均一性良好,Zeta电位为(-35.3±1.16)mV,证明该体系稳定。见表8。
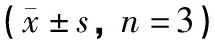
表8 EVO@Lipo的粒径、PDI及Zeta电位
2.4.3 DSC分析 如图4可见,对DSC曲线进行分析,EVO的熔融吸热峰位于286 ℃,Lipo在129 ℃出现吸热峰;二者的物理混合物分别在126 ℃及274 ℃有2个吸热峰,其中EVO吸热峰的偏移可能暗示在加热过程中有新相形成;EVO@Lipo的吸热峰出现在139 ℃,且不存在EVO的吸热峰,证明EVO可能以分子或无定型相态存在。

图4 DSC曲线变化
2.4.4 傅里叶变换红外光谱 如图5所示,EVO的红外光谱图中,3 220 cm-1为N—H的伸缩振动吸收峰,1 700~1 600 cm-1之间的峰为苯环骨架伸缩振动峰,它们是苯环的特征振动,除此之外,1 629 cm-1为C=O的伸缩振动吸收峰;Lipo在3 374 cm-1及2 930 cm-1分别出现O—H伸缩振动及C—H伸缩振动吸收峰;在物理混合物中,1 629 cm-1为EVO的C=O伸缩振动吸收峰,2 931 cm-1为脂质的C—H伸缩振动吸收峰,基本是二者各自图谱的叠加,而在EVO@Lipo中,EVO的N—H伸缩振动吸收峰为3 221 cm-1,C=O伸缩振动吸收峰移动至1 606 cm-1,C—H伸缩振动吸收峰移动至2 941 cm-1,证明EVO与脂质发生了相互作用。
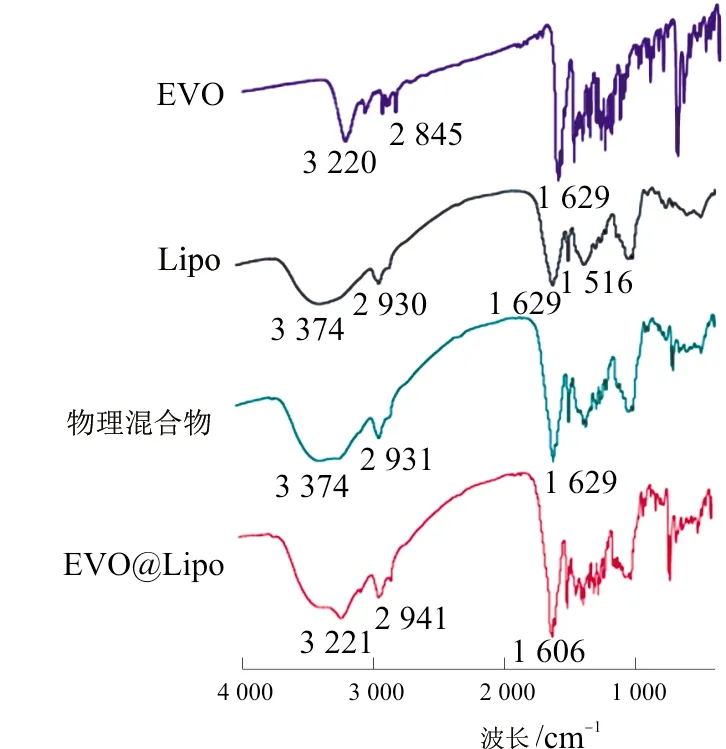
图5 红外图谱变化
2.5 体外释放度实验
如图6所示,当pH为1.2和6.8时,对照品EVO在1 h时释放度均到达50%,2 h时,释放度分别达到76%和85%;而将其制备成脂质体后,在24 h内,其体外释药速度降低,说明将EVO制备成脂质体后,具有一定的缓释作用。
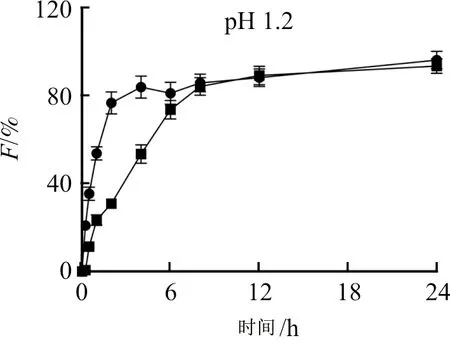
图6 EVO及EVO@Lipo在PBS中的累计释放度
3 讨论
EVNs具有蛋白脂质膜结构,被膜材料包裹的囊腔为活性分子的装载提供了空间,具有广泛的运载能力,可装载亲疏水药物和核酸药物等[8-9]。此外,借助其纳米级特性,EVNs还可以改善药物的渗透性和组织渗透性。EVNs通常以2种方式作为载体,一种是直接使用分离的EVNs进行药物装载,另一种方法是提取EVNs的脂质组分并重新组装,或插入功能基团作为复合载体。目前囊泡类载体的载药方法主要包括共孵育、电穿孔、超声、冻融、皂苷增溶等[17]。除了直接将EVNs用作药物载体,大多数会先提取EVNs的脂质后再进行载药或工程化修饰,该过程去除了蛋白、核酸等水性成分,既有利于减少免疫原性,也避免制备载药制剂过程因有机溶剂的加入导致蛋白等成分的沉淀。
EVO作为一种具有多种药理活性的生物碱类化合物,存在水溶性差,生物利用度低等问题,可采用制剂学手段加以改善。在本文中,我们从生姜EVNs中提取脂质,制备载EVO的脂质体。通过不同提取溶剂的筛选,可以变换处方中的脂质组成,最终制备的载药脂质体能增大EVO的溶解度,并使其在体外缓慢释放,从不同pH条件下的溶出曲线看,EVO的释放并未受pH变化影响。本研究为研发药源性功能载体,以期协同增强EVO的药效提供了参考方法。
