肺腺癌患者组织中circ_0000620的表达和患者化疗耐药的相关性
2022-06-14楚倩王云飞程瑞瑞李萍王华启
楚倩,王云飞,程瑞瑞,李萍,王华启
(郑州大学第一附属医院 呼吸与危重症医学科,河南 郑州 450052)
肺癌是全世界最常见的恶性肿瘤之一,近些年其病死率虽有下降的趋势,但仍超过乳腺癌、前列腺癌和结直肠癌的总和[1]。根据组织病理学形态,肺癌可分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC),NSCLC约占肺癌的85%,根据组织病理学形态又可分为腺癌、鳞癌和大细胞癌等,其中腺癌是NSCLC最常见的类型[2]。由于缺乏早期临床表现,很多肺腺癌患者确诊时已处于疾病的晚期或发生远处转移,错失了手术治疗的最佳时机。近些年来,针对驱动基因突变的靶向治疗和免疫治疗可明显改善患者的预后和生存质量,但对于不存在任何驱动基因突变的晚期肺腺癌患者,化疗仍是此类患者治疗的基石,而含铂的双药化疗仍为一线治疗的标准方案。但临床发现,很多肺腺癌患者在化疗后会出现耐药现象,严重影响疗效和预后[3-6]。铂类药物包括顺铂、卡铂、奈达铂等,可与DNA链交叉连接,造成DNA损伤,破坏DNA复制和转录,诱导细胞凋亡,被认为是NSCLC的主要辅助治疗,也可广泛用于治疗食管癌、膀胱癌、前列腺癌等多种恶性肿瘤[7-8]。然而,铂类药物耐药的出现仍然是NSCLC治疗中的一大挑战,更好地认识NSCLC铂类药物耐药的机制,将为逆转铂类药物耐药和提高NSCLC治疗效果提供理论依据[9],因此研究肺腺癌患者化疗耐药的相关机制已经迫在眉睫。
环状RNA(circular RNA,circRNA)是在转录过程中通过反向剪接形成的一段首尾相接的闭合环状结构[10]。它最早于20世纪70年代在RNA病毒中被发现,当时被认为是“拼接噪音”或转录产物,并未引起人们太多的关注[11]。而近些年的研究表明,circRNA具有多种生物学功能,它既可以与蛋白质相互作用,又可作为“分子海绵”,竞争性结合微小RNA(microRNA,miRNA),阻止miRNA与相应靶基因的3’-非翻译区(3’-untranslated region,3’-UTR)结合,从而调节多种信号转导通路[12-13]。研究发现,circRNA在多种肿瘤组织中异常表达且与患者化疗耐药息息相关。Huang等[14]研究表明circular RNA AKT3是一种潜在的致癌因子,通过作用于相应的信号通路促进胃癌的进展,并且导致其对顺铂耐药,成为潜在的治疗靶点;Shen等[15]研究证实circular RNA Foxo3通过激活信号通路介导膀胱癌的进展,并导致其对紫杉醇类药物耐药;Zhang等[16]研究发现circCELSR1可通过作用于miR-1252靶向调节FOXR2的表达,从而参与乳腺癌化疗耐药过程。
本研究通过circRNA高通量测序等技术筛选出差异表达的circ_0000620,并探讨其在肺腺癌组织和细胞中的表达情况,并且分析其与患者化疗耐药的相关性,为肺腺癌的治疗提供新思路。
1 资料与方法
1.1 一般资料收集2018年1月至2020年1月在郑州大学第一附属医院确诊的120例肺腺癌患者的癌组织及其配对癌旁正常组织,经手术或CT引导下肺穿刺获取组织,标本获得后立即置于液氮中,然后转移至-80℃低温冰箱中保存。其中男73例,女47例,年龄≥55岁者71例,<55岁者49例,化疗耐药者28例,化疗敏感者92例。实体瘤疗效评价标准[17]:完全缓解(complete response,CR),所有肿瘤完全消失;部分缓解(partial response,PR),肿瘤最大径缩小≥30%;病变稳定(stable disease,SD),肿瘤最大径变化介于PR和PD之间;病变进展(progressive disease,PD),肿瘤最大径增加≥20%或者有新转移灶。将CR、PR视为化疗敏感,SD、PD视为化疗耐药。纳入标准:(1)经组织病理学检查确诊为肺腺癌;(2)手术前未接受过放化疗。排除标准:(1)合并其他部位的恶性肿瘤,(2)合并其他基础疾病。本研究经郑州大学第一附属医院伦理委员会批准,所有患者签署知情同意书。
1.2 材料与试剂肺腺癌细胞株A549、PC-9、SPC-A-1、NCI-H1299、NCI-H1395和正常人支气管上皮细胞(normal human bronchial epithelial cell,NHBE)购自上海中科院细胞库;DMEM培养基、胎牛血清、胰蛋白酶购自上海优宁维生物科技股份有限公司;Trizol试剂盒购自美国Invitation公司;逆转录试剂盒、PCR试剂盒、qRT-PCR试剂盒购自美国Promega公司;pGM-T载体、感受态大肠杆菌购自上海索莱宝生物科技有限公司;circ_0000620和内参引物的合成以及测序技术由北京擎科生物科技有限公司提供。
1.3 实验方法
1.3.1 circRNA高通量测序 随机选择化疗耐药组的3对肺腺癌组织和癌旁正常组织的标本,由上海鲸舟基因科技有限公司进行RNA文库制备和circRNA高通量测序,然后用EDGER软件(http://bioconductor.org/)分析这3对标本中circRNA的表达差异,并进行预实验和生物信息分析,筛选出本次研究的目标分子。
1.3.2 细胞培养 使用含体积分数为10%胎牛血清的DMEM完全培养基在37℃、含有体积分数为5%CO2的细胞培养箱中培养A549、PC-9、SPC-A-1、NCI-H1299、NCI-H1395和NHBE细胞。
1.3.3 RNA提取和逆转录 按照产品说明书使用RNA提取试剂盒Trizol提取肺腺癌组织、癌旁组织、肺腺癌细胞株和NHBE细胞的总RNA,再用紫外分光光度计检测所提取RNA的浓度,读取A260和A280处吸光度数值并计算A260与A280的比值,比值在1.7~2.0视为合格。接着按照逆转录试剂盒的说明将提取的RNA逆转录为cDNA。
1.3.4 聚合酶链式反应(polymerase chain reaction,PCR)和实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qRT-PCR)分别以cDNA、基因组DNA为模板,divergent primer、convergent primer为引物,按照PCR试剂盒的说明建立反应体系,程序设定为94℃120 s,94℃30 s,55℃30 s,72℃30 s,35个循环。以cDNA为模板,divergent primer为引物,按照qRT-PCR试剂盒的说明建立反应体系,程序设定为94℃120 s,94℃30 s,55℃30 s,72℃40 s,35个循环,GAPDH为内参基因,用2-△△Ct方法分析结果。引物序列见表1。

表1 引物序列
1.3.5 分子克隆和测序 胶回收以cDNA为模板、divergent primer为引物扩增出的目标产物,然后重组入pGM-T载体,再转化入感受态大肠杆菌,培养转化菌18~24 h,最后挑取阳性转化菌送擎科公司进行测序。
1.4 实验数据的处理使用SPSS 25.0统计软件分析实验结果。计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 circRNA高通量技术筛选靶基因通过circRNA高通量测序技术共筛选出6 587个差异性表达的circRNA,有4 571个上调,2 016个下调,最主要的差异性表达见图1。其中circ_0000620的表达水平上调了8.2倍,位于15号染色体的AAGAB基因上,是由外显子2、3、4、5反向剪切所形成的环状结构。
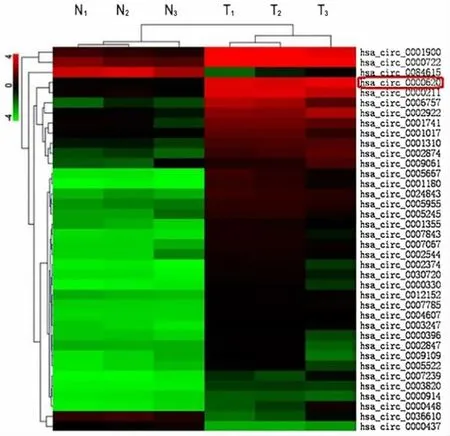
图1 肺腺癌组织及癌旁正常组织中circRNA的表达热图
2.2 circ_0000620 在肺腺癌组织中存在且为circRNA第一,以cDNA和基因组DNA为模板,convergent primer为引物均可扩出143 bp的产物条带,以cDNA为模板,divergent primer为引物,可扩增出361 bp的产物条带,而以基因组DNA为模版,divergent primer为引物则不能扩增出361 bp的产物条带(图2)。第二,利用circBase(http://www.circbase.org/)在UCSC Genome Browser(http://genome.ucsc.edu/)中探索了circ_0000620的形成过程,发现它位于15号染色体上,是由AAGAB基因组的外显子2、3、4、5环化所形成的,并通过测序发现目标产物中存在反向剪接(backsplice junction,BS)位点(图3)。第三,BLAST结果显示:BS位点前的部分序列为AAGAB基因的5号外显子(图4B),BS位点后的部分序列为AAGAB基因的2号外显子(图4A),将包含BS位点的区域进行BLAST,无相关结果(图4C)。
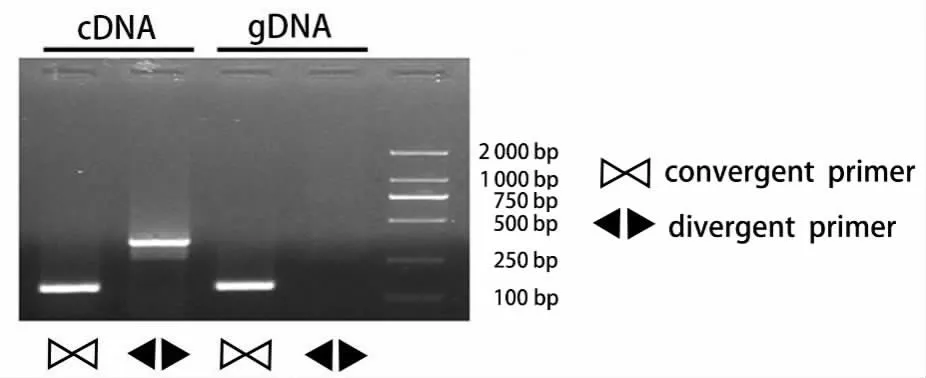
图2 琼脂糖凝胶电泳结果
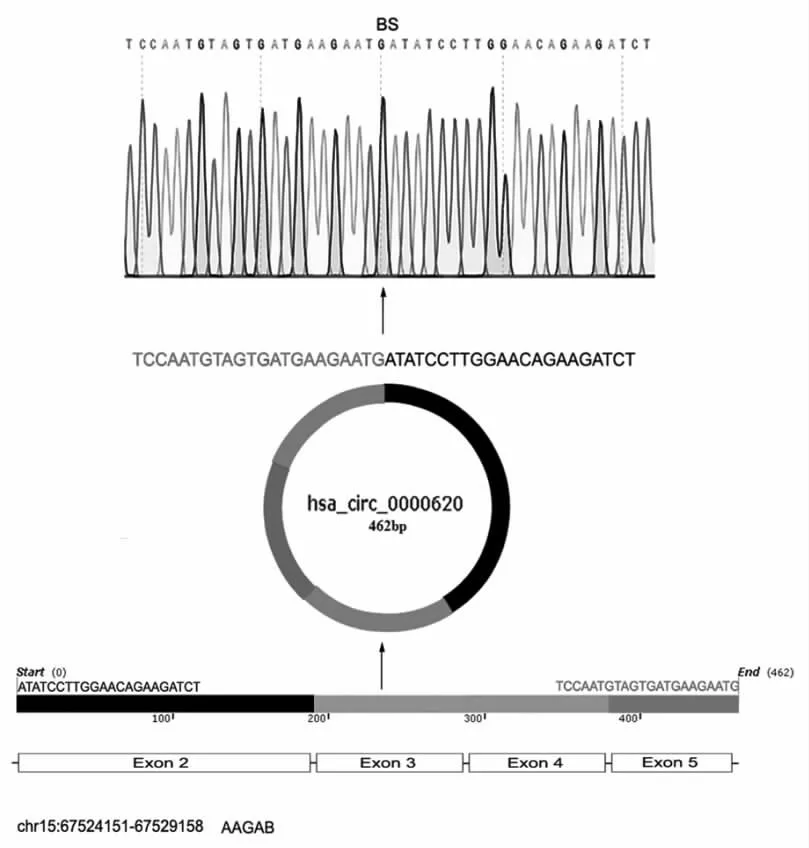
图3 circ_0000620测序结果

图4 BLAST结果
2.3 肺腺癌组织和细胞株中circ_0000620的表达水平肺腺癌组织中circ_0000620的表达水平高于其配对癌旁正常组织,差异有统计学意义(P<0.05)。见图5。肺腺癌细胞株(A549、PC-9、SPC-A-1、NCI-H1299、NCI-H1395)中circ_0000620的表达水平也高于NHBE,差异有统计学意义(P<0.05)。见图6。
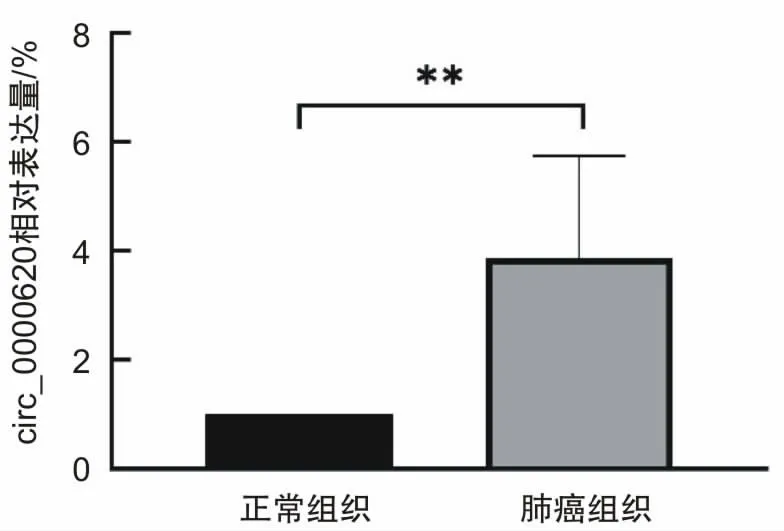
图5 肺腺癌组织与癌旁正常组织中circ_0000620的表达水平

图6 肺腺癌细胞株中circ_0000620的表达水平
2.4 肺腺癌组织中circ_0000620的表达水平与化疗耐药的相关性分析分析28例化疗耐药和92例化疗敏感患者肺腺癌组织中circ_0000620的表达水平,结果显示:化疗耐药组肺腺癌组织中circ_0000620的表达水平高于化疗敏感组,差异有统计学意义(P<0.05)(图7)。不同性别、不同年龄组肺腺癌组织中circ_0000620的表达水平差异无统计学意义(P>0.05)。见图8、9。

图7 肺腺癌组织中circ_0000620的表达水平在化疗敏感组与化疗耐药组中的差异

图8 肺腺癌组织中circ_0000620的表达水平在性别中的差异
图9 肺腺癌组织中circ_0000620的表达水平在年龄中的差异
3 讨论
circRNA属于非编码RNA(non-coding RNA,ncRNA)的一种,可存在于多种哺乳动物的细胞中,虽不直接编码蛋白质,但可在DNA转录、RNA加工和蛋白质翻译水平上调节基因的表达[18]。研究表明,circRNA主要位于细胞核中,由外显子反向剪接所形成的具有BS位点的circRNA,与传统的线性RNA不同,circRNA不具备5’端帽子和3’端的尾巴结构,不易被核酸外切酶RNase R降解,在体内稳定存在,并可竞争性结合miRNA,调控下游靶基因的表达,从而促进包括肺癌在内的多种恶性肿瘤的发生发展[19]。随着高通量测序技术和分子生物学的发展,发现circRNA不仅促进了肿瘤的恶性过程,还与化疗耐药息息相关。例如:Kong等[20]研究表明,hsa_circ_0085131在非小细胞肺癌组织中高表达,用不同浓度的顺铂处理NSCLC细胞和耐药细胞株后,发现hsa_circ_0085131在顺铂耐药的细胞株中高表达,并且通过蛋白质印记等实验表明hsa_circ_0085131可通过影响细胞自噬导致NSCLC对顺铂耐药;Zhao等[21]研究表明,circRNA CDR1as在顺铂耐药的NSCLC细胞株中高表达,并且通过双荧光素酶报告实验证明circRNA CDR1as可与miR-641结合调控HOXA9的表达,从而参与NSCLC化疗耐药过程;Xu等[22]研究表明,circAKT3在肺癌组织和细胞中高表达,并可通过调节miR-516b-5p/STAT3轴介导的糖酵解平衡来抑制肺癌细胞对顺铂的敏感性。
在本研究中,采用circRNA高通量测序技术,发现在化疗耐药的3对癌组织和癌旁组织中circ_0000620的表达显著上调,而circ_0000620在肿瘤组织中的作用还未被报道,因此选择circ_0000620作为研究的目标分子。circ_0000620位于15号染色体上,是由AAGAB基因组的外显子2、3、4、5环化所形成的,并通过divergent primer和测序技术证明了其在肺腺癌组织中存在且为环状。目前,基于铂类的化疗方案仍是非小细胞肺癌患者的基本抗癌策略之一,利用qRTPCR技术发现circ_0000620在肺腺癌组织和细胞株中高表达,并且通过比较不同分组中circ_0000620的表达水平,发现circ_0000620的表达在化疗耐药组水平高于化疗敏感组,而性别、年龄中的差异无统计学意义。关于circ_0000620导致患者化疗耐药的具体作用机制,将在接下来的研究中做出进一步的探讨。
综上所述,circ_0000620在肺腺癌组织中显著高表达,并且在患者化疗耐药组中水平更高,因此,circ_0000620可作为潜在的分子靶点,对提高化疗效果、改善患者的预后和生存质量具有非常重要的意义。
